Abstracts
Résumé
L’énigme immunologique de la grossesse a récemment fait l’objet d’un certain nombre d’avancées significatives. Plusieurs nouveaux concepts ont émergé d’études réalisées dans des modèles de gestation chez la souris, mais également d’observations effectuées chez l’homme. Des mécanismes moléculaires ont été décrits, capables de neutraliser les effets potentiellement néfastes d’effecteurs de la réponse immune maternelle vis-à-vis des cellules trophoblastiques d’origine foetale, présentes aux interfaces foetomaternelles durant la gestation. Les allo-anticorps maternels antipaternels produits pendant la grossesse peuvent ainsi être inhibés, notamment par la production locale de protéines inhibitrices du complément ou par la délétion partielle des cellules B maternelles spécifiques d’allo-antigènes paternels. Les cellules cytotoxiques T CD8+ spécifiques d’allo-antigènes paternels exprimés par le trophoblaste acquièrent un état de tolérance transitoire et réversible envers ces allo-antigènes, ou sont éliminées ou bloquées dans leur prolifération par des molécules immuno-suppressives locales. Les cellules NK (natural killer) utérines ont un potentiel cytotoxique limité, et leurs cellules cibles trophoblastiques potentielles sont résistantes à la lyse. De façon tout à fait inattendue, il vient d’être démontré, chez l’homme, que les interactions entre récepteurs NK utérins et molécules HLA-C du trophoblaste sont, dans la majorité des gestations, non seulement sans effet néfaste, mais au contraire bénéfiques pour le remodelage vasculaire utérin. À l’inverse, les mères n’exprimant pas, ou peu, de récepteurs NK utérins de type KIR activateur (génotype AA) et portant un foetus exprimant des molécules HLA-C du groupe C2 présentent un grand risque de développer une pré-éclampsie, pathologie extrêmement sévère de la grossesse.
Summary
The long-standing question of pregnancy immunological paradox has been generating renewed interest. Recent insights have emerged from studies in pregnant mice and humans demonstrating a number of mechanisms that prevent potentially harmful effects of maternal anti-paternal allo-antibodies (complement inhibition, partial deletion of maternal B cells specific of paternal antigens), cytotoxic CD8+ T cells (lack of HLA-A and HLA-B expression on trophoblast, local immunosuppressive molecules, transient tolerance of paternal allo-antigens specific T cells) and uterine NK cells directed against fetal-derived trophoblast cells (limited NK cytotoxic potential, trophoblast resistance to NK killing). Interestingly, it appears that not only decidual NK cell/trophoblast interactions are not harmful for the fetus but are beneficial for the placental vascularization and its subsequent development. A recent report has indeed demonstrated that during pregnancy most of the combinations of uterine KIR (killer cell immunoglobulin-like receptor) NK cell receptors and fetal HLA-C molecules expressed by trophoblast led to normal pregnancies, whereas mothers lacking activating KIR of the AA genotype when the fetus possessed HLA-C of the C2 group were at a greatly increased risk of severe preeclampsia pathology.
Article body
L’énigme immunologique de la grossesse chez les animaux vivipares - le foetus et ses annexes extra-embryonnaires expriment des molécules d’origine paternelle, normalement reconnues par la mère comme du « non-soi » - a, depuis plusieurs décennies, fait l’objet d’innombrables articles, revues et discussions. Plusieurs avancées significatives ont récemment permis de clarifier un certain nombre de mécanismes moléculaires à l’origine de cette énigme. L’objectif de cette revue est de décrire de façon simplifiée ces découvertes qui, si elles ont été bien souvent effectuées dans des modèles murins, sont très probablement applicables à l’espèce humaine. Le lecteur pourra également se référer à d’autres revues récentes, plus exhaustives, écrites par des experts reconnus du sujet [1-5].
Interfaces foetomaternelles
Chez les espèces vivipares, l’embryon transite dans l’oviducte de la mère, puis se niche et se développe dans l’utérus, où certaines de ses annexes extra-embryonnaires sont alors en contact avec des tissus maternels. Son génome étant pour moitié d’origine paternelle (en cas de dons d’ovocytes, le génome foetal est même totalement allogénique), le foetus peut présenter aux cellules effectrices du système immunitaire maternel des molécules du « non-soi » reconnues comme étrangères par la mère.
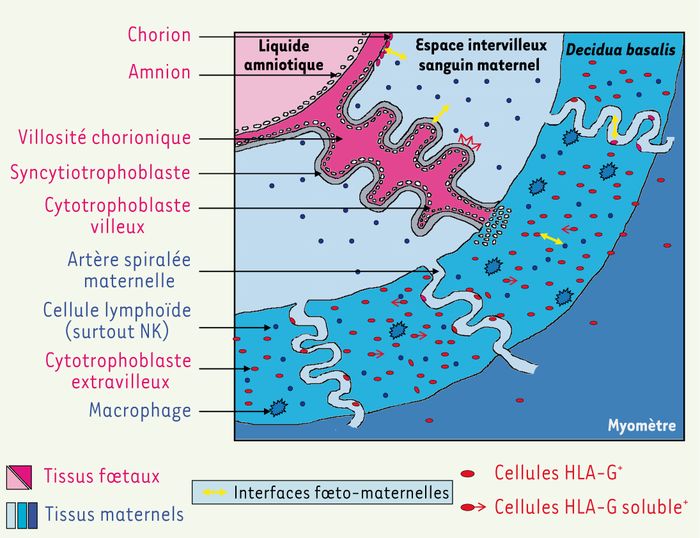
Durant la gestation humaine, le foetus lui-même, baignant dans le liquide amniotique, n’est pas en contact direct avec les tissus maternels. Seules les cellules trophoblastiques, dérivées du trophectoderme, d’origine foetale, sont en contact local direct et continu avec des cellules d’origine maternelle, sanguines ou utérines. Les différents sites d’interaction constituent les interfaces foetomaternelles, au nombre de quatre : interface syncytiotrophoblaste/espace intervilleux sanguin maternel, interface chorion (constitué de cellules du cytotrophoblaste extravilleux)/espace intervilleux sanguin maternel, interface cytotrophoblaste extravilleux (endovasculaire)/sang périphérique des artères spiralées maternelles et interface cytotrophoblaste extravilleux (interstitiel, cellules placentaires géantes)/decidua basalis(Figure 1) [6].
Figure 1
Principales interfaces foetomaternelles pendant la grossesse.
Représentation schématique du placenta humain au cours du premier trimestre de gestation (en rose, tissus d’origine foetale ; en bleu, tissus d’origine maternelle). Seules les cellules trophoblastiques, qui dérivent du trophectoderme et sont donc d’origine foetale, forment une interface avec les cellules d’origine maternelle. Le trophectoderme embryonnaire se différencie en trophoblaste villeux et extravilleux. Le trophoblaste villeux forme les deux couches cellulaires qui tapissent les villosités chorioniques flottant dans l’espace intervilleux sanguin maternel : on distingue le cytotrophoblaste villeux (couche interne) et le syncytiotrophoblaste qui en dérive (couche externe). Les cellules du cytotrophoblaste extravilleux dérivent du cytotrophoblaste villeux provenant des villosités chorioniques ancrées dans la decidua basalis. Elles prolifèrent à la base de ces villosités, puis acquièrent un phénotype invasif qui les font pénétrer profondément à l’intérieur de la decidua basalis et même du myomètre (trophoblaste interstitiel), ainsi que dans les artères maternelles spiralées, où elle vont progressivement remplacer les cellules endothéliales (trophoblaste endovasculaire). Les cellules du trophoblaste extravilleux constituent également la membrane chorionique qui, associée à la membrane amniotique, forment l’enveloppe entourant le liquide amniotique [6]. Les quatre interfaces foetomaternelles - syncytiotrophoblaste/espace intervilleux sanguin maternel, cellules chorioniques/sang de l’espace intervilleux, cytotrophoblaste extravilleux/sang périphérique des artères spiralées maternelles et cytotrophoblaste extravilleux/cellules maternelles de la decidua basalis - sont indiquées par des doubles flèches jaunes.
Les cellules trophoblastiques, dépourvues de molécules HLA de classe II, sont caractérisées par une distribution unique des molécules HLA de classe I. Les cellules du trophoblaste extravilleux, invasives et prolifératives, contrairement à la plupart des cellules somatiques de l’organisme, n’expriment pas les molécules très polymorphes HLA-A et HLA-B [6]. À l’inverse, elles expriment les molécules relativement peu polymorphes HLA-C, ainsi que les molécules HLA de classe I non classiques, non polymorphes, HLA-G (également sous forme soluble), HLA-E et HLA-F. Quant au syncytiotrophoblaste, il est dépourvu de toute expression membranaire de molécules HLA de classe I. Plusieurs groupes ont cependant identifié l’isoforme HLA-G1 soluble (également appelée HLA-G5), sécrétée dans le surnageant de culture du syncytiotrophoblaste en culture primaire [7, 8].
Le syncytiotrophoblaste est en contact avec le sang maternel de l’espace intervilleux qui contient, comme le sang périphérique, les différentes cellules effectrices du système immunitaire maternel : lymphocytes T CD8+, T CD4+, B, cellules NK, monocytes, cellules dendritiques… Les cellules du cytotrophoblaste extravilleux qui forment la membrane chorionique sont également en contact avec le sang maternel de l’espace intervilleux, alors que celles qui ont migré et envahi les artères maternelles spiralées, pour remplacer les cellules endothéliales tapissant leur paroi, sont en contact direct avec le sang périphérique de la mère. Les cellules du trophoblaste extravilleux qui envahissent la decidua basalis sont, quant à elles, en contact avec les mêmes types de cellules du système immunitaire maternel. Toutefois, la distribution de ces cellules maternelles dans la decidua basalis diffère de celle observée dans le sang périphérique : cellules NK (~ 70 %), cellules de type macrophagique CD14+ (~ 20 %), cellules dendritiques (~ 1 %), cellules T CD4+, y compris T régulatrices (~ 10 %), cellules Tγδ, cellules NK tueuses, rares cellules T CD8+ et cellules B.
Lors de la grossesse, le foetus, ou plus exactement les différents types de cellules trophoblastiques, sont donc théoriquement les cibles potentielles des effecteurs humoraux et cellulaires de la réponse immunitaire de la mère. Le foetus doit ainsi faire face à trois types de menaces potentielles provenant de la mère, et spécifiquement dirigées contre des antigènes paternels : les anticorps cytotoxiques fixant le complément, les cellules T CD8+ cytotoxiques et les cellules NK tueuses. En fait, le foetus, en l’absence de toute pathologie ou infection, parvient à déjouer ces différentes menaces par la mise en place de mécanismes moléculaires protecteurs, spécifiques et transitoires.
Menaces et protections mises en place par le foetus
Première menace : les anticorps cytotoxiques maternels antipaternels dirigés contre le trophoblaste
La présence d’allo-anticorps maternels cytotoxiques dirigés contre des molécules HLA de classe I a été mise en évidence chez environ 15 % des primipares et 75 % des multipares. Trois mécanismes principaux ont été décrits qui permettent de prévenir cette menace.
En premier lieu, les cellules trophoblastiques n’expriment pas de molécule HLA de classe II. Cette absence d’expression prévient la stimulation des lymphocytes B (producteurs des anticorps), ainsi que celle des lymphocytes T CD4+ (stimulateurs des cellules B via la sécrétion des interleukines 4, 5 et 10).
Par ailleurs, le placenta humain résiste à la lyse par les anticorps cytotoxiques maternels antipaternels, en inhibant l’activation du complément par des molécules régulatrices. C’est ainsi qu’ont été décrites les protéines MCP, qui s’opposent à la fixation du complément sur les immunoglobulines, et DAF, qui favorisent son inactivation [9]. Certains avortements précoces chez l’homme pourraient ainsi être dus à des défauts d’expression de telles protéines régulatrices du complément. Chez la souris, l’inactivation de la protéine Crry, régulatrice des composants C3 et C4 de la cascade du complément, entraîne 100 % d’avortements, en raison du dépôt de C3 sur les cellules trophoblastiques invasives et de l’inflammation placentaire qui en résulte [10]. L’activation du complément semble donc critique à ce niveau [11].
Enfin, les cellules B maternelles antipaternelles sont partiellement délétées durant la gestation. Des expériences, réalisées chez la souris par le groupe de Colette Kanellopoulos à Paris (France), ont démontré que des cellules maternelles spécifiques d’antigènes foetaux paternels H2-Kk sont partiellement délétées de la rate, du sang périphérique et de la moelle osseuse pendant la seconde moitié de la gestation [12]. La principale cible de cette délétion est la population des lymphocytes B immatures de type IgMbright, B220low, appelées également cellules B transitoires.
Deuxième menace : les cellules T CD8+ cytotoxiques spécifiques d’antigènes d’histocomptabilité de classe I paternels
Une combinaison de plusieurs mécanismes permet au foetus de prévenir cette seconde menace.
En premier lieu, les cellules trophoblastiques n’expriment pas les molécules les plus polymorphes HLA-A et HLA-B [6] qui sont, comme les molécules HLA de classe II, connues pour initier la reconnaissance des allogreffes par l’hôte, et donc leur rejet. Bien que les molécules HLA-C soient également polymorphes (mais à un degré moindre), leur expression à la surface des cellules du trophoblaste extravilleux est faible et les cellules T CD8+ spécifiques de HLA-C sont rarement observées après transplantation.
Par ailleurs, il existe une sécrétion locale de molécules immuno-suppressives, retrouvées localement au niveau des interfaces foetomaternelles et permettant de contrôler l’activité des cellules T, mais également NK : molécules HLA-G solubles, TGFβ, PIBF, enzyme IDO et Fas ligand (CD95L).
Les molécules HLA-G solubles, sécrétées à la fois par le cytotrophoblaste extravilleux et le syncytiotrophoblaste [7], induisent l’apoptose des cellules T CD8+ activées en se fixant spécifiquement sur la molécule CD8 [8, 13], ce qui pourrait expliquer le faible nombre de cellules T CD8+ au niveau de la decidua basalis [14]. Concernant le TGFβ, l’administration d’anticorps anti-TGFβ à des souris inhibe l’implantation embryonnaire [15]. Le PIBF, qui induit la sécrétion de cytokines de type Th2, est quant à lui une protéine anti-abortive, dont l’absence semble être un facteur prédictif d’avortements spontanés précoces [16]. L’expression par certains macrophages de l’enzyme IDO, qui catabolise le tryptophane en réponse à l’interféron γ, résulte en une rapide déplétion du tryptophane et en l’inhibition subséquente de la prolifération des cellules T. Cette enzyme est également exprimée et sécrétée par le syncytiotrophoblaste en contact avec le sang maternel de l’espace intervilleux. Le groupe d’Andrew Mellor (Augusta, GA, États-Unis) a montré que l’inhibition de l’IDO entraîne un dépôt de complément à l’interface foetomaternelle chez la souris, et un rejet médié par les cellules T des conceptus semi-allogéniques, mais pas syngéniques [17] ; un tel type de rejet inflammatoire pourrait également être en partie causé par des cellules T CD4+. Chez des souris déficientes en Fas ligand, normalement exprimé par le trophoblaste, la gestation est associée à une nécrose au niveau des interfaces foetomaternelles, qui entraîne une résorption foetale [18]. Un lien avec les molécules HLA-G solubles a également établi, puisqu’elle induit la production de Fas ligand soluble par les cellules T CD8+ activées, induisant leur apoptose par fixation sur les molécules Fas membranaires [13, 19].
Enfin, il se développe durant la gestation un état de tolérance transitoire des cellules T spécifiques des allo-antigènes paternels, présentes au niveau de l’espace intervilleux et de la decidua basalis. Afin de suivre le devenir des cellules T réactives envers des antigènes paternels chez des souris gestantes, des expériences ont été réalisées dans un modèle de souris transgéniques pour un récepteur aux cellules T (TCR) reconnaissant la molécule H-2Kb. Contrairement aux grossesses syngéniques ou allogéniques n’exprimant pas H-2Kb, les souris portant des conceptus Kb+ ont un nombre réduit de cellules T réactives envers la molécule H2-Kb et acceptent des greffes exprimant la même molécule Kb [20]. La réponse de ces cellules T (rejet de greffes portant Kb) est restaurée après la délivrance. La conclusion de ces résultats est que, durant la gestation, les cellules T maternelles acquièrent un état de tolérance transitoire et réversible envers les allo-antigènes paternels. Une autre étude effectuée chez la souris démontre que des cellules T spécifiques d’antigènes foetaux décroissent en nombre pendant la gestation, ce qui suggère qu’une délétion clonale spécifique pourrait être un mécanisme de tolérance [21].
Troisième menace (ou atout ?) : les cellules NK tueuses
Les lymphocytes NK (de phénotype CD3-/CD56+), présents dans le sang périphérique et les organes lymphoïdes secondaires, sont des effecteurs cellulaires majeurs de l’immunité innée. Leurs fonctions effectrices comprennent à la fois la lyse de cellules cibles exprimant « un soi modifié » (cellules infectées par un virus, cellules tumorales) et la sécrétion de cytokines, notamment antivirales (interféron γ). Ces fonctions effectrices sont déclenchées par l’interaction de leurs récepteurs membranaires activateurs avec leurs ligands spécifiques exprimés à la surface des cellules cibles. Dans un organisme sain, ces fonctions effectrices NK sont contrôlées par des récepteurs inhibiteurs qui préviennent ainsi toute réaction anormale dirigée contre des molécules du soi.
Les cellules NK sont également présentes dans la muqueuse utérine. Après l’implantation embryonnaire, leur nombre croît très rapidement, pour représenter environ 70 % des cellules lymphoïdes présentes dans la decidua basalis. Cette impressionnante proportion de cellules NK à ce niveau n’a pas échappé à Y.W. Loke (Cambridge, Royaume-Uni) qui, le premier, en a perçu l’importance fonctionnelle au cours de la grossesse [22], bien avant que cela ne soit démontré expérimentalement. Le phénotype des cellules NK de la decidua (dNK) diffère de celui des cellules NK du sang périphérique, avec une sous-population majeure CD56bright, cette sous-population étant minoritaire dans le sang périphérique. Les cellules dNK expriment une grande variété de récepteurs, dont certains ligands sont connus et exprimés sur les cellules trophoblastiques (HLA-E, HLA-G, HLA-C) avec lesquelles ils rentrent en contact [23]. C’est le cas des récepteurs CD94/NKG2A (inhibiteur) et CD94/NKG2C (activateur), qui reconnaissent HLA-E, des récepteurs ILT2 et KIR2DL4 (ayant des propriétés activatrices et inhibitrices), reconnus par les formes solubles ou membranaires de HLA-G, et les récepteurs KIR (formes activatrices ou inhibitrices) reconnaissant les molécules HLA-C (voir plus loin). Le récepteur activateur CD160, dont le ligand principal est HLA-C [24], est exprimé par une sous-population minoritaire de dNK [25]. D’autres récepteurs activateurs (NKG2D, NKp30, NKp46) sont également exprimés à la surface de sous-populations de cellules dNK, mais on ne connaît pas encore avec certitude leurs ligands spécifiques ni s’ils sont exprimés par le trophoblaste [26].
Alors qu’on aurait pu penser que ce type cellulaire NK présentait une menace (par lyse cellulaire) pour les cellules trophoblastiques présentes dans la decidua basalis, il n’en est rien.
De fait, la grande majorité des cellules NK de la decidua basalis possède un potentiel cytotoxique contrôlé : d’une part, la sous-population majoritaire de cellules dNK est CD56bright/CD16-, ce qui correspond à un phénotype non cytotoxique (contrairement au phénotype CD56dim/CD16+, majoritaire dans le sang périphérique) ; d’autre part, et toujours à l’inverse des cellules NK du sang périphérique, les cellules dNK ne polarisent pas vers la synapse leurs centres d’organisation microtubulaires et leurs granules contenant de la perforine [27].
Par ailleurs, les cellules trophoblastiques sont résistantes à la lyse. La difficulté d’induire la lyse de cellules cibles trophoblastiques, à la fois par des cellules dNK mais également par des cellules NK du sang périphérique, a effectivement été observée il y a déjà quelques années [28, 29]. L’absence de lyse des cellules du trophoblaste par les cellules dNK pourrait notamment être due à une expression très forte, au cours du premier trimestre de gestation, de la forme active de la molécule XIAP [30] : ce puissant inhibiteur des caspases bloque la cascade apoptotique médiée par Fas dans les cellules trophoblastiques. Quant à l’absence de lyse des cellules trophoblastiques par les cellules NK du sang périphérique, elle pourrait avoir des conséquences fonctionnelles importantes au niveau de l’interface syncytiotrophoblaste/espace intervilleux sanguin maternel.
Un rôle bénéfique pour les cellules dNK
L’interaction spécifique entre récepteurs KIR des cellules NK utérines et molécules HLA-C exprimées à la surface des cellules trophoblastiques exerce un effet bénéfique. Dans une étude récente, Ashley Moffett et ses collaborateurs à Cambridge (Royaume-Uni) ont démontré qu’une certaine combinaison de récepteurs NK maternels KIR (exprimés sur les dNK) et de molécules HLA-C (exprimées à la surface des cellules du trophoblaste extravilleux) pouvait augmenter le risque de pré-éclampsie [31], une pathologie de la grossesse humaine associée à une forte probabilité de mortalité maternelle [32]. Cette pathologie se caractérise notamment par une perfusion sanguine placentaire diminuée, par défaut de transformation des artères maternelles spiralées (défaut d’invasion trophoblastique). Le risque de pré-éclampsie est augmenté chez les mères dont le génotype KIR est de type AA (perte de la plupart des récepteurs de type activateur) et qui portent un foetus homozygote pour les molécules de type HLA-C2 (et donc exprimées à la surface du trophoblaste extravilleux), groupe allélique de HLA-C ayant un résidu lysine 80 qui réagit avec les récepteurs KIR2DL1 et KIRD2S1 [31]. La comparaison de différentes populations ethniques, issues de zones géographiques de différents continents, montre une corrélation statistique inverse entre les fréquences du génotype KIR AA et celles de HLA-C2. Ces observations suggèrent que l’interaction entre les KIR maternels présents sur les dNK avec les molécules HLA-C d’origine paternelle exprimées par le trophoblaste extravilleux a des conséquences fonctionnelles importantes en termes de régulation du développement placentaire, notamment de sa vascularisation.
Une des fonctions possible des cellules dNK pourrait être de contrôler le remodelage vasculaire utérin en début de gestation. Cette hypothèse est fondée sur différentes observations. Les cellules dNK produisent des cytokines impliquées dans le contrôle de l’angiogenèse : angiopoïétine 2, VEGF-C ou PIGF. Des études immunohistochimiques réalisées sur des coupes de decidua basalis de premier trimestre de grossesse ont, quant à elles, montré que les cellules dNK pouvaient être étroitement associées aux artères maternelles spiralées. Par ailleurs, l’engagement du récepteur KIR2DL4 des cellules dNK par son ligand spécifique HLA-G soluble, produit par le trophoblaste extravilleux, entraîne la production par les cellules dNK de médiateurs de type pro-angiogénique, tels que le TNFα, l’IL-1β, l’IL-8 et l’interféron γ [33]. Enfin, l’utilisation de modèles murins déficients en cellules NK a permis au groupe d’Anne Croy (Canada) de démontrer que les cellules NK utérines contrôlaient effectivement le remodelage vasculaire utérin chez des souris gestantes, par l’intermédiaire de la sécrétion d’interféron γ : de fait, les souris déficientes en cellules NK ou en interféron γ présentent des défauts d’implantation embryonnaire, ainsi que des anomalies du remodelage vasculaire utérin aboutissant à la formation de placentas de petite taille [34]. La reconstitution chez de telles souris d’une population de dNK à partir de moelle osseuse de souris SCID, déficientes en cellules T et B, ou l’injection d’interféron ? murin ou humain corrigent largement ces déficits observés, démontrant clairement l’importance fonctionnelle positive des cellules dNK et de leur sécrétion d’interféron γ [35].
Influence des cellules T régulatrices pendant la gestation
Les cellules T régulatrices représentent une sous-population de cellules T CD4+ caractérisée par une forte expression constitutive de la chaîne α du récepteur de l’IL-2 (CD25). Ces cellules, qui représentent environ 5 % à 10 % des cellules T CD4+ périphériques, exercent un effet suppresseur sur les réponses immunitaires spécifiques d’antigènes, et sont donc importantes pour induire une tolérance aux allogreffes et pour la prévention de maladies auto-immunes. Il a récemment été observé chez des souris gestantes une expansion de ces cellules T régulatrices CD4+ CD25+ dans la circulation maternelle, la rate et les ganglions drainants [36]. Cette population cellulaire exercerait un effet suppresseur vis-à-vis d’une réponse de type allogénique dirigée contre le foetus ; de fait, leur absence empêche toute gestation d’aller à son terme. Les cellules T régulatrices inhibent la prolifération de cellules T par stimulation anti-CD3. De la même manière, il a été observé une augmentation du nombre des cellules T régulatrices dans la circulation périphérique des femmes enceintes. Elles ont également été détectées dans la decidua. Leur proportion est significativement diminuée dans la decidua provenant d’avortements spontanés à répétition [37]. Il est intéressant par ailleurs de noter que les cellules T régulatrices induisent la production d’IDO par les cellules dendritiques [38].
Conclusions
Les différentes observations récentes, brièvement décrites dans cet article, démontrent à la fois la mise en place par le foetus de mécanismes moléculaires visant à déjouer spécifiquement des réponses immunitaires de la mère qui pourraient lui être potentiellement néfastes, mais également les conséquences positives, sur le développement placentaire (vascularisation), d’une interaction entre les récepteurs membranaires (voire intracellulaires) maternels (cellules dNK) et les ligands membranaires ou solubles d’origine foetale (trophoblaste). Ces données nouvelles tendent à prouver que les interactions cellules maternelles-cellules trophoblastiques aux différentes interfaces foetomaternelles ont des conséquences fonctionnelles cruciales : les signaux qui en résultent apparaissent à la fois bénéfiques au foetus et à la mère. Les différentes théories immunologiques élaborées au cours des cinq dernières décennies, et qui tentaient d’expliquer le « paradoxe immunologique » de la gestation (self-nonself, missing self, danger hypothesis…), doivent maintenant être revisitées. Bien qu’allogéniques, les cellules trophoblastiques foetales et les cellules immunes maternelles interagissent pour leurs bénéfices réciproques. Dorénavant, la grossesse ne peut donc plus être considérée comme une simple « allogreffe ».
Appendices
Remerciements
L’équipe de Philippe Le Bouteiller est membre du réseau d’excellence européen « EMBIC » (embryo implantation control), dont le coordinateur est Gérard Chaouat.
Références
- 1. Caucheteux SM, Kanellopoulos-Langevin C, Ojcius DM. At the innate frontiers between mother and fetus : linking abortion with complement activation. Immunity 2003 ; 18 : 169-72.
- 2. Chaouat G, Ledee-Bataille N, Dubanchet S, et al. Reproductive immunology 2003 : reassessing the Th1/Th2 paradigm? Immunol Lett 2004 ; 92 : 207-14.
- 3. Ledee-Bataille N. Materno-foetal dialogue and human embryo implantation : some evolving concepts. J Gynecol Obstet Biol Reprod 2004 ; 33 : 564-76.
- 4. Moffett A, Loke YW. The immunological paradox of pregnancy : a reappraisal. Placenta 2004 ; 25 : 1-8.
- 5. Hunt J, Petroff M, McIntire R, et al. HLA-G and immune tolerance in pregnancy. FASEB J 2005 ; 19 : 681-93.
- 6. Le Bouteiller P, Pröll J. Immunologie placentaire : le foetus face à un double défi. Réalités en Gynécologie-Obstétrique 2001 ; 57 : 9-17.
- 7. Morales P, Pace J, Platt J, et al. Placental cell expression of HLA-G2 isoforms is limited to the invasive trophoblast phenotype. J Immunol 2003 ; 171 : 6215-24.
- 8. Solier C, Aguerre-Girr M, Lenfant F, et al. Secretion of pro-apoptotic intron 4-retaining soluble HLA-G1 by human villous trophoblast. Eur J Immunol 2002 ; 32 : 3576-86.
- 9. Holmes C, Simpson K, Okada H, et al. Complement regulatory proteins at the feto-maternal interface during human placental development : distribution of CD59 by comparison with membrane cofactor protein (CD46) and decay accelerating factor (CD55). Eur J Immunol 1992 ; 22 : 1579-85.
- 10. Xu C, Mao D, Holers VM, et al. A critical role for murine complement regulator crry in fetomaternal tolerance. Science 2000 ; 287 : 498-501.
- 11. Girardi G, Bulla R, Salmon JE, et al. The complement system in the pathophysiology of pregnancy. Mol Immunol 2006 ; 43 : 68-77.
- 12. Aït-Azzouzene D, Gendron M, Houdayer M, et al. Maternal B lymphocytes specific for paternal histocompatibility antigens are partially deleted during pregnancy. J Immunol 1998 ; 161 : 2677-83.
- 13. Contini P, Ghio M, Poggi A, et al. Soluble HLA-A,-B,-C and -G molecules induce apoptosis in T and NK CD8+ cells and inhibit cytotoxic T cell activity through CD8 ligation. Eur J Immunol 2003 ; 33 : 125-34.
- 14. Pröll J, Bensussan A, Goffin F, et al. Tubal versus uterine placentation : similar HLA-G expressing extravillous cytotrophoblast invasion but different maternal leukocyte recruitment. Tissue Antigens 2000 ; 56 : 479-91.
- 15. Slager HG, Van Inzen W, Freund E, et al. Transforming growth factor-beta in the early mouse embryo : implications for the regulation of muscle formation and implantation. Dev Genet 1993 ; 14 : 212-24.
- 16. Szekeres-Bartho J, Barakonyi A, Par G, et al. Progesterone as an immunomodulatory molecule. Int Immunopharmacol 2001 ; 1 : 1037-48.
- 17. Mellor AL, Munn DH. Tryptophan catabolism prevents maternal T cells from activating lethal anti-fetal immune responses. J Reprod Immunol 2001 ; 52 : 5-13.
- 18. Hunt JS, Vassmer D, Ferguson TA, et al. Fas ligand is positioned in mouse uterus and placenta to prevent trafficking of activated leukocytes between the mother and the conceptus. J Immunol 1997 ; 158 : 4122-8.
- 19. Fournel S, Aguerre-Girr M, Huc X, et al. Cutting Edge : Soluble HLA-G1 triggers CD95/CD95 ligand-mediated apoptosis in activated CD8+ cells by interacting with CD8. J Immunol 2000 ; 164 : 6100-4.
- 20. Tafuri A, Alferink J, Moller P, et al. T cell awareness of paternal allo-antigens during pregnancy. Science 1995 ; 270 : 630-3.
- 21. Jiang S, Vacchio M. Multiple mechanisms of peripheral T cell tolerance to the fetal allograft. J Immunol 1998 ; 160 : 3086-90.
- 22. Loke YW, King A, Burrows TD. Decidua in human implantation. Hum Reprod 1995 ; 10 Suppl 2 : 14-21.
- 23. Tabiasco J, Rabot M, Aguerre-Girr M, et al. Human decidual NK cells : unique phenotype and functional properties: a review. Placenta 2006 ; 27(suppl 1) : 34-9.
- 24. Le Bouteiller P, Barakonyi A, Giustiniani J, et al. Engagement of CD160 receptor by HLA-C is a triggering mechanism used by circulating natural killer (NK) cells to mediate cytotoxicity. Proc Natl Acad Sci USA 2002 ; 99 : 16963-8.
- 25. Rabot M, Tabiasco J, Polgar B, et al. HLA Class I/NK cell receptor interaction in early human decidua basalis : possible functional consequences. Chem Immunol Allergy 2005 ; 89 : 72-83.
- 26. Koopman L, Kopcow H, Rybalov B, et al. Human decidual natural killer cells are a unique NK cell subset with immunomodulatory potential. J Exp Med 2003 ; 198 : 1201-12.
- 27. Kopcow HD, Allan DS, Chen X, et al. Human decidual NK cells form immature activating synapses and are not cytotoxic. Proc Natl Acad Sci USA 2005 ; 102 : 15563-8.
- 28. Avril T, Jarousseau AC, Watier H, et al. Trophoblast cell line resistance to NK lysis mainly involves an HLA class I-independent mechanism. J Immunol 1999 ; 162 : 5902-9.
- 29. Chumbley G, King A, Robertson K, et al. Resistance of HLA-G and HLA-A2 transfectants to lysis by decidual NK cells. Cell Immunol1994 ; 155 : 312-22.
- 30. Straszewski-Chavez S, Abrahams V, Funai E, et al. X-linked inhibitor of apoptosis (XIAP) confers human trophoblast cell resistance to Fas-mediated apoptosis. Mol Hum Reprod 2004 ; 10 : 33-41.
- 31. Hiby SE, Walker JJ, O’Shaughnessy K M, et al. Combinations of maternal KIR and fetal HLA-C genes influence the risk of preeclampsia and reproductive success. J Exp Med 2004 ; 200 : 957-65.
- 32. Redman CW, Sargent IL. Latest advances in understanding preeclampsia. Science 2005 ; 308 : 1592-4.
- 33. Rajagopalan S, Bryceson YT, Kuppusamy SP, et al. Activation of NK Cells by an endocytosed receptor for soluble HLA-G. PLoS Biol 2006 ; 4 : e9.
- 34. Croy BA, He H, Esadeg S, et al. Uterine natural killer cells : insights into their cellular and molecular biology from mouse modelling. Reproduction 2003 ; 126 : 149-60.
- 35. Guimond MJ, Wang B, Croy BA. Engraftment of bone marrow from severe combined immunodeficient (SCID) mice reverses the reproductive deficits in natural killer cell-deficient tg epsilon 26 mice. J Exp Med 1998 ; 187 : 217-23.
- 36. Aluvihare VR, Kallikourdis M, Betz AG. Regulatory T cells mediate maternal tolerance to the fetus. Nat Immunol 2004 ; 5 : 266-71.
- 37. Sasaki Y, Sakai M, Miyazaki S, et al. Decidual and peripheral blood CD4+CD25+ regulatory T cells in early pregnancy subjects and spontaneous abortion cases. Mol Hum Reprod 2004 ; 10 : 347-53.
- 38. Fallarino F, Grohmann U, Hwang KW, et al. Modulation of tryptophan catabolism by regulatory T cells. Nat Immunol 2003 ; 4 : 1206-12.
List of figures
Figure 1
Principales interfaces foetomaternelles pendant la grossesse.
Représentation schématique du placenta humain au cours du premier trimestre de gestation (en rose, tissus d’origine foetale ; en bleu, tissus d’origine maternelle). Seules les cellules trophoblastiques, qui dérivent du trophectoderme et sont donc d’origine foetale, forment une interface avec les cellules d’origine maternelle. Le trophectoderme embryonnaire se différencie en trophoblaste villeux et extravilleux. Le trophoblaste villeux forme les deux couches cellulaires qui tapissent les villosités chorioniques flottant dans l’espace intervilleux sanguin maternel : on distingue le cytotrophoblaste villeux (couche interne) et le syncytiotrophoblaste qui en dérive (couche externe). Les cellules du cytotrophoblaste extravilleux dérivent du cytotrophoblaste villeux provenant des villosités chorioniques ancrées dans la decidua basalis. Elles prolifèrent à la base de ces villosités, puis acquièrent un phénotype invasif qui les font pénétrer profondément à l’intérieur de la decidua basalis et même du myomètre (trophoblaste interstitiel), ainsi que dans les artères maternelles spiralées, où elle vont progressivement remplacer les cellules endothéliales (trophoblaste endovasculaire). Les cellules du trophoblaste extravilleux constituent également la membrane chorionique qui, associée à la membrane amniotique, forment l’enveloppe entourant le liquide amniotique [6]. Les quatre interfaces foetomaternelles - syncytiotrophoblaste/espace intervilleux sanguin maternel, cellules chorioniques/sang de l’espace intervilleux, cytotrophoblaste extravilleux/sang périphérique des artères spiralées maternelles et cytotrophoblaste extravilleux/cellules maternelles de la decidua basalis - sont indiquées par des doubles flèches jaunes.