Abstracts
Résumé
Après deux décennies de découvertes et de controverses, la paléogénétique semble, sinon avoir atteint l’âge de raison, du moins avoir délaissé les frasques de son impétueuse jeunesse. Si ses principes théoriques ont été à peine affinés en quinze ans, sa pratique opérationnelle a, elle, rapidement évolué, en bénéficiant de l’explosion méthodologique de la biologie moléculaire. C’est véritablement avec l’avènement de la méthode d’amplification de l’ADN par PCR que ce champ d’étude a pris son essor. Dès 1989, les travaux se multipliaient en s’intéressant à des groupes biologiques animaux et végétaux variés : espèces récemment éradiquées par l’homme (ratites), représentants disparus de la période glaciaire (mammouth laineux) ou, encore, espèces domestiques (cochon) définirent les entités qui restent aujourd’hui les cibles favorites de ces études. Les champs d’application se sont également multipliés, afin de mieux cerner l’évolution des espèces, des populations et des génomes : génétique des populations, phylogénie d’espèces, domestication, migration de populations, paléopathologie, paléogénomique et évolution moléculaire s’offrent désormais à une discipline décidément en plein essor.
Summary
Twenty years after the advent of ancient DNA studies, this discipline seems to have reached the maturity formerly lacking to the fulfilment of its objectives. In its early development paleogenetics, as it is now acknowledged, had to cope with very limited data due to the technical limitations of molecular biology. It led to phylogenetic assumptions often limited in their scope and sometimes non-focused or even spurious results that cast the reluctance of the scientific community. This time seems now over and huge amounts of sequences have become available which overcome the former limitations and bridge the gap between paleogenetics, genomics and population biology. The recent studies over the charismatic woolly mammoth (independent sequencing of the whole mitochondrial genome and of millions of base pairs of the nuclear genome) exemplify the growing accuracy of ancient DNA studies thanks to new molecular approaches. From the earliest publications up to now, the number of mammoth nucleotides was multiplied by 100,000. Likewise, populational approaches of ice-age taxa provide new historical scenarios about the diversification and extinction of the Pleistocene megafauna on the one hand, and about the processes of domestication of animal and vegetal species by Man on the other. They also shed light on the differential structure of molecular diversity between short-term populational research (below 2 My) and long-term (over 2 My) phylogenetic approaches. All those results confirm the growing importance of paleogenetics among the evolutionary biology disciplines
Article body
Ambitions passées et avancées actuelles
Quand furent publiées au milieu des années 80 les deux premières séquences d’ADN ancien, respectivement celle d’une momie humaine vieille de 2 400 ans [1] et celle d’un quagga taxidermisé (équidé proche du zèbre disparu au cours du xixe siècle) [2], l’enthousiasme de la communauté scientifique fut extrême. La paléogénétique allait remplir le même rôle à l’égard des phylogénies moléculaires que la paléontologie à l’égard des phylogénies morphologiques : elle offrait l’opportunité rare d’incorporer des représentants historiques réels (et non des hypothèses analytiques) dans la reconstitution de l’histoire des lignées évolutives. Les ambitions portaient même sur l’évolution des gènes au cours du temps et donc sur la possible compréhension de l’évolution des génomes.
Cependant, entre 1990 et 1994, pas moins d’une dizaine de publications spectaculaires paraissent : on prétend tour à tour avoir extrait de l’ADN de végétaux vieux de plusieurs millions d’années [3], d’insectes de l’ère secondaire piégés dans l’ambre [4], et même d’os de dinosaure vieux de 80 millions d’années [5]. Hélas, les vérifications ultérieures discréditeront ces résultats et entacheront durablement la réputation de cette discipline émergente [6-8].
Le spectre de la contamination
En effet, l’efficacité de la méthode de PCR s’est rapidement révélée le plus grave facteur d’erreur d’une recherche dont les praticiens ont parfois cédé aveuglément à leur enthousiasme. Si la sensibilité de la PCR en fait un outil extrêmement puissant pour amplifier l’ADN à partir d’un nombre dérisoire de copies, cette efficacité s’exerce indifféremment sur les molécules d’ADN endogènes aux tissus anciens et sur les molécules exogènes contaminantes, qui les surclassent en nombre et dont l’amplification est consécutivement plus probable.
Aujourd’hui, les cas de contamination n’ont pas disparu, mais la communauté scientifique, échaudée par ces déconvenues, a revu ses exigences à la hausse. Une vérification et un tri plus rigoureux des séquences produites assurent un contrôle plus efficace de leur qualité. La légitimité scientifique doit répondre maintenant à différents critères, des règles propres aux méthodes d’investigation en paléogénétique qui ont été fixées dès le début des années 90 [9,10], comme la reproduction des expérimentations dans des laboratoires différents ou, encore, la cohérence des résultats. Dans les faits, il demeure cependant impossible d’affirmer qu’une séquence d’ADN est issue de molécules endogènes au matériau ancien ; les règles instiguées permettent uniquement d’éliminer une part importante des risques d’erreurs pouvant être commises au cours du processus opératoire. La qualité des séquences produites peut donc être vue comme proportionnelle au degré de stringence des règles adoptées par leurs auteurs.
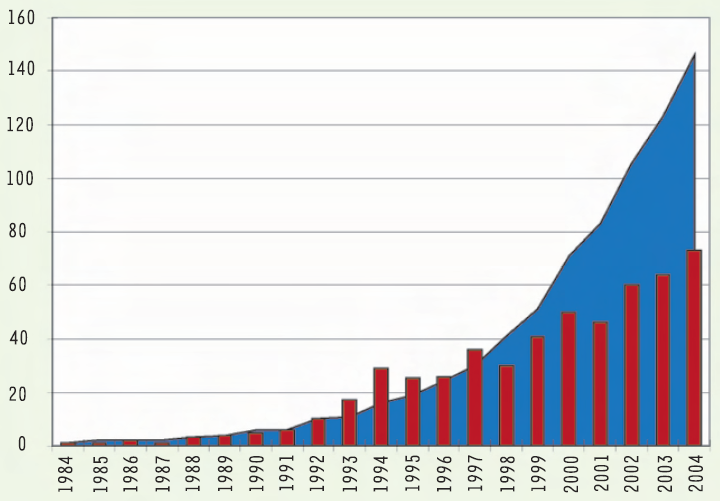
Malgré la rigueur des critères d’authenticité, le nombre de publications au cours des vingt dernières années est en constante augmentation. Ainsi, près de cent cinquante taxons spécifiques différents ont fait l’objet d’au moins une analyse (Figure 1).
Figure 1
Évolution de l’activité en ADN ancien en vingt ans (1984-2004).
Histogrammes : nombre de publications en ADN ancien par an ; courbe : nombre cumulatif d’espèces soumises à des études d’ADN ancien.
Mammouths, Afrique et Asie…
La pertinence des phylogénies moléculaires est le fruit d’un équilibre délicat entre le nombre d’individus (ou d’espèces) et la taille des séquences considérées : plus le nombre de séquences prises en compte est élevé, plus on pourra espérer reconstruire efficacement la phylogénie du groupe d’intérêt. L’apport de séquences anciennes permet parfois de combler des échantillons biologiques dans des groupes qui ont été largement décimés au cours du temps. Néanmoins, augmenter le nombre de séquences ne supprime pas entièrement le problème : les tailles de séquences sont également déterminantes. La plupart des séquences anciennes disponibles jusqu’au début des années 2000 ne comportaient qu’un nombre réduit de sites, qui limitaient la portée des comparaisons avec les taxons actuels.
À cet égard, le cas des mammouths et de leurs relations avec les éléphants actuels est exemplaire de l’apport des séquences anciennes, mais aussi des limites liées à toute utilisation d’une partie seulement du génome. D’un point de vue morphologique, on les associe classiquement aux éléphants d’Asie. Toutefois, les premières séquences d’ADN des mammouths [11] semblaient plutôt les rapprocher des éléphants d’Afrique. Le mammouth laineux a ainsi « joué au yoyo », étant associé, au gré des publications, soit aux éléphants d’Asie [12], soit aux éléphants d’Afrique [13], soit aux deux [14-15]. Au début des années 2000, grâce à des séquences plus nombreuses, à l’affinement des analyses et à la mise en évidence de contaminations dans les jeux de données précédents, l’hypothèse d’un rapprochement entre mammouth et éléphant d’Afrique s’est affirmée [16]. Cependant, la publication du génome mitochondrial complet du mammouth laineux [17] a relancé le débat en multipliant par 10 l’information génétique dont on disposait à propos de cet animal : les relations de parenté inférées à partir de ce génome associent le mammouth laineux aux éléphants d’Asie, conformément aux hypothèses des morphologistes du XIXe siècle. Là encore, pourtant, l’échantillonnage taxinomique demeure très imparfait, l’écrasante majorité des proboscidiens[1] fossiles ne pouvant être intégrée à une phylogénie moléculaire, à l’exception des mastodontes, pour lesquels les données paléogénétiques se limitent, pour le moment, à une séquence douteuse de 230 paires de bases. Cet exemple souligne la nécessité de traiter les fragments d’ADN les plus longs possibles pour le matériel ancien, afin de produire des inférences phylogénétiques robustes. Ce débat, déclenché à propos des ADN modernes au cours des années 90, fait aujourd’hui son chemin parmi la communauté des paléogénéticiens, qui a parfois manqué de recul dans la discussion de la portée phylogénétique des séquences d’ADN ancien, tout exceptionnelles fussent-elles.
Après avoir longtemps été confinée à l’étude de petits fragments d’ADN de spécimens isolés, la paléogénétique affiche aujourd’hui fermement ses ambitions, qui reposent sur l’amélioration constante (au gré des perfectionnements techniques) des données analysées. Qualitativement d’abord, les progrès ont été spectaculaires, du fait de l’amélioration de notre compréhension des mécanismes à l’oeuvre dans la dégradation post-mortem des molécules d’ADN en fonction des conditions du milieu. Quantitativement aussi, et surtout, puisque de fragments uniques de cent à trois cents nucléotides d’ADN mitochondrial, on est passé aujourd’hui à des gènes complets, voire à des génomes mitochondriaux, en mettant notamment à profit la méthode de PCR multiplex [17]. Le génome nucléaire n’est pas en reste, en dépit de la préservation médiocre de ce type d’ADN (présentant une seule copie par cellule, généralement dégradée par les nucléases endogènes) par rapport au génome mitochondrial (plusieurs centaines à plusieurs milliers de ces organites selon le type cellulaire considéré) : des gènes multicopies (protéines histones, [18]) et même simple copie sont désormais étudiés [19]. Bien plus, une approche de paléogénomique récente [20] a permis de séquencer plus de 28 millions de nucléotides du génome du mammouth, soit 100 000 fois plus que l’information disponible il y a quinze ans, et 5 000 fois plus que le contenu total du génome mitochondrial.
Ratites, moas et Nouvelle-Zélande
Les ratites constituent un groupe d’oiseaux terrestres de grande taille, incapables de voler, ayant un long cou et des pattes très puissantes adaptées à la course. Ce groupe comporte 10 espèces actuelles : l’autruche d’Afrique (Struthio camelus), 2 espèces de nandous en Amérique du Sud (Rhea), 3 de casoars (Casuarius) ainsi que l’émeu (Dromaius) en Nouvelle-Guinée et Australie, et 3 espèces de kiwis (Apteryx) en Nouvelle-Zélande.
À ces espèces actuelles, il convient d’ajouter des espèces récemment éteintes (quelques siècles) du fait de l’activité prédatrice humaine : les moas de Nouvelle-Zélande (11 espèces d’herbivores pouvant atteindre 3 m de haut pour 200 kg, et disparus au XVe siècle) et les oiseaux-éléphant de Madagascar (2 espèces, Aepyornis mullerornis et surtout Aepyornis maximus, éteint dans les années 1600).
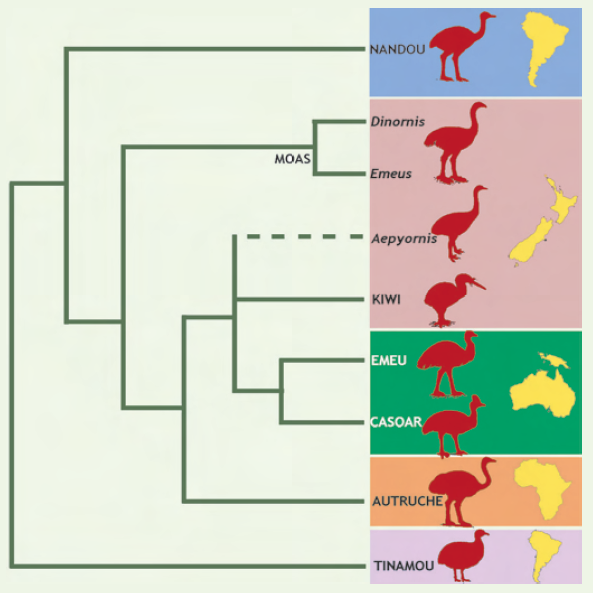
Dès les premières études d’ADN ancien [21] effectuées à partir de 400 pb de l’ARN ribosomique 12S de 4 espèces de moas, la monophylie des moas et des kiwis a été remise en cause, ouvrant des perspectives biogéographiques inédites (Figure 2). Les kiwis apparaissent plus proches des ratites d’Australie, de Nouvelle-Guinée et d’Afrique (autruches, émeus, casoars) que des moas. Les nandous et les moas forment chacun des groupes monophylétiques qui auraient rapidement divergé des autres ratites : les nandous d’Amérique du Sud se seraient séparés en premier, ce qui suggère une origine sud-américaine pour les ratites, hypothèse confirmée par la paléontologie. Par ailleurs, la colonisation de la Nouvelle-Zélande se serait faite par 2 lignées indépendantes d’ancêtres des ratites (moas et kiwis). Ce résultat initial a été confirmé par des études plus récentes et exhaustives [22], incluant le génome mitochondrial complet de deux espèces éteintes de moas, Emeus crassus et Dinornis giganteus.
Figure 2
Phylogénie moléculaire des ratites.
Les recherches en ADN ancien ont bouleversé notre idée de la parenté entre les lignées d’oiseaux aptères de Nouvelle-Zélande, en démontrant que les moas fossiles ne sont pas les plus proches parents des kiwis actuels. Cette hypothèse suppose une colonisation indépendante de l’archipel par ces deux lignées, celle des kiwis ayant atteint cette région secondairement.
Approches populationnelles
Depuis quelques années, l’augmentation des données de séquences a emprunté une autre voie en se focalisant non plus sur un (ou quelques) spécimen(s) isolé(s), mais sur l’échantillon d’individus le plus large et le plus représentatif de l’histoire récente d’une espèce. Les préoccupations de ces analyses, plutôt que la systématique d’un groupe, se concentrent donc sur l’histoire des « populations »[2].
Les représentants de la faune de la période glaciaire en sont des exemples récurrents. Les variations climatiques au cours du pléistocène sont interprétées comme des facteurs importants de vicariance (fragmentation de l’aire de répartition du groupe souche) et de divergence des espèces distribuées dans la zone d’influence glaciaire. Mais les restes actuels de cette faune sont souvent très épars, de sorte que la prise en compte exclusive des populations actuelles ne permet pas de recomposer efficacement leur histoire. C’est notamment le cas pour les bisons [23], les ours bruns [24], les manchots d’Adélie [25] et les moas [26], des espèces qui ont toutes été le sujet d’une analyse phylogéographique incluant plusieurs dizaines de représentants fossiles (respectivement plus de 400, 70, 96 et 125 individus) réparties entre - 150 000 ans et l’époque moderne.
Ces études ont démontré la nature dynamique des phénomènes de colonisation, d’extinction locale et de goulets d’étranglements qui ont produit la structure des populations modernes. Elles ont mis en évidence des trajectoires phylogéographiques beaucoup plus riches et complexes que ne le laissait présager l’examen des données relatives aux populations actuelles. Bouclant la boucle, ces analyses populationnelles apportent en retour des informations déterminantes pour la reconstitution des paléo-environnements.
Domestication animale et végétale
Le choix des espèces traitées dans les approches paléo-populationnelles peut également être orienté pour répondre à d’autres questions, notamment dans le cadre de l’étude de l’histoire de la domestication. La domestication des espèces animales et végétales est interprétée aujourd’hui comme un processus majeur dans la structuration socio-économique de l’homme moderne, depuis les chasseurs-cueilleurs du pléistocène jusqu’à la sédentarisation des fermiers du néolithique.
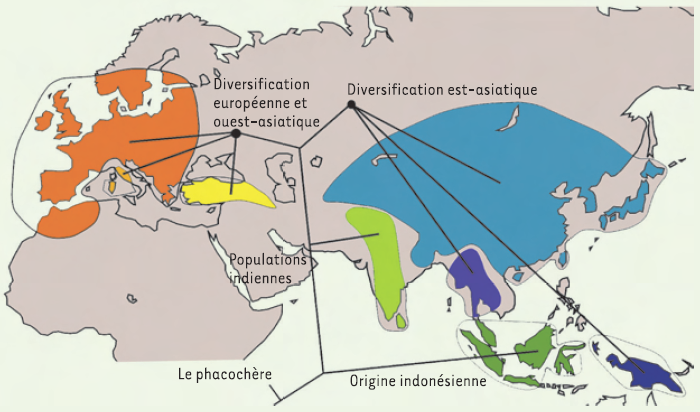
La paléogénétique peut apporter des réponses en relation à la fois avec l’évolution des espèces domestiquées et avec l’histoire des peuplements humains préhistoriques. L’étude du cas du cochon [27] a permis de révéler que cet animal a connu plusieurs phases de domestication en Eurasie, à partir d’un centre de dispersion sur les îles de l’est asiatique (Figure 3). Les données d’ADN ancien nous permettent de dresser un patron géographique : les centres de dispersion et de domestication des espèces sont identifiés, et les éventuelles extinctions de populations, voire d’espèces, sont documentées [28]. Les hypothèses classiques peuvent être testées : dans le cas du cochon, les données paléogénétiques identifient des centres de domestication en nombre bien supérieur aux hypothèses prévalentes, et démontrent que les populations domestiques européennes ne sont pas issues d’une importation de cochons domestiques du Proche-Orient, mais bien de la domestication de porcs européens.
Figure 3
Histoire biogéographique des cochons sauvages et domestiques de l’Ancien Monde.
Cette histoire est largement renseignée par les données génétiques obtenues à partir de spécimens subfossiles et de collection. À partir d’une origine indonésienne, la colonisation Europe-Asie s’est faite de façon séparée en deux ensembles est et ouest (modifié d’après [27]).
Le patron temporel que les données paléogénétiques sous-tendent est avant tout relatif : il permet d’ordonner les événements dans une séquence orientée dans le temps, mais leur datation précise demeure hautement spéculative, du fait de l’imprécision des horloges moléculaires et d’erreurs potentielles à ce niveau d’analyse [29].
Dans tous les cas, l’intégration des données obtenues sur différentes lignées animales et végétales nous renseigne sur les relations historiques entre les populations humaines du quaternaire.
Les études paléogénétiques menées sur les espèces domestiques nous permettent aussi, désormais, d’analyser ces lignées sous l’angle du phénotype. Une étude portant sur le maïs cultivé retrouvé dans un tombeau vieux de 4 400 ans [30] a permis de démontrer qu’il existait déjà, dans le génome de cette variété, des allèles comparables à ceux du maïs moderne pour des marqueurs moléculaires sélectionnés par l’homme dans les variétés cultivées… ce à peine deux mille ans après la domestication du maïs à partir de lignées sauvages de téosinte : après la phase de domestication, la sélection des variétés de maïs pour des traits phénotypiques avantageux s’est donc effectuée très rapidement. Là encore, l’argument biologique rejaillit sur notre connaissance de l’histoire de la lignée humaine.
Perspectives en évolution moléculaire
Le champ d’analyse de l’évolution moléculaire est sans doute celui qui a le moins profité des développements paléogénétiques à ce jour, un état de fait qui, néanmoins, pourrait rapidement changer. De façon inattendue, les analyses menées sur de vastes échantillons paléo-populationnels de la faune glaciaire ont révélé un patron de distribution de la variabilité génétique comparable entre les espèces, avec une accumulation de variants très au-delà des taux de polymorphisme à long terme attendus entre les espèces.
Autant dire que l’équipe d’Alan Cooper qui a dirigé ces études [29] n’est pas loin de remettre en cause la théorie de l’évolution moléculaire neutre de Motoo Kimura. Elle a démontré, de façon indépendante dans plusieurs lignées d’oiseaux et de primates, qu’il est possible de distinguer un taux de mutations à court terme (inférieur à un million d’années) très supérieur au taux de mutations classique, à long terme : une part non négligeable des variants produits à court terme seraient donc secondairement effacés du registre moléculaire. Cela signifierait que, à cette échelle de temps, la part des variants réellement neutres dans l’évolution moléculaire n’est pas aussi écrasante que le laisserait penser la théorie neutraliste : une fraction très importante du polymorphisme serait plutôt faiblement délétère, et succomberait donc au filtre de la sélection. David Penny [31] propose que la courbe en « J » du polymorphisme serait ainsi le fruit de l’élimination différentielle de mutants plus ou moins neutres : l’hécatombe moléculaire se ferait à un rythme d’autant plus rapide que les mutations seraient délétères, des mutants faiblement délétères (« quasi-neutres ») pouvant être maintenus dans les populations naturelles sur une échelle de temps relativement longue. Les mutants véritablement neutres, ignorés par cette hécatombe moléculaire, ne produiraient ainsi que le bruit de fond du polymorphisme des lignées maintenu sur le long terme.
Si les mécanismes à l’origine de cette diversité moléculaire en excès ne sont pas encore identifiés avec certitude, il paraît aujourd’hui invalide d’utiliser les taux d’évolution moléculaire classique à une échelle temporelle très courte. Plus encore, il semble pratiquement impossible de calibrer un taux d’évolution moléculaire pour un temps de divergence inférieur au million d’années : de fait, ce taux varie rapidement au cours de la période considérée, contrairement aux limites théoriques qui lui sont imposées par l’équilibre mutation/dérive dans un modèle de coalescence simple [32], décroissant rapidement jusqu’à atteindre le taux attendu entre espèces séparées au-delà d’un à deux millions d’années.
Conclusions
Malgré les progrès réalisés, la paléogénétique demeure un champ d’investigation extrêmement limité dans les dimensions de l’espace et du temps. Aussi, si certains s’enthousiasment quant à l’éventualité de la recherche d’ADN dans des roches martiennes, ou dans les corps d’insectes momifiés dans l’ambre du crétacé, il est bien peu probable que ces recherches dépassent un jour le niveau de vulgaires effets d’annonces.
En effet, les constats sont là : dans les conditions enregistrées dans l’environnement terrestre depuis l’apparition de la vie, on estime aujourd’hui qu’il est possible de retrouver des fragments amplifiables de macromolécules d’ADN jusqu’à 100 000 ans, voire 1 million d’années, soit durant une fraction de temps qui couvre le dernier 1/5000e (0,0002 %) de l’histoire de la biosphère… une peccadille pour les biologistes évolutionnaires. Néanmoins, si l’on considère que c’est durant cette fraction de temps que l’impact de la lignée humaine a profondément modifié, à tous les niveaux, le macro-écosystème terrestre, on peut s’attendre à ce que la recherche future en ADN ancien continue d’enrichir la vision de notre existence passée.
Appendices
Notes
Références
- 1. Pääbo S. Molecular cloning of ancient Egyptian mummy DNA. Nature 1985 ; 314 : 644-5.
- 2. Higuchi RG, Bowman B, Freiberger M, et al. DNA sequences from the quagga, an extinct member of the horse family. Nature1984 ; 312 : 282-4.
- 3. Golenberg EM, Giannasi DE, Clegg MT, et al. Chloroplast DNA sequence from a Miocene Magnolia species. Nature 1990 ; 344 : 656-8.
- 4. Cano RJ, Poinar HN, Pieniazek NJ, et al. Amplification and sequencing of DNA from a 120-135-million-year-old weevil. Nature 1993 ; 363 : 536-8.
- 5. Woodward SR, Weyand NJ, Bunnel M. DNA sequence from cretaceous period bone fragments. Science 1994 ; 266 : 1229-32.
- 6. Gutierrez G, Marin A. 1998. The most ancient DNA recovered from an amber-preserved specimen may not be as ancient as it seems. Mol Biol Evol 15 : 926-9.
- 7. Austin JJ, Ross AJ, Smith AB, et al. 1997. Problems of reproducibility : does geologically ancient DNA survive in amber-preserved insects ? Proc R Soc B 1997 ; 264 : 467-74
- 8. Hedges SB, Schweitzer MH. Detecting dinosaur DNA. Science 1995 ; 268 : 1191-2
- 9. Austin JJ, Smith AB, Thomas RH. 1997. Palaeontology in a molecular world : the search for authentic ancient DNA. TREE 12 : 303-306
- 10. Willerslev E et Cooper A. Ancient DNA. Proc R Soc B 2005 ; 272 : 3-16.
- 11. Hagelberg E, Thomas MG, Cook Jr CE, et al. DNA from ancient mammoth bones. Nature 1994 ; 370 : 333-4.
- 12. Ozawa T, Hayashi S, Mikhelson VM. Phylogenetic position of mammoth and Steller’s sea cow within Tethytheria demonstrated by mitochondrial DNA sequences. J Mol Evol1997 ; 44 : 406-13.
- 13. Noro M, Masuda R, Dubrovo IA, et al. Molecular phylogenetic inference of the woolly mammoth Mammuthus primigenius, based on complete sequences of mitochondrial cytochrome b and 12S ribosomal genes. J Mol Evol 1998 ; 46 : 314-26.
- 14. Derenko M, Malyarchuk B, Shields GFG. Mitochondrial cytochrome b sequence from a 33000 year-old woolly mammoth (Mammuthus primigenius). Ancient Biomolecules 1997 ; 1 : 149-53.
- 15. Barriel V, Thuet E, Tassy P. Molecular phylogeny of Elephantidae. Extreme divergence of the extant forest african elephant. CR Acad Sci Paris Ser III 1999 ; 322 : 447-54.
- 16. Debruyne R, Barriel V, Tassy P. Mitochondrial cytochrome b of Lyakhov mammoth (Proboscidea, Mammalia) : new data and phylogenetic analyses of Elephantidae. Mol Phylogenet Evol 2003 ; 26 : 421-34.
- 17. Krause J, Dear PH, Pollack JL, et al. Multiplex amplification of the mammoth mitochondrial genome and the evolution of Elephantidae. Nature 2006 ; 439 : 724-7.
- 18. Pineau P, Henry M, Suspène R, et al. PCR amplification from all Metazoan species with a universal primer set from nuclear gene HIST2H4. Mol Biol Evol 2004 ; 22 : 582-8.
- 19. Krajewski C, Buckley L, Westerman M. 1997. DNA phylogeny of the marsupial wolf resolved. Proc R Soc B 264 : 911-7.
- 20. Poinar HN, Schwarz C, Qi J, Shapiro B, et al. Metagenomics to paleogenomics : large-scale sequencing of mammoth DNA. Science 2006 ; 311 : 392-4.
- 21. Cooper A, Mourer-Chauviré C, Chambers GK, et al. Independent origins of New Zealand moas and kiwis. Proc Natl Acad Sci USA 1992 ; 89 : 8741-4.
- 22. Cooper A, Lalueza-Fox C, Anderson S, et al. Complete mitochondrial genome sequences of two extinct moas clarify ratite evolution. Nature 2001 ; 409 : 704-7.
- 23. Shapiro B, Drummond AJ, Rambaut A, et al. Rise and fall of the Beringian steppe bison. Science 2004 ; 306 : 1561-5.
- 24. Barnes I, Matheus P, Shapiro B, et al. Dynamics of pleistocene population extinctions in Beringian brown bears. Science 2002 ; 295 : 2267-70.
- 25. Lambert DM, Ritchie PA, Millar CD, et al. Rates of evolution in ancient DNA from Adélie Penguins. Science 2002 ; 295 : 2270-3
- 26. Baker AJ, Huynen LJ, Haddrath O, et al. Reconstructing the tempo and mode of evolution in an extinct clade of birds with ancient DNA : the giant moas of New Zealand. Proc Natl Acad Sci USA 2005 ; 102 : 8257-62.
- 27. Larson G, Dobney K, Albarella, et al. Worlwide phylogeography of wild boar reveals multiple centers of pig domestication. Science2005 ; 307 : 1618-21.
- 28. Weinstock J, Willerslev E, Sher A et al. Evolution, systematics, and phylogeography of pleistocene horses in the New World : a molecular perspective. PLoS Biol 2005 ; 3 : e241.
- 29. Ho SYW, Phillips MJ, Cooper A, Drummond AJ. Time dependency of molecular rate estimates and systematic overestimation of recent divergence times. Mol Biol Evol 2005 ; 22 : 1561-8.
- 30. Jaenicke-Després V, Buckler ES, Smith BD, et al. Early allelic selection in maize as revealed by ancient DNA. Science 2003 ; 302 : 1206-8.
- 31. Penny D. Evolutionary biology : relativity for molecular clocks. Nature 2005 ; 436 : 183-4.
- 32. Excoffier L. Ce que nous dit la généalogie des gènes. La Recherche 1997 ; 302 : 82-9.
List of figures
Figure 1
Évolution de l’activité en ADN ancien en vingt ans (1984-2004).
Figure 2
Phylogénie moléculaire des ratites.
Les recherches en ADN ancien ont bouleversé notre idée de la parenté entre les lignées d’oiseaux aptères de Nouvelle-Zélande, en démontrant que les moas fossiles ne sont pas les plus proches parents des kiwis actuels. Cette hypothèse suppose une colonisation indépendante de l’archipel par ces deux lignées, celle des kiwis ayant atteint cette région secondairement.
Figure 3
Histoire biogéographique des cochons sauvages et domestiques de l’Ancien Monde.