Abstracts
Résumé
L’oeuvre de Claude Fortier est indissociable de l’histoire de la neuroendocrinologie. À travers ses travaux réalisés à Montréal avec Hans Selye, puis à Québec dans son laboratoire où se sont succédés de très nombreux neuroendocrinologistes réputés, c’est toute la saga de la recherche sur le CRH (corticotropin releasing hormone) et la régulation de l’axe hypothalamo-hypophyso-surrénalien (HPA) ou axe du stress que l’on peut relater. Parmi les travaux pionniers de Claude Fortier, on peut citer la mise en évidence de la rétroaction de l’activité centrale et hypophysaire de l’axe HPA par les glucocorticoïdes et la mise en évidence de récepteurs des glucocorticoïdes et des minéralocorticoïdes réglant distinctement la libération d’ACTH (adrenocorticotropic hormone). On lui doit aussi d’avoir été l’un des précurseurs dans l’utilisation de l’outil informatique en recherche biomédicale. Les retombées de ses découvertes dans les maladies du stress (anxiété, dépression, addiction) sont majeures. Claude Fortier ne fut pas seulement un grand homme de science, dont les travaux et ceux de ses collègues ont été récompensés par de nombreux prix et distinctions, mais il a aussi joué un rôle politique important dans l’organisation de la recherche au Québec dont la qualité est reconnue internationalement.
Summary
The work of Claude Fortier is linked to the history of neuroendocrinology. Through him and his pioneer work in Montreal with Hans Selye, the « Man of stress », and at Laval University in Quebec City in his own laboratory, where all researchers involved in the study of the hypothalamo-hypophysial adrenal axis have been through, it is the whole saga of the search for the neuropeptide CRH (corticotropin releasing factor), and the harsh fight for the Nobel distinction that can be related. Among Claude Fortier’s scientific discoveries, the feedback mechanisms of glucocorticoid hormones on brain and pituitary function, the presence of both mineralo and glucocorticoid receptors in some brain structures, and the introduction of computer science in biomedical research, can be cited. The consequences of these discoveries are illustrated in the pathologies linked to stress (anxiety, depression, addiction). Claude Fortier was not only a great figure in biomedical science, honored by several distinctions, but also an important personality in the policy of research in which he played a prominent role in Quebec medical research and allowed it to rank among the best in the world.
Article body
Cet article se propose de rappeler les travaux pionniers réalisés par le Dr Claude Fortier. Il fut en effet l’un des plus grands neuroendocrinologistes, marquant de son empreinte les débuts de cette discipline scientifique.
Les débuts de la neuroendocrinologie du stress
Le Dr Fortier (tout le monde l’appelait ainsi) naît à Montréal en 1921. Il y poursuit de brillantes études qu’il continue en 1941 en sciences sociales économiques et politiques à l’Université de Montréal.
Des problèmes de santé l’obligent à s’arrêter, en dépit d’une force de caractère exceptionnelle. C’est au cours d’un séjour dans un sanatorium qu’il décide de se lancer dans une nouvelle carrière, la médecine, et plus précisément dans l’étude du lien pouvant exister entre le cerveau et les glandes endocrines.
Il obtient son diplôme de médecin en 1948 puis son doctorat en 1952. Il réalise ce doctorat à l’université de Montréal, dans le laboratoire du Pr Hans Selye, l’homme du stress [1, 2].
L’approche de H. Selye (qui faisait la visite des rats comme un patron le fait pour les patients dans son service hospitalier) essentiellement intuitive, fondée sur l’observation, n’était pas celle de Claude Fortier, scientifique méthodique, dont les idées étaient fondées sur les résultats de l’expérimentation. Il était ferme, solide et énergique, des traits de caractère que l’on retrouve dans les armoiries des Fortier issues d’Antoine Fortier arrivé sur l’Ile d’Orléans en 1663, en provenance de Dieppe.
À partir de là, la carrière de Claude Fortier est comme une quête du Graal à la recherche de facteurs, et plus précisément d’un facteur hypothalamique agissant sur l’axe du stress, le CRF (corticotropin-releasing factor).
Il écrit des articles de neuroendocrinologie qui font référence malgré son jeune âge [3]. Il passe deux années à Londres, de 1953 à 1955, dans le laboratoire de Geoffrey Harris, qui, tout comme Jacques Benoit, soutenait l’existence d’un contrôle humoral ou hormonal de l’hypophyse par l’hypothalamus. Chez G. Harris, il apprend du Maître les approches chirurgicales, que ce dernier maîtrisait parfaitement, et la possibilité de mettre en culture des hypophyses in vitro.
C’est grâce à cette technique et à l’existence d’un dosage biologique mis au point pour l’ACTH que la quête du CRF a commencé [4].
Cette quête n’a pas été des plus calmes comme cela est brillamment relaté dans le livre « la Course au Nobel » [5]. Elle a consisté en une campagne ininterrompue, une suite d’attaques et de contre-attaques entre deux chercheurs, Roger Guillemin et Andrew Schally. La biologie moderne n’a pas connu de lutte plus longue et plus âpre, la bataille ayant commencé à Montréal.
En effet, R. Guillemin arrive en 1948 dans le laboratoire de H. Selye après avoir entendu une conférence donnée par ce dernier à Paris. Claude Fortier est ainsi chargé de diriger les premiers pas de R. Guillemin dans la recherche. Il le prend sous son aile et le fait adhérer à l’hypothèse de G. Harris, qui était loin de faire l’unanimité, et selon laquelle le cerveau pouvait synthétiser des hormones.
R. Guillemin doit aussi au Dr Claude Fortier de lui avoir sauvé la vie. En 1950, à la veille de passer son doctorat, R. Guillemin tombe gravement malade ; il est atteint de méningite tuberculeuse. Les antibiotiques seuls étant inefficaces, Claude Fortier à l’idée d’administrer conjointement de la cortisone, diminuant ainsi l’oedème méningé et permettant aux antibiotiques de mieux agir. Trois mois plus tard, R. Guillemin reprenait son travail.
De l’autre côté de la « montagne » (le Mont Royal à Montréal), se trouvait le laboratoire de Murray Saffran, à l’Université Mc Gill, qui travaillait également sur l’axe du stress. En 1954, arrive un jeune étudiant originaire de Pologne, Andrew Schally, R. Guillemin étant parti une année plus tôt pour créer un laboratoire à Houston (Texas, États-Unis).
C’est en 1955 que la bataille entre R. Guillemin et A. Schally commence, les deux groupes montrant parallèlement que des hypophyses mises en présence d’extraits hypothalamiques, selon la technique mise au point par C. Fortier, pouvaient libérer plus d’ACTH qu’en l’absence d’extrait [6, 7].
De 1955 à 1977, la bataille fut rude. Si le TRF (thyrotropin-releasing factor) (1969), le LRF (luteinizing hormone-releasing factor) (1971) et la somatostatine (1973) avaient été mis en évidence, le CRF était toujours ce Graal introuvable [8].
Il faudra attendre octobre 1981 pour que la structure du CRF devenu CRH (corticotropin-releasing hormone) soit publiée [9].
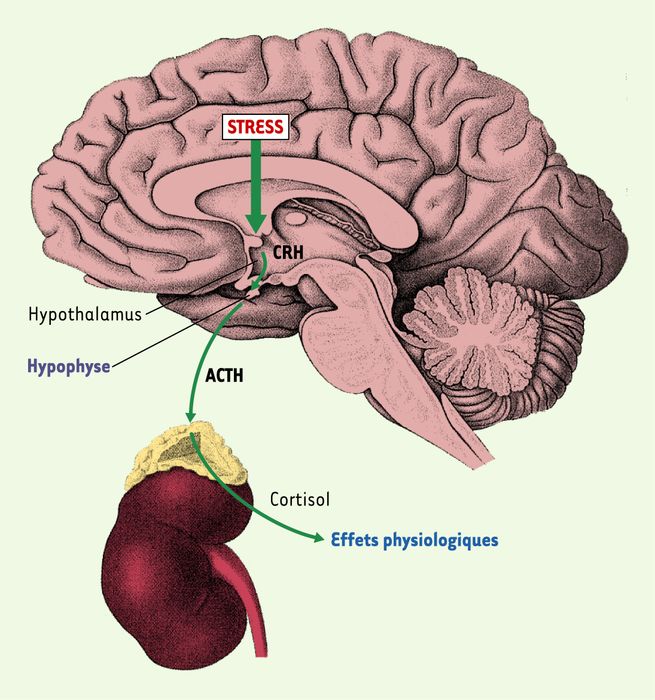
L’axe hypothalamo-hypophyso-surrénalien (HPA) prenait corps grâce aux travaux de tous ces scientifiques, et en particulier de ceux de Claude Fortier. Ainsi le fonctionnement de l’axe HPA est activé principalement par la sécrétion du CRH par l’hypothalamus. Le CRH stimule la sécrétion de l’ACTH par l’hypophyse via des récepteurs membranaires spécifiques localisés sur les cellules corticotropes. L’ACTH libérée dans le sang agit sur les glandes surrénales permettant la libération des glucocorticoïdes (Figure 1). Ces derniers interagissent avec leurs récepteurs nucléaires situés dans de nombreux tissus et organes et règlent, en particulier, le métabolisme énergétique.
Figure 1
L’axe hypothalamo-hypophyso-surrénalien ou axe du stress.
À la suite d’un stress (par exemple, la vue d’une voiture arrivant vers soi), les zones associatives corticales et limbiques (hippocampe et amygdale) du cerveau sont activées et envoient des informations nerveuses vers les neurones hypothalamiques qui synthétisent le CRH (corticotropin-releasing factor), peptide qui va être libéré dans le sang porte hypophysaire qui relie l’hypothalamus à l’hypophyse, où il va agir via des récepteurs spécifiques sur les cellules endocrines fabriquant l’ACTH (adrenocorticotropin hormone). Celle-ci va être à son tour libérée dans le sang pour atteindre une petite glande endocrine située au-dessus du rein, la surrénale, dont la partie corticale (externe) synthétise les corticoïdes, tels que le cortisol. Le cortisol agit sur ses organes cibles comme le système immunitaire ou les muscles dans lesquels il produit des effets métaboliques qui aboutissent, avec la stimulation rapide nerveuse à l’origine d’une libération d’adrénaline et de noradrénaline, à la production de glucose à partir de glycogène, permettant ainsi à nos muscles d’avoir l’énergie suffisante pour éviter la voiture, dans l’exemple donné ci-dessus.
En se fixant sur leurs récepteurs au niveau de l’hypophyse et du cerveau, les glucocorticoïdes peuvent bloquer leur propre sécrétion en agissant sur la libération du CRH et de l’ACTH (phénomène de rétroaction négative).
Stress, corticoïdes et peptides hypothalamiques
La renommée grandissante de Claude Fortier le conduit à créer le premier laboratoire de neuroendocrinologie aux États-Unis, à l’Université Baylor à Houston (Texas), où il retrouve R. Guillemin. Il y développe en particulier un dosage biologique extrêmement sensible de l’ACTH.
De retour au Québec en 1960, on lui demande de mettre sur pied un laboratoire d’endocrinologie à la Faculté de médecine de l’Université Laval à Québec.
Tous les chercheurs qui ont été les pionniers dans les études sur l’HPA ont fait des séjours dans ce laboratoire dont il devient le directeur en 1964.
Auteur de plus de 200 publications scientifiques, Claude Fortier est le pionnier dans le domaine de la neuroendocrinologie au Québec dont on connaît la force aujourd’hui. Ses contributions scientifiques ont permis d’élucider de nombreux aspects de l’interaction entre organes endocrines tels que l’hypothalamus, l’hypophyse, la thyroïde, les surrénales et les gonades [10].
L’idée originale, pour l’époque, d’introduire l’informatique dans le domaine de la recherche biomédicale, non seulement pour la compilation et l’analyse de données expérimentales, mais aussi pour simuler des modèles mathématiques des mécanismes de régulation neuroendocrinienne, est un des grands succès de Claude Fortier [11, 12]. Ainsi, il a pu mettre en évidence dans des systèmes de périfusion in vivo, qu’il a ramenés de son séjour chez G. Harris, l’étroite relation entre la dose de corticostérone et l’inhibition de la libération d’ACTH, démontrant ainsi le phénomène de rétroaction négative des hormones stéroïdes sur la libération d’une hormone hypophysaire [13]. Par des modèles mathématiques, il a également pu montrer que la saturation des sites de liaison de la corticostérone tritiée au niveau hypophysaire était nécessaire à l’inhibition de la libération d’ACTH, alors que des concentrations moins fortes de cette hormone stéroïde, bien que saturantes pour les sites hypothalamiques ou hippocampiques, n’induisaient pas cette inhibition. Ces données ont permis de suggérer la présence de deux types de récepteurs pour la corticostérone, des récepteurs minéralocorticoïdes, saturés à faibles taux plasmatiques de corticoïdes et que l’on trouve par exemple dans l’hypothalamus et l’hippocampe, et des récepteurs glucocorticoïdes qui nécessitent, pour être saturés, de fortes concentrations de corticoïdes dans le sang, comme dans la réponse au stress [14].
Les modèles concernant l’HPA intégraient naturellement la présence du CRH comme régulateur de la sécrétion d’ACTH, même si la structure de celui-ci n’était pas encore connue au moment où ces expériences étaient réalisées dans le laboratoire du Dr C. Fortier.
Par le fait que le CRH était lui-même sous la dépendance des corticoïdes surrénaliens, un champ nouveau de recherche a été ouvert par le Dr Claude Fortier pour étudier les mécanismes intervenant dans les effets des stéroïdes sur les neuropeptides au niveau central.
C’est ainsi qu’a été décrite l’influence des corticoïdes sur la synthèse, le taux et la sécrétion neuronale de CRH [15], de vasopressine [16], du peptide vasoactif intestinal [17] et de la neurotensine [18], ces neuropeptides ayant, comme le CRH, un rôle important dans la réponse au stress.
Stress et maladies
Plusieurs maladies peuvent être liées au stress. Elles ont des conséquences importantes sur notre façon de vivre.
Les modifications de l’HPA participent ainsi au développement de symptômes dépressifs. La dépression se caractérise par une hyperactivité de l’axe HPA qui ressemble à la réponse neuroendocrine au stress. Cette activation ne serait pas un simple épiphénomène de la dépression, mais jouerait plutôt un rôle essentiel dans la pathogénie de la dépression, illustrant ainsi sous un jour nouveau le traitement possible de cette maladie mentale.
Trois aspects mettent en évidence la relation entre stress, dépression et axe HPA : (1) la dépression et ses symptômes principaux que sont l’humeur triste, l’incapacité à éprouver du plaisir et la baisse d’énergie, est une réponse universelle à des événements stressants, en particulier lorsque le stress est chronique ou que la personne n’a aucun contrôle de la situation ; (2) la dépression, lorsqu’elle est sévère, se caractérise, comme nous l’avons rappelé, par des modifications de l’HPA ; (3) les traitements qui modifient la réponse au stress, telles que les thérapies de groupe, ont un effet antidépresseur ; en outre, les antidépresseurs diminuent l’activité HPA [19].
Les modifications de l’HPA chez des personnes en dépression majeure sont tout à fait similaires à celles que l’on peut observer chez des animaux mis en condition de stress chronique. Dans ce cas, on observe non seulement une activation de l’HPA, mais aussi un système de rétroaction négative des glucocorticoïdes déficient, entraînant une libération importante de CRH. Les animaux présentent également un accroissement du volume des surrénales et de l’hypophyse. Ainsi, on peut envisager l’hypothèse selon laquelle l’hyperactivité de l’HPA chez des personnes déprimées pourrait être liée à une diminution du fonctionnement des récepteurs des glucocorticoïdes, ne permettant pas au cortisol circulant dans le sang de produire sa régulation négative sur l’HPA, provoquant ainsi une sorte de « résistance aux glucocorticoïdes » [20]. En accord avec cette idée, les antidépresseurs augmentent l’expression et la fonctionnalité des récepteurs des glucocorticoïdes dans le cerveau, permettant un accroissement de la rétroaction [19]. Comme le dit Charles Nemeroff : « Une façon de voir la dépression est de considérer une réponse au stress mal réglée ».
Pourquoi le stress produisant cette activation de l’HPA indispensable à notre survie induit-il également une conséquence aussi néfaste que la dépression ? La réponse, selon Hans Selye et Claude Fortier, est que la dépression constitue une réponse adaptative [21]. La dépression diminue notre envie de disperser notre énergie vers un but que l’on ne peut atteindre, nous protège, en quelque sorte, contre le comportement agressif des autres par un repli sur soi.
Aujourd’hui, de nombreuses recherches démontrent que l’activation de l’HPA interagit avec des systèmes de neurotransmetteurs tels que la sérotonine, réglant notre comportement. Cette idée trouve des arguments en clinique, puisque la normalisation de l’HPA par les antidépresseurs agissant sur les systèmes sérotoninergiques précède les effets thérapeutiques sur les symptômes dépressifs [19, 20]. Tout l’honneur revient, là encore, aux travaux réalisés dans le groupe de Claude Fortier où il avait pu être montré que des lésions des voies sérotoninergiques avaient des répercussions dramatiques sur les taux et le rythme circadien de la corticostérone observés chez le rat [22].
Un autre exemple de maladie liée au stress (si cette dernière peut être considérée comme une maladie) est l’addiction aux drogues psychostimulantes. Plusieurs travaux récents ont démontré le lien étroit pouvant exister entre état de stress et prise de drogues [23]. L’utilisation de psychostimulants entraîne une augmentation du niveau d’un neurotransmetteur, la dopamine, dans le noyau accumbens, petite structure cérébrale qui sert de relais aux processus émotionnels et hédoniques. Il a été montré que des animaux stressés (changement d’environnement physique ou social, stress prénatal) sont plus demandeurs de drogues psychostimulantes que des animaux témoins. Les corticoïdes libérés pendant le stress peuvent activer le circuit de récompense impliqué dans les processus émotionnels et hédoniques [23]. Parmi les peptides pouvant jouer un rôle dans ce phénomène, la neurotensine a sans doute une place privilégiée. Non seulement elle active l’axe HPA - sa synthèse dans l’hypothalamus est sous la dépendance des corticoïdes - mais elle est également impliquée dans la réponse psychostimulante de la cocaïne [24].
On peut ainsi se rendre compte par ces quelques exemples des retombées, sans doute non soupçonnées par le Dr C. Fortier lui-même, de ses propres découvertes.
L’homme de science, l’homme politique
Les remarquables activités scientifiques du Dr C. Fortier n’ont pas empêché cet homme doté d’une richesse intellectuelle exceptionnelle d’être profondément engagé dans la politique scientifique de son pays. Il devint ainsi, et il en était fier, le premier président francophone de la Société Royale et du Conseil des Sciences du Canada, mêlant sciences et politique (sa première formation). Homme de rigueur, il démissionna en 1981 du Conseil des Sciences du Canada pour protester contre une nomination politique et non scientifique d’un membre de ce Conseil prestigieux.
Son oeuvre fut couronnée par de nombreux prix et par la plus haute distinction donnée à un scientifique du Québec, le Prix du Québec, qu’il reçut en 1972.
Le 22 avril 1986, la neuroendocrinologie mondiale, l’Université Laval, le Québec et le Canada perdaient l’un de ses plus grands scientifiques.
Travailleur acharné, très exigeant pour lui-même, le Dr C. Fortier l’était également pour les autres. Il attendait d’eux la même discipline personnelle et la même rigueur intellectuelle dont il a toujours fait preuve.
Je le cite : « La recherche est la plus jalouse et exigeante des maîtresses et ne saurait tolérer d’infidélité prolongée, ce qui implique que le chercheur doit pouvoir s’y consacrer corps et âme et souvent au détriment de certains devoirs familiaux […]. Sans cependant exagérer dans ce sens, mais je l’imagine idéalement comme un célibataire acétique et continent. J’ai eu le seul mérite d’avoir tenté de faciliter l’apprentissage du dur métier de chercheur à ceux qui sont venus dans mon laboratoire et auxquels je fais rétrospectivement amende honorable pour mes exigences, et dont plusieurs, par l’importance de leur oeuvre scientifique personnelle, iront sans doute beaucoup plus loin que moi dans les voies de la connaissance et de la découverte. Il y a une chose en moi qui ne s’est jamais altérée, c’est ma curiosité, ma capacité d’émerveillement pour l’infinie complexité des mécanismes de la vie. N’est-ce pas là en effet l’objectif ultime du scientifique, qui ne parcourt jamais lui-même qu’une étape plus ou moins négligeable dans l’interminable poursuite du connaissable ? » [25-27].
J’ai eu la chance de travailler avec ce grand pionnier de la neuroendocrinologie.
Appendices
Remerciements
Je voudrais particulièrement remercier le Dr Louise Lafrance et Josée Lalonde (Université Laval) pour leur aide dans la recherche des documents sur Claude Fortier, Véronique Soulier et Antoine Wappler pour l’iconographie.
Références
- 1. Fortier C. Facteurs humoraux et nerveux de la réponse hypophyso-surrénalienne au stress. Acta Neuroveg (Wien) 1952 ; 5 : 55-181.
- 2. Selye H. Stress sans détresse. Montréal : Éditions La Presse, 1974.
- 3. Fortier C. Nervous control of ACTH secretion. In : Harris GW, Donovan BT, eds. The pituitary gland, vol. 2. London : Butterworths, 1966 : 195-234.
- 4. Sayers G, Sayers M. Regulation of pituitary adrenocorticotropic activity during the response of the rat to acute stress. Endocrinology 1947 ; 40 : 265-73.
- 5. Wade N. The Nobel duel : two scientists’ 21-year race to win the world’s most coveted research prize. Garden City-New York : Anchor Press-Doubleday, 1981.
- 6. Guillemin R, Rosenberg B. Humoral hypothalamic control of anterior pituitary. A study with combined tissue cultures. Endocrinology 1955 ; 57 : 599-607.
- 7. Saffran M, Schally AV, Benfey BG. Stimulation of the release of corticotropin from the adenohypophysis by a neurohypophysial factor. Endocrinology 1955 ; 57 : 439-45.
- 8. Wade N, Guillemin R, Shally AV. The years in the wilderness. Science 1978 ; 200 : 279-82.
- 9. Vale W, Spiess J, Rivier C, Rivier J. Characterization of a 41-residue ovine hypothalamic peptide that stimulates secretion of corticotropin and β-endorphin. Science 1981 ; 213 : 1394-7.
- 10. Fortier C, Labrie F, Pelletier G, et al. Recent studies on the feedback control of ACTH secretion, with particular reference to the role of transcortin in pituitary thyroid-adrenocortical interactions. Ciba Foundation Symposium on Control processes in multicellular organisms. Londres : Churchill Ltd, 1970 : 178-209.
- 11. Fortier C, Ardouin P. Statistical programs for the processing of bioassay data by digital computer. Québec : Presses de l’Université Laval, 1963.
- 12. Normand M, Fortier C. Numerical versus analytical integration of hormonal disappearance data. Can J Physiol Pharmacol 1970 ; 48 : 274-81.
- 13. Lemaire I, Dupont A, Bastarache E, et al. Some characteristics of corticosterone uptake by the dorsal hippocampus and the adenohypophysis in the rat. Can J Physiol Pharmacol 1974 ; 52 : 451-7.
- 14. Rotsztejn WH, Normand M, Lalonde J, Fortier C. Relationship between ACTH release and corticosterone binding by the receptor sites of the adenohypophysis and dorsal hippocampus following infusion of corticosterone at a constant rate in the adrenalectomized rat. Endocrinology 1975 ; 97 : 223-30.
- 15. Imaki T, Nahan JL, Rivier C, et al. Differential regulation of corticotropin-releasing factor mRNA in rat brain regions by glucocorticoids and stress. J Neurosci 1991 ; 11 : 585-99.
- 16. Ma XM, Lightman SL, Aguilera G.Vasopressin and corticotropin-releasing hormone gene responses to novel stress in rats adapted to repeated restraint. Endocrinology 1999 ; 140 : 3623-32.
- 17. Rotsztejn WH, Besson J, Briaud B, et al. Effects of steroids on vasocactive intestinal peptide in discrete brain regions and peripheral tissues. Neuroendocrinology 1980 ; 31 : 287-91.
- 18. Rostène W, Alexander J. Neurotensin and neuroendocrine regulation. Front Neuroendocrinol 1997 ; 18 : 115-73.
- 19. Hery F. Interactions entre la fonction corticotrope et la transmission sérotoninergique dans le contexte de la filiation stress, anxiété, dépression. Séminaire de Psychiatrie biologique de l’hôpital Sainte-Anne. Paris : Éditions Rhône-Poulenc, 1999 ; 29 : 5-28.
- 20. Barden N. Regulation of corticosteroid receptor gene expression in depression and antidepressant action. J Psychiatr Neurosci 1999 ; 24 : 25-39.
- 21. Selye H. The general adaptation syndrome and the diseases of adaptation. J Clin Endocrinol Metab 1946 ; 6 : 117-230.
- 22. Rotsztejn WH, Beaudet A, Roberge AG, et al. Role of brain serotonin in the circadian rhythm of corticosterone secretion and the corticotropic response to adrenalectomy in the rat. Neuroendocrinology 1977 ; 23 : 157-70.
- 23. Deroche-Gamonet V, Sillaber I, Aouizerate B, et al. The glucocorticoid receptor as a potential target to reduce cocaine abuse. J Neurosci 2003 ; 23 : 4785-90.
- 24. Betancur C, Cabrera R, De Kloet ER, et al. Role of endogenous neurotensin in the behavioral and neuroendocrine effects of cocaine. Neuropsychopharmacology 1998 ; 19 : 322-32.
- 25. Fortier C. Témoignage et confession d’un scientifique. La Vie Médicale au Canada Français 1973 ; 2 : 193-4.
- 26. Rostène W. Hommage au Docteur Claude Fortier. Med Sci (Paris) 1986 ; 7 : 384.
- 27. Lafrance L. In Memoriam Dr Claude Fortier. Physiol Can 1986 ; 17 : 1-7.
List of figures
Figure 1
L’axe hypothalamo-hypophyso-surrénalien ou axe du stress.
À la suite d’un stress (par exemple, la vue d’une voiture arrivant vers soi), les zones associatives corticales et limbiques (hippocampe et amygdale) du cerveau sont activées et envoient des informations nerveuses vers les neurones hypothalamiques qui synthétisent le CRH (corticotropin-releasing factor), peptide qui va être libéré dans le sang porte hypophysaire qui relie l’hypothalamus à l’hypophyse, où il va agir via des récepteurs spécifiques sur les cellules endocrines fabriquant l’ACTH (adrenocorticotropin hormone). Celle-ci va être à son tour libérée dans le sang pour atteindre une petite glande endocrine située au-dessus du rein, la surrénale, dont la partie corticale (externe) synthétise les corticoïdes, tels que le cortisol. Le cortisol agit sur ses organes cibles comme le système immunitaire ou les muscles dans lesquels il produit des effets métaboliques qui aboutissent, avec la stimulation rapide nerveuse à l’origine d’une libération d’adrénaline et de noradrénaline, à la production de glucose à partir de glycogène, permettant ainsi à nos muscles d’avoir l’énergie suffisante pour éviter la voiture, dans l’exemple donné ci-dessus.