Abstracts
Résumé
Des travaux récents réalisés in vitro montrent que l’appauvrissement du milieu de culture en oxygène (hypoxie) active la réplication du parvovirus humain B19, des virus du sarcome de Kaposi et de l’immunodéficience humaine, ainsi que l’expression de protéines virales oncogènes. Les mécanismes de cette régulation impliquent le plus souvent le facteur cellulaire majeur de réponse à l’hypoxie, HIF-1 (hypoxia inducible factor-1). Le dérèglement de ce facteur de transcription participe également au pouvoir oncogène de certains de ces virus.
Summary
Recent studies show that low oxygen tension levels in cell culture up-regulate the replication of human B19 parvovirus, Kaposi’s sarcoma, and human immunodeficiency viruses as well as the expression of viral oncogenic proteins. The mechanisms of this regulation proceed with the major hypoxia-related factor, HIF-1 (hypoxia inducible factor-1). HIF-1 misregulation is implicated in the oncogenesis potential of some of these viruses.
Article body
La mesure de la pression partielle en oxygène (pO2) dans les tissus humains montre qu’elle est très largement inférieure à celle de l’air que nous respirons. En effet, si la pO2 est de 15 % au niveau des alvéoles pulmonaires, elle n’est que de 4 % dans le foie, de 3 % au niveau de la moelle osseuse et de 2 % au niveau des cellules tubulaires rénales [1, 2]. Ces conditions d’hypoxie relative dans l’organisme correspondent en fait à un état de « normoxie » physiologique puisqu’elles sont compatibles avec le fonctionnement normal des cellules et des tissus in vivo. Ainsi, le développement foeto-placentaire [3] ((→) m/s 2003, n° 11, p.1120), la formation du cartilage par les chondrocytes [4], ou encore la différenciation et la maturation des précurseurs hématopoïétiques [5] ne se réalisent correctement qu’à faible concentration d’oxygène. Notons que la pO2 des étuves dans lesquelles sont incubées les cellules utilisées pour la réplication des virus in vitro est de 20 % et donc bien loin de respecter ces conditions physiologiques.
L’hypoxie tissulaire au sens strict se définit comme une concentration en oxygène inférieure aux valeurs physiologiques et qui ne permet pas de satisfaire aux besoins des tissus [1]. Ces conditions sont décrites, par exemple, au cours d’ischémies lors des angéites [6] ou au sein des tumeurs solides [7].
Réponse cellulaire à l’hypoxie
Les mécanismes impliqués dans la réponse cellulaire à l’hypoxie ont fait l’objet d’un article récent ((→) m/s 2002, n° 1, p. 70) et ne seront rappelés ici que très brièvement (Figure 1) [8]. Le facteur majeur de réponse à l’hypoxie est nommé HIF-1 (hypoxia inducible factor-1). Il s’agit d’un hétérodimère constitué de deux protéines de la famille bHLH-PAS : HIF-1β ou ARNT (aryl hydrocarbon receptor nuclear translocator) et HIF-1α ((→) m/s 1999, n° 12, p. 1379) .
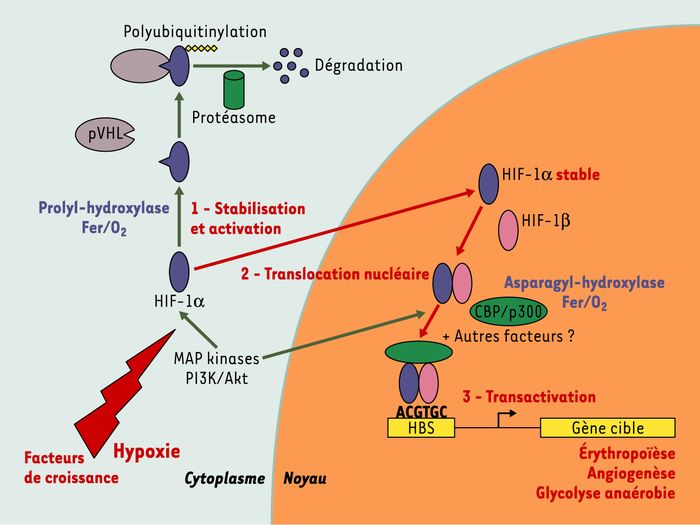
Figure 1
Régulation de l’activité de la protéine HIF-1α par la concentration intracellulaire en oxygène.
La protéine HIF-1α est très instable en présence d’oxygène : elle est rapidement dégradée et sa demi-vie est inférieure à cinq minutes. En effet, une prolyl-hydroxylase hydroxyle un résidu proline de la protéine HIF-1α, ce qui permet son interaction avec la protéine pVHL (von Hippel Lindau) et sa dégradation par le protéasome. En condition d’hypoxie, la prolyl-hydroxylase étant inactive, la protéine HIF-1α est très rapidement stabilisée et migre dans le noyau où elle s’associe à son partenaire HIF-1β. Le complexe ainsi formé recrute d’autres partenaires, en particulier CBP/p300, et se fixe sur la séquence nucléotidique spécifique de reconnaissance du facteur HIF-1 (motif HBS : HIF-binding site) située dans les régions régulatrices des gènes cibles. L’activation de la protéine HIF-1β par l’hypoxie entraîne la synthèse de facteurs protéiques impliqués notamment dans l’érythropoïèse, l’angiogenèse et la glycolyse anaérobie. Le recrutement de CBP/p300 par HIF-1α dans le noyau est également régulé par la tension en oxygène : une asparagyl-hydroxylase va modifier la protéine HIF-1α en présence d’oxygène et empêcher son interaction avec CBP/p300. Notons que de nombreuses autres modifications post-traductionnelles interviennent dans la régulation de l’activité de HIF-1α [26]. Parmi celles-ci, les phosphorylations de HIF-1α et de ses partenaires par les MAP-kinases (mitogen activated protein kinase) et la PI3K (phosphatidylinositol 3-kinase)/Akt sont impliquées dans l’activation de la voie HIF par de nombreux facteurs de croissance, même en condition de normoxie.
C’est la régulation de la stabilité et de l’activité transcriptionnelle de la sous-unité α par la concentration d’O2 intracellulaire qui module l’activité du facteur HIF-1 ((→) m/s 2002, n° 1, p. 70) .
Dès que la tension partielle en oxygène est inférieure à 6 %, la protéine HIF-1α est stabilisée, migre dans le noyau cellulaire et s’associe à son partenaire HIF-1β ; le dimère ainsi formé recrute de nombreux cofacteurs, en particulier CBP/p300. Le complexe transcriptionnel actif va alors se fixer sur un motif spécifique présent dans les régions régulatrices des gènes cibles et nommé HBS (HIF-binding site). Ce motif a pour séquence consensus 5’RCGTG3’ où R est une purine. Cette séquence est retrouvée dans les régions régulatrices de nombreux gènes cellulaires dont l’expression est contrôlée par la tension en oxygène. Elle est ainsi présente dans la région 3’ régulatrice (enhancer) du gène codant pour l’érythropoïétine (Epo) et participe au contrôle de la synthèse de l’Epo par les cellules péritubulaires rénales en réponse à une diminution du taux de l’hémoglobine. Cette séquence est également retrouvée dans le promoteur du gène codant pour le VEGF (vascular endothelial growth factor) et son activation, en hypoxie, participe à la néo-angiogenèse tumorale (pO2 intra-tumorale inférieure à 1 %).
Virus et réponse cellulaire à l’hypoxie
Des études récentes montrent que des virus peuvent interférer avec la voie cellulaire de réponse à l’hypoxie, soit en perturbant la régulation de l’expression d’HIF-1α dans le cas des virus oncogènes, soit en utilisant le facteur de transcription HIF-1 pour augmenter l’expression de leurs gènes (Tableau I).
Protéines virales oncogènes et régulation d’HIF-1α
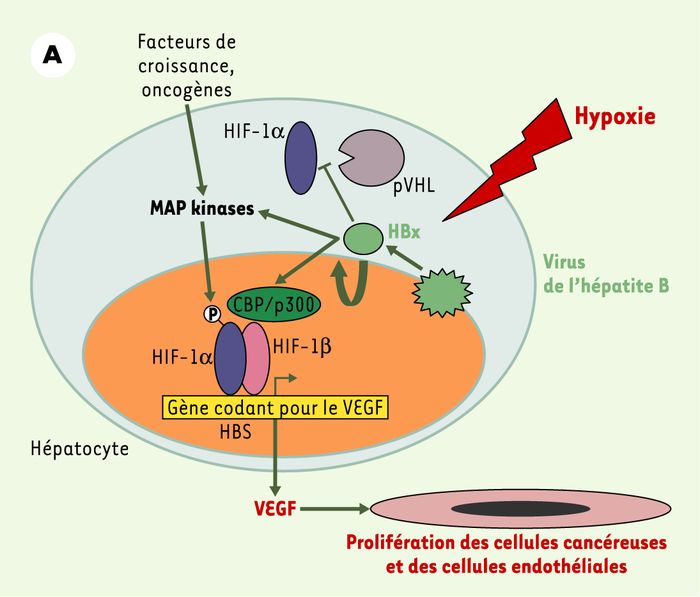
Les protéines virales oncogènes, en activant notamment la voie des MAP-kinases, sont capables de stabiliser et d’activer HIF-1α. Par ce mécanisme, l’oncoprotéine HBx du virus de l’hépatite B participe à la néo-angiogenèse de l’hépatocarcinome en favorisant la production de VEGF [9, 10] (Figure 2A). De plus, HBx interagit directement avec HIF-1α, empêchant ainsi sa dégradation et favorisant son interaction avec ses partenaires transcriptionnels [11]. Notons que la synthèse de HBx est également augmentée dans des conditions d’hypoxie in vitro(Tableau I) [12] et que HBx est capable de stimuler l’activité transcriptionnelle de son propre promoteur in vitro ; cette boucle d’autorégulation amplifie encore la production de facteurs pro-angiogéniques.
Figure 2
Perturbation de la régulation de la protéine HIF-1α par des protéines virales oncogènes.
A.La protéine oncogène HBx produite par le virus de l’hépatite B favorise la stabilisation et l’activation de la protéine HIF-1α en inhibant son interaction avec pVHL, en favorisant son interaction avec CBP/p300 [11] et en activant la voie des MAP-kinases [9, 10]. Le VEGF alors produit stimule la prolifération des cellules cancéreuses et des cellules endothéliales. B. La protéine oncogène membranaire LMP1 produite par le virus d’Epstein-Barr stimule les voies des MAP-kinases et des dérivés réactifs de l’oxygène (ROS), entraînant la stabilisation du facteur HIF-1α et la production de VEGF impliqué dans la prolifération des cellules endothéliales et des cellules épithéliales cancéreuses du nasopharynx [13]. C. La protéine membranaire oncogène couplée aux protéines G, GPCR, produite par le virus HHV8 va activer, en collaboration avec des facteurs de croissance et des oncogènes, la voie des MAP-kinases et de la PI3K/Akt [15]. La protéine HIF-1α ainsi stabilisée va s’associer avec ses partenaires nucléaires et activer la synthèse de VEGF qui va induire la prolifération des cellules tumorales et des cellules endothéliales. Le facteur HIF se fixe également au niveau de sites HBS présents dans les promoteurs viraux et augmente la production de particules virales [16, 17].
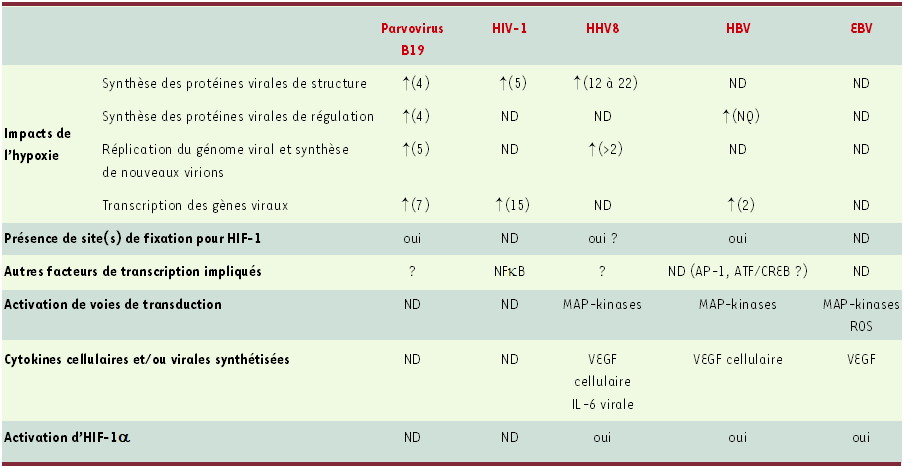
Tableau I
Réplication et expression des virus en hypoxie.
L’activation de certains promoteurs viraux met en jeu la voie de réponse à l’hypoxie assurée par HIF-1α. La présence et la fonctionnalité de sites de fixation pour HIF-1α ont été démontrées dans le génome du parvovirus B19 [19] et du virus herpès humain 8 [16, 17]. L’activation d’HIF-1α est impliquée dans le pouvoir pathogène, en particulier oncogène, des virus herpès humains 8 (HHV8), de l’hépatite B (VHB) et d’Epstein-Barr (EBV) [9-15]. La valeur notée entre parenthèses est le rapport entre les données expérimentales obtenues en conditions d’hypoxie (faibles concentrations d’oxygène) et en conditions habituelles de culture cellulaire (20 % d’oxygène). Les cytokines de l’hôte ou les virokines produites en réponse à l’infection virale sont également présentées dans ce tableau. ND : non déterminé. NQ : non quantifié.
De même, la protéine membranaire LMP1 (latent membrane protein 1) codée par le virus d’Epstein-Barr est susceptible d’activer de nombreuses voies de transduction, en particulier celles des MAP- kinases et des dérivés réactifs de l’oxygène, et ainsi d’augmenter l’expression de HIF-1α in vitro(Figure 2B) [13]. Ce phénomène, reproduit dans un modèle in vitro, pourrait expliquer l’augmentation de l’expression de HIF-1α et de VEGF observée sur des coupes de cancer du nasopharynx, dans lequel la protéine LMP1 est surexprimée [14].
Le génome du virus herpès 8 (HHV8) code pour des protéines qui possèdent de fortes homologies fonctionnelles avec des médiateurs cellulaires. Ainsi, la protéine vGPCR (viral G protein-coupled receptor) présente une homologie importante avec le récepteur cellulaire de l’interleukine-8, chimiokine qui possède des propriétés pro-angiogéniques. Le domaine intra-cytoplasmique de la protéine virale vGPCR s’associe aux protéines G sous-membranaires et active de manière constitutive les kinases intracellulaires, telles que les MAPK p44/p42 et p38, la PI3K/Akt, ainsi que la synthèse de nombreux facteurs de croissance et cytokines [15]. Parmi ceux-ci, on peut citer le VEGF qui permet la prolifération des cellules fusiformes et des cellules endothéliales (Figure 2C). L’activation des kinases cellulaires conduit également à la stabilisation et à la migration nucléaire du facteur HIF-1α ((→) m/s 2002, n° 1, p. 70), ce qui exacerbe encore la synthèse de VEGF au niveau des lésions du sarcome de Kaposi, caractérisées par la prolifération de cellules fusiformes et une angiogenèse importante.
HIF-1 et expression des gènes viraux
Le virus HHV8, outre le fait de perturber l’expression d’HIF, est capable d’utiliser ce facteur de transcription pour optimiser sa réplication. En effet, le génome de ce virus possède de nombreux sites de fixation pour le complexe HIF-1 [16]. En condition d’hypoxie, la fixation de HIF-1 en amont des gènes viraux stimule l’expression des protéines lytiques et structurales du HHV8 ainsi que sa réplication in vitro dans des cellules de lymphome B des séreuses infectées chroniquement (Figure 2C et Tableau I) [17]. Le sarcome de Kaposi se développe plus particulièrement au niveau de la micro-circulation où l’hématocrite, et donc la concentration en oxygène, est très faible. Cet environnement pourrait favoriser d’une part la réplication virale, ainsi que l’expression de protéine(s) oncogène(s), d’autre part la production de facteurs de croissance impliqués dans la prolifération des cellules endothéliales et tumorales.
Le parvovirus humain B19 semble également capable d’utiliser le facteur HIF-1. Ce virus, en infectant et en détruisant les précurseurs érythroïdes, est responsable de crises d’érythroblastopénie aiguë chez les patients atteints de drépanocytose, et de mort foetale in utero par anasarque foeto-placentaire[1]. Des facteurs érythroïdes spécifiques sont probablement mis en jeu, mais ne semblent pas suffisants pour expliquer le tropisme étroit de ce virus particulièrement difficile à cultiver in vitro [18]. Seule l’infection de cellules humaines de la lignée érythroïde permet une réplication, cependant très limitée, du parvovirus B19. Au laboratoire, nous avons pu montrer que la culture de progéniteurs érythroïdes en hypoxie augmente la synthèse et la production des protéines structurales et non structurales du parvovirus B19 [19]. Cette expression virale accrue en situation d’hypoxie s’explique au moins en partie par la fixation du complexe HIF-1 sur un site HBS présent dans le promoteur viral. L’activation de la réplication du parvovirus B19 en hypoxie s’accompagne d’une augmentation significative de la production de particules virales infectieuses (Tableau I). Des études réalisées in vitro et la mesure de la pO2 intramédullaire montrent que la maturation et la différenciation des précurseurs érythroïdes, cibles du parvovirus B19, s’effectuent à faible concentration d’oxygène [5, 20]. L’environnement intramédullaire pauvre en O2 et riche en progéniteurs érythroïdes serait favorable à la réplication du parvovirus B19 et à la production de nombreux virions (1012 particules virales/ml de sérum). L’érythropoïèse inefficace et les complications thrombo-emboliques de la drépanocytose participent à l’hypoxie tissulaire et favorisent probablement la réplication du virus chez ces patients. De même, le développement HIF-dépendant des tissus foetaux [3] ((→) m/s 2003, n° 11, p. 1111) pourrait participer à la sensibilité particulière du foetus à l’infection par le parvovirus B19 (Figure 3).
Figure 3
Activation de la réplication et de l’expression du parvovirus B19 par l’hypoxie.
Après fixation sur son récepteur, l’antigène P de groupe sanguin, et son corécepteur, un complexe d’intégrines, le parvovirus humain B19 libère son génome dans le noyau des progéniteurs érythroïdes. La transcription et la réplication virales sont activées en condition d’hypoxie in vitro, et probablement in vivo puisque la pO2 a été évaluée à moins de 3 % dans la moelle osseuse. Le promoteur viral qui contrôle l’expression de l’ensemble des gènes viraux possède un site HBS situé à 349 paires de bases en amont du site d’initiation de la transcription [19]. Ce site de fixation pour le facteur HIF-1α, en collaboration probablement avec d’autres sites de fixation pour des facteurs de transcription, est impliqué dans l’augmentation de l’expression du parvovirus B19 in vitro. La stimulation de la production de protéines virales et de virions infectieux en hypoxie pourrait participer à la physiopathologie des érythroblastopénies et des anasarques foeto-placentaires associées à ce virus. NS1, VP1, VP2 : protéines virales.
Notons que des sites HBS sont également retrouvés dans le génome de parvovirus animaux, en particulier le parvovirus H-1 et le virus minute de la souris. Ces virus non pathogènes pour l’homme possèdent un oncotropisme et des propriétés oncolytiques bien étayés [21] qui leur confèrent un intérêt pour la mise au point de nouveaux traitements de cancers résistants ou inaccessibles aux thérapies conventionnelles. En l’absence d’étude publiée, nous ne pouvons actuellement que spéculer sur le fait que l’environnement intratumoral, présentant une pO2 très faible [7] et des quantités importantes d’HIF-1 [22], est probablement favorable à l’expression et la réplication in situ de ces virus.
Perspectives thérapeutiques
Utilisée dans certaines infections à bactéries anaérobies [23], l’oxygénothérapie, en association à des molécules antivirales, pourrait avoir un intérêt dans le traitement d’infections virales. D’ailleurs, l’oxygène hyperbare a déjà été utilisé comme traitement adjuvant de l’infection par le virus de l’immunodéficience humaine de type 1 (VIH-1) [24]. Les bases moléculaires de ce traitement restent mal explorées, puisqu’une seule étude publiée en 1991 a montré que la culture en hypoxie des cellules lymphoïdes de lignée T chroniquement infectées par le VIH-1 induit l’augmentation de la synthèse des ARNm rétroviraux, de la protéine de capside p24 et de la glycoprotéine d’enveloppe gp160 (Tableau I) [25]. Soulignons cependant que les ganglions constituent des carrefours importants du système immunitaire et des « réservoirs » de cellules cibles pour le VIH, dans lesquels la pO2 est d’environ 4 %, ce qui pourrait favoriser la réplication in vivo du VIH. Le développement d’agents susceptibles d’interférer avec la voie d’activation du facteur HIF-1α (activateurs d’hydroxylases, phosphatases…) pourrait également constituer une nouvelle voie de recherche pour le traitement de certaines infections virales et des complications néoplasiques que certains virus engendrent.
Conclusions
L’interaction des virus avec la voie de réponse à l’hypoxie est encore peu documentée. Cependant, le contrôle de nombreuses fonctions cellulaires par la voie HIF, telles que la régulation du cycle, de l’apoptose et de la différenciation, suggère que d’autres protéines virales sont très certainement susceptibles d’interagir avec ce facteur de transcription. De plus, il nous paraît important de souligner que la culture des virus dans des conditions qui se rapprochent des conditions physiologiques habituelles (type cellulaire, mais aussi pH, concentration en oxygène) permettra la réplication de virus réputés « non cultivables in vitro ».
Appendices
Remerciements
Les auteurs remercient le Professeur Frédéric Morinet (Virologie et UPR CNRS 9051) pour son soutien scientifique et amical. Les travaux réalisés sur le parvovirus B19 exposés dans cette revue ont été financés par l’Association pour la Recherche sur le Cancer, l’Établissement Français du Sang, l’AP/CNRS et la Fondation pour la Recherche Médicale.
Note
-
[1]
Oedème généralisé et intense de l’oeuf tout entier (placenta et foetus), avec production d’ascite.
Références
- 1. Ebbesen P, Pettersen EO, Denekamp J, et al. Hypoxia, normoxia and hyperoxia—terminology for medical in vitro cell biology. Acta Oncol 2000 ; 39 : 247-8.
- 2. Lewis JS, Lee JA, Underwood JC, et al. Macrophage responses to hypoxia : relevance to disease mechanisms. J Leuk Biol 1999 ; 66 : 889-900.
- 3. Iyer NV, Kotch LE, Agani F, et al. Cellular and developmental control of O2 homeostasis by hypoxia- inducible factor 1 alpha. Genes Dev 1998 ; 12 : 149-62.
- 4. Schipani E, Ryan HE, Didrickson S, et al. Hypoxia in cartilage : HIF-1alpha is essential for chondrocyte growth arrest and survival. Genes Dev 2001 ; 15 : 2865-76.
- 5. Cipolleschi MG, D’Ippolito G, Bernabei PA, et al. Severe hypoxia enhances the formation of erythroid bursts from human cord blood cells and the maintenance of BFU-E in vitro. Exp Hematol 1997 ; 25 : 1187-94.
- 6. Semenza GL. HIF-1 : mediator of physiological and pathophysiological responses to hypoxia. J Appl Physiol 2000 ; 88 : 1474-80.
- 7. Hockel M, Vorndran B, Schlenger K, et al. Tumor oxygenation : a new predictive parameter in locally advanced cancer of the uterine cervix. Gynecol Oncol 1993 ; 51 :141-9.
- 8. Hofer T, Wenger H, Gassmann M. Oxygen sensing, HIF-1 alpha stabilization and potential therapeutic strategies. Pflug Arch Eur J Physiol 2002 ; 443 : 503-7.
- 9. Lee SW, Lee YM, Bae SK, et al. Human hepatitis B virus X protein is a possible mediator of hypoxia-induced angiogenesis in hepatocarcinogenesis. Biochem Biophys Res Commun 2000 ; 268 : 456-61.
- 10. Moon EJ, Jeong CH, Jeong JW, et al. Hepatitis B virus X protein induces angiogenesis by stabilizing hypoxia-inducible factor-1. FASEB J 2004 ; 18 : 382-4.
- 11. Yoo YG, Cho S, Park S, Lee MO. The carboxy-terminus of the hepatitis B virus X protein is necessary and sufficient for the activation of hypoxia-inducible factor-1. FEBS Lett 2004 ; 577 : 121-6.
- 12. Yoo YG, Oh SH, Park ES, et al. Hepatitis B virus X protein enhances transcriptional activity of hypoxia-inducible factor-1alpha through activation of mitogen-activated protein kinase pathway. J Biol Chem 2003 ; 278 : 39076-84.
- 13. Wakisaka N, Kondo S, Yoshizaki T, et al. Epstein-Barr virus latent membrane protein 1 induces synthesis of hypoxia-inducible factor 1. Mol Cell Biol 2004 ; 24 : 5223-34.
- 14. Hui EP, Chan ATC, Pezzella F, et al. Coexpression of hypoxia-inducible factor 1 and 2, carbonic anhydrase IX, and vascular endothelial growth factor in nasopharyngeal carcinoma and relationship to survival. Clin Cancer Res 2002 ; 8 : 2595-604.
- 15. Sodhi A, Montaner S, Patel V, et al. The Kaposi’s sarcoma-associated herpes virus G protein-coupled receptor up-regulates vascular endothelial growth factor expression and secretion through mitogen-activated protein kinase and p38 pathways acting on hypoxia-inducible factor 1alpha. Cancer Res 2000 ; 60 : 4873-80.
- 16. Haque M, Davis DA, Wang V, et al. Kaposi’s sarcoma associated herpesvirus (human herpesvirus 8) contains hypoxia response elements : relevance to lytic induction by hypoxia. J Virol 2003 ; 77 : 6761-8.
- 17. Davis DA, Rinderknecht AS, Zoeteweij JP, et al. Hypoxia induces lytic replication of Kaposi sarcoma-associated herpesvirus. Blood 2001 ;97 : 3244-50.
- 18. Pillet S, Morinet F. Parvovirus B19 and erythroid cells. Pathol Biol (Paris) 2002 ; 50 : 349-56.
- 19. Pillet S, Le Guyader N, Hofer T, et al. Hypoxia enhances human B19 erythrovirus gene expression in primary erythroid cells. Virology 2004 ; 327 : 1-7.
- 20. Harrison JS, Rameshwar P, Chang V, Bandari P. Oxygen saturation in the bone marrow of healthy volunteers. Blood 2002 ; 99 : 394.
- 21. Deleu L, Daeffler L, Faisst S, Rommelaere J. Action oncolytique des parvovirus de rongeurs. Virologie 2002 ; 6: 29-40.
- 22. Zhong H, De Marzo AM, Laughner E, et al. Overexpression of hypoxia-inducible factor 1alpha in common human cancers and their metastases. Cancer Res 1999 ; 59 : 5830-5.
- 23. Sugihara A, Watanabe H, Oohashi M, et al. The effect of hyperbaric oxygen therapy on the bout of treatment for soft tissue infections.J Infect 2004 ; 48 : 330-3.
- 24. Reillo MR, Altieri RJ. HIV antiviral effects of hyperbaric oxygen therapy.J Assoc Nurses AIDS Care 1996 ; 7 : 43-5.
- 25. Polonis VR, Anderson GR, Vahey MT, et al. Anoxia induces human immunodeficiency virus expression in infected T cell lines. J Biol Chem 1991 ; 266 : 11421-4.
- 26. Brahimi-Horn C, Mazure N, Pouysségur J. Signalling via the hypoxia-inducible factor-1 requires multiple posttranslational modifications. Cell Signal 2005 ; 17 : 1-9.
List of figures
Figure 1
Régulation de l’activité de la protéine HIF-1α par la concentration intracellulaire en oxygène.
La protéine HIF-1α est très instable en présence d’oxygène : elle est rapidement dégradée et sa demi-vie est inférieure à cinq minutes. En effet, une prolyl-hydroxylase hydroxyle un résidu proline de la protéine HIF-1α, ce qui permet son interaction avec la protéine pVHL (von Hippel Lindau) et sa dégradation par le protéasome. En condition d’hypoxie, la prolyl-hydroxylase étant inactive, la protéine HIF-1α est très rapidement stabilisée et migre dans le noyau où elle s’associe à son partenaire HIF-1β. Le complexe ainsi formé recrute d’autres partenaires, en particulier CBP/p300, et se fixe sur la séquence nucléotidique spécifique de reconnaissance du facteur HIF-1 (motif HBS : HIF-binding site) située dans les régions régulatrices des gènes cibles. L’activation de la protéine HIF-1β par l’hypoxie entraîne la synthèse de facteurs protéiques impliqués notamment dans l’érythropoïèse, l’angiogenèse et la glycolyse anaérobie. Le recrutement de CBP/p300 par HIF-1α dans le noyau est également régulé par la tension en oxygène : une asparagyl-hydroxylase va modifier la protéine HIF-1α en présence d’oxygène et empêcher son interaction avec CBP/p300. Notons que de nombreuses autres modifications post-traductionnelles interviennent dans la régulation de l’activité de HIF-1α [26]. Parmi celles-ci, les phosphorylations de HIF-1α et de ses partenaires par les MAP-kinases (mitogen activated protein kinase) et la PI3K (phosphatidylinositol 3-kinase)/Akt sont impliquées dans l’activation de la voie HIF par de nombreux facteurs de croissance, même en condition de normoxie.
Figure 2
Perturbation de la régulation de la protéine HIF-1α par des protéines virales oncogènes.
A.La protéine oncogène HBx produite par le virus de l’hépatite B favorise la stabilisation et l’activation de la protéine HIF-1α en inhibant son interaction avec pVHL, en favorisant son interaction avec CBP/p300 [11] et en activant la voie des MAP-kinases [9, 10]. Le VEGF alors produit stimule la prolifération des cellules cancéreuses et des cellules endothéliales. B. La protéine oncogène membranaire LMP1 produite par le virus d’Epstein-Barr stimule les voies des MAP-kinases et des dérivés réactifs de l’oxygène (ROS), entraînant la stabilisation du facteur HIF-1α et la production de VEGF impliqué dans la prolifération des cellules endothéliales et des cellules épithéliales cancéreuses du nasopharynx [13]. C. La protéine membranaire oncogène couplée aux protéines G, GPCR, produite par le virus HHV8 va activer, en collaboration avec des facteurs de croissance et des oncogènes, la voie des MAP-kinases et de la PI3K/Akt [15]. La protéine HIF-1α ainsi stabilisée va s’associer avec ses partenaires nucléaires et activer la synthèse de VEGF qui va induire la prolifération des cellules tumorales et des cellules endothéliales. Le facteur HIF se fixe également au niveau de sites HBS présents dans les promoteurs viraux et augmente la production de particules virales [16, 17].
Figure 3
Activation de la réplication et de l’expression du parvovirus B19 par l’hypoxie.
Après fixation sur son récepteur, l’antigène P de groupe sanguin, et son corécepteur, un complexe d’intégrines, le parvovirus humain B19 libère son génome dans le noyau des progéniteurs érythroïdes. La transcription et la réplication virales sont activées en condition d’hypoxie in vitro, et probablement in vivo puisque la pO2 a été évaluée à moins de 3 % dans la moelle osseuse. Le promoteur viral qui contrôle l’expression de l’ensemble des gènes viraux possède un site HBS situé à 349 paires de bases en amont du site d’initiation de la transcription [19]. Ce site de fixation pour le facteur HIF-1α, en collaboration probablement avec d’autres sites de fixation pour des facteurs de transcription, est impliqué dans l’augmentation de l’expression du parvovirus B19 in vitro. La stimulation de la production de protéines virales et de virions infectieux en hypoxie pourrait participer à la physiopathologie des érythroblastopénies et des anasarques foeto-placentaires associées à ce virus. NS1, VP1, VP2 : protéines virales.
List of tables
Tableau I
Réplication et expression des virus en hypoxie.
L’activation de certains promoteurs viraux met en jeu la voie de réponse à l’hypoxie assurée par HIF-1α. La présence et la fonctionnalité de sites de fixation pour HIF-1α ont été démontrées dans le génome du parvovirus B19 [19] et du virus herpès humain 8 [16, 17]. L’activation d’HIF-1α est impliquée dans le pouvoir pathogène, en particulier oncogène, des virus herpès humains 8 (HHV8), de l’hépatite B (VHB) et d’Epstein-Barr (EBV) [9-15]. La valeur notée entre parenthèses est le rapport entre les données expérimentales obtenues en conditions d’hypoxie (faibles concentrations d’oxygène) et en conditions habituelles de culture cellulaire (20 % d’oxygène). Les cytokines de l’hôte ou les virokines produites en réponse à l’infection virale sont également présentées dans ce tableau. ND : non déterminé. NQ : non quantifié.