Article body
Les maladies articulaires telles que l’arthrose sont la conséquence de processus mécaniques et biologiques qui concourent à la rupture de l’homéostasie du cartilage et, à terme, à la dégradation de la fonction articulaire et de ses propriétés biomécaniques (Figure 1). Les arthropathies touchent plus de 900 000 personnes dans le monde chaque année, et ont un coût important que l’on estime à plus de trois billions d’euros. Ces maladies, à la fois chroniques et évolutives, ont une prévalence élevée chez les sujets âgés. Elles altèrent considérablement la qualité de vie et sont une des principales causes de consultation médicale, de consommation médicamenteuse et d’invalidité.
Figure 1
Rupture de l’homéostasie du cartilage.
Lors de maladies dégénératives du cartilage, comme l’arthrose, il y a rupture de l’équilibre entre les processus de synthèse et de dégradation des composants de la matrice extracellulaire. La voie de dégradation est favorisée par l’action conjointe de cytokines pro-inflammatoires telles que l’interleukine-1 (IL-1) ou le tumor necrosis factor α (TNF-α), ainsi que par les événements liés à l’activation des gènes de l’inflammation IL-1-dépendants (cyclo-oxygénase-2, COX-2, NO synthase II, NOSII, production de radicaux libres), et à l’activation d’enzymes hydrolysant les macromolécules protéiques et polysaccharidiques (métalloprotéases et hyaluronidase). La dégradation des composés collagéniques est prévenue par des inhibiteurs de protéases tels que les tissue inhibitor of matrix metalloproteases (TIMP). Interviennent également des cytokines anti-inflammatoires, ainsi que les facteurs de croissance, insulin-like growth factor-1 (IGF-1) et tumor growth factor (TGF), dans la stimulation de l’anabolisme. La rupture de l’homéostasie tissulaire entraîne la dégradation du cartilage accompagnée d’hyperplasie de la membrane synoviale, du remodelage de l’os sous-chondral et l’apparition d’ostéophytes. Ces processus entraînent une détérioration des propriétés mécaniques de l’articulation et sont à l’origine de douleurs.
Il n’existe pas actuellement de traitement efficace des lésions dégénératives du cartilage. La mise en place de prothèses représente le stade ultime de traitement de l’arthrose et les approches pharmacologiques proposées sont limitées. Un éventail de substances pharmacologiques (anti-inflammatoires, antalgiques) est utilisé pour soulager les symptômes de la maladie (inflammation, douleur), mais ces prescriptions conventionnelles ne permettent pas d’arrêter sa progression. De plus, l’utilisation de ces médicaments expose au risque de manifestations indésirables, voire toxiques, qui limitent leur utilisation chronique. Dans ce contexte, les approches de bio-ingénierie tissulaire ouvrent des perspectives alternatives intéressantes dans le domaine de la réparation du cartilage, tissu incapable de se régénérer spontanément.
La perte d’homéostasie du cartilage est provoquée principalement par une production locale de cytokines pro-inflammatoires telles que l’interleukine-1 (IL-1), par les chondrocytes et les synoviocytes qui favorise à la fois la dégradation des constituants matriciels et l’inhibition de leur biosynthèse (Figure 1). Plusieurs approches expérimentales visant à s’opposer aux effets délétères de l’IL-1 et du tumor necrosis factor α, les deux principales cytokines impliquées dans les maladies articulaires, ont été tentées. Ces stratégies, fondées sur l’administration de protéines recombinantes et sur l’expression par transfert de gène dans le chondrocyte ou dans le liquide synovial d’antagonistes ou de récepteurs solubles de cytokines, ont permis de ralentir la progression des lésions chez l’animal [1]. Une autre approche est de développer des stratégies réparatrices des lésions du cartilage. Nous avons choisi de privilégier des approches visant à stimuler la biosynthèse des constituants matriciels. Les phases précoces de l’arthrose sont caractérisées par une perte d’anabolisme des protéoglycanes, principalement l’agrécane, qui se traduit essentiellement par des modifications quantitatives et qualitatives de ses chaînes de glycosaminoglycanes (GAG). Ces perturbations conduisent à la détérioration progressive et finalement irréversible de la matrice cartilagineuse. La biosynthèse des chaînes de GAG revêt une importance biologique considérable en raison de leur rôle dans l’organisation structurale de la matrice des tissus conjonctifs et de leurs propriétés régulatrices liées à leur capacité d’interaction avec les facteurs de croissance et les cytokines [2].
La β1,3-glucuronosyltransférase I chondrocytaire : importance stratégique et fonctionnelle dans la biosynthèse des GAG
Les voies de biosynthèse des GAG mettent en jeu l’action séquentielle de glycosyltransférases. Elles sont initiées par l’assemblage d’une séquence tétrasaccharidique commune d’ancrage fixée sur un squelette peptidique pour former une amorce glycopeptidique (GlcAβ1,3-Galβ1,3-Galβ1,4-Xylβ-O-sérine), à partir de laquelle s’effectue la polymérisation des deux principaux types de chaînes de GAG (héparine/héparane-sulfates, chondroïtine/dermatane-sulfates) (Figure 2). La formation de cette séquence constituée par l’ajout successif de résidus glucidiques est catalysée par les enzymes suivantes : la O-xylosyltransférase I, la β1,4-galactosyltransférase 7 (GalT-I), la β1,3-galactosyltransférase 6 (GalT-II), et la β1,3-glucuronosyltransférase I (GlcAT-I) [3]. Le transfert d’un résidu αGlcNAc ou βGalNAc sur l’acide glucuronique terminal initie la polymérisation, respectivement, des chaînes d’héparane-sulfates ou de chondroïtine-sulfates. Ces hétéropolysaccharides subissent des modifications par l’action conjointe d’épimérases et de sulfotransférases, ce qui confère à la chaîne des GAG une complexité considérable et des fonctions variées.
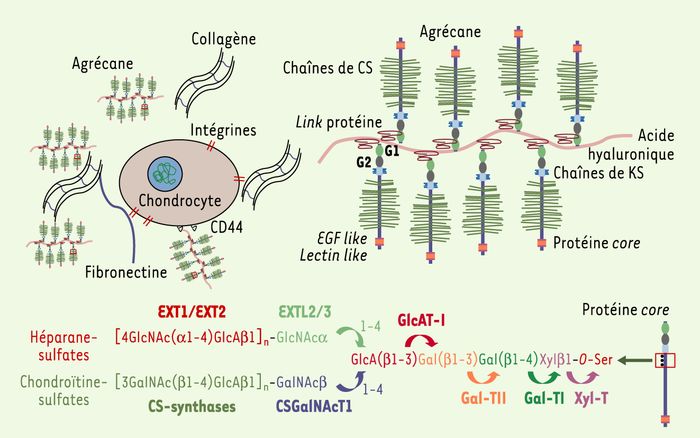
Figure 2
Principaux constituants de la matrice du cartilage et voies de biosynthèse des protéoglycanes.
Le cartilage est un tissu avasculaire constitué de chondrocytes qui synthétisent une matrice extracellulaire dense principalement composée de fibres de collagène et de macromolécules polysaccharidiques, les protéoglycanes. L’agrécane est le principal protéoglycane de la matrice cartilagineuse où il joue un rôle essentiel dans les propriétés mécaniques et fonctionnelles de ce tissu. Il est formé d’une protéine porteuse (core) comprenant plusieurs domaines d’interaction avec d’autres constituants matriciels, des sites de fixation de chaînes de kératane-sulfates (KS) et de chondroïtine-sulfates (CS). Ces dernières, fortement chargées, permettent la rétention d’eau et sont responsables des propriétés de compression caractérisant le cartilage. La perte d’anabolisme des chondroïtine-sulfates de l’agrécane est un des événements précoces de la rupture de l’homéostasie du cartilage. La biosynthèse de ces chaînes fait appel à un réseau de glycosyltransférases, dont la β1,3-glucuronosyltransférase (GlcAT-I), qui catalyse une réaction située à la charnière entre la voie de synthèse des chaînes d’héparane-sulfates et de chondroïtine-sulfates. Xyl-T : xylosyltransférase ; Gal-TI : β1,4-galactosyltransférase 7 ; Gal-TII : β1,3-galactosyltransférase 6 ; EXT1/EXT2 : exostose gene 1 and 2 ; EXTL2/3 : extostose like gene 2 and 3.
La GlcAT-I, en catalysant l’étape finale de la biosynthèse de l’amorce tétrasaccharidique des protéoglycanes, conditionne la polymérisation ultérieure des chaînes et jouerait un rôle limitant dans la biosynthèse des GAG [4]. Ainsi, nous avons montré que la répression de l’expression de la GlcAT-I par des oligonucléotides anti-sens entraîne une diminution de la biosynthèse des GAG dans des explants de cartilage articulaire de rat [5]. Inversement, la surexpression du gène codant pour la GlcAT-I stimule la biosynthèse des protéoglycanes et s’oppose à l’effet délétère de l’IL-1 [6]. Nous avons surexprimé la GlcAT-I humaine au moyen d’un système de transfert de gène non viral dans des chondrocytes en culture primaire et dans des explants de cartilage ex vivo. L’expression efficace du transgène s’accompagne d’une augmentation significative de la biosynthèse et de l’accumulation des GAG matriciels. Nous avons montré que la stimulation de la biosynthèse des GAG par la GlcAT-I se traduit par une augmentation du nombre et non de la longueur des chaînes polysaccharidiques, en particulier des chaînes de chondroïtine- sulfates, suggérant une structure normale de la matrice restaurée [6].
De façon intéressante, le transfert de l’ADNc codant pour la GlcAT-I est capable de contrecarrer la déplétion en protéoglycanes produite par l’IL-1 et de préserver l’activité anabolique des chondrocytes en terme de synthèse des GAG. De plus, la surexpression de la GlcAT-I permet de restaurer la synthèse des protéoglycanes dans des explants de cartilage après leur déplétion au préalable par un traitement à l’IL-1. Ces résultats suggèrent que la GlcAT-I est capable de contrôler et de s’opposer à la détérioration du cartilage en termes d’anabolisme des protéoglycanes et des GAG après action de l’IL-1.
Conclusions
Cette étude jette les bases d’une approche de transfert de gène pour promouvoir la réparation du cartilage au cours d’atteintes dégénératives. Le transfert de gènes permet de surexprimer dans les tissus articulaires des enzymes pouvant restaurer les composants polysaccharidiques et/ou des facteurs protéiques anti-cytokiniques recombinants capables de s’opposer à la dégénérescence matricielle. Cette stratégie pourra être combinée à l’utilisation de biomatériaux constitués de matrices polymériques. Il devrait ainsi être possible de développer de nouvelles approches d’ingénierie tissulaire pour la conception de bio-systèmes originaux susceptibles de faciliter et de guider la cicatrisation du cartilage.
Appendices
Références
- 1. Ghivizzani SC, Lechman ER, Kang R, et al. Direct adenovirus-mediated gene transfer of interleukin 1 and tumor necrosis factor alpha soluble receptors to rabbit knees with experimental arthritis has local and distal anti-arthritic effects. Proc Natl Acad SciUSA 1998 ; 95 : 4613-8.
- 2. Wegrowski Y, Maquart FX. Involvement of stromal proteoglycans in tumour progression. Crit Rev Oncol Hematol 2004 ; 49 : 259-68.
- 3. Gulberti S, Lattard V, Fondeur M, et al. Phosphorylation and sulfation of oligosaccharide substrates critically influence the activity of human β1,4-galactosyltransferase 7 (GalT-I) and β1,3-glucuronosyltransferase I (GlcAT-I) involved in the biosynthesis of the glycosaminoglycan-protein linkage region of proteoglycans. J Biol Chem 2005 ; 280 : 1417-25.
- 4. Bai X, Wei G, Anjana S, et al. Chinese hamster ovary cell mutants defective in glycosaminoglycan assembly and glucuronosyltransferase-I. J Biol Chem 1999 ; 274 : 13017-24.
- 5. Venkatesan N, Barré L, Benani A, et al. Stimulation of proteoglycan synthesis by glucuronosyltransferase-I gene delivery : a novel strategy to promote cartilage repair. Proc Natl Acad Sci USA 2004 ; 101 : 18087-92.
- 6. Calabro A, Hascall VC, Midura RJ. Adaptation of FACE methodology for microanalysis of total hyaluronan and chondroitin sulfate composition from cartilage. Glycobiology 2000 ; 10 : 283-93.
List of figures
Figure 1
Rupture de l’homéostasie du cartilage.
Lors de maladies dégénératives du cartilage, comme l’arthrose, il y a rupture de l’équilibre entre les processus de synthèse et de dégradation des composants de la matrice extracellulaire. La voie de dégradation est favorisée par l’action conjointe de cytokines pro-inflammatoires telles que l’interleukine-1 (IL-1) ou le tumor necrosis factor α (TNF-α), ainsi que par les événements liés à l’activation des gènes de l’inflammation IL-1-dépendants (cyclo-oxygénase-2, COX-2, NO synthase II, NOSII, production de radicaux libres), et à l’activation d’enzymes hydrolysant les macromolécules protéiques et polysaccharidiques (métalloprotéases et hyaluronidase). La dégradation des composés collagéniques est prévenue par des inhibiteurs de protéases tels que les tissue inhibitor of matrix metalloproteases (TIMP). Interviennent également des cytokines anti-inflammatoires, ainsi que les facteurs de croissance, insulin-like growth factor-1 (IGF-1) et tumor growth factor (TGF), dans la stimulation de l’anabolisme. La rupture de l’homéostasie tissulaire entraîne la dégradation du cartilage accompagnée d’hyperplasie de la membrane synoviale, du remodelage de l’os sous-chondral et l’apparition d’ostéophytes. Ces processus entraînent une détérioration des propriétés mécaniques de l’articulation et sont à l’origine de douleurs.
Figure 2
Principaux constituants de la matrice du cartilage et voies de biosynthèse des protéoglycanes.
Le cartilage est un tissu avasculaire constitué de chondrocytes qui synthétisent une matrice extracellulaire dense principalement composée de fibres de collagène et de macromolécules polysaccharidiques, les protéoglycanes. L’agrécane est le principal protéoglycane de la matrice cartilagineuse où il joue un rôle essentiel dans les propriétés mécaniques et fonctionnelles de ce tissu. Il est formé d’une protéine porteuse (core) comprenant plusieurs domaines d’interaction avec d’autres constituants matriciels, des sites de fixation de chaînes de kératane-sulfates (KS) et de chondroïtine-sulfates (CS). Ces dernières, fortement chargées, permettent la rétention d’eau et sont responsables des propriétés de compression caractérisant le cartilage. La perte d’anabolisme des chondroïtine-sulfates de l’agrécane est un des événements précoces de la rupture de l’homéostasie du cartilage. La biosynthèse de ces chaînes fait appel à un réseau de glycosyltransférases, dont la β1,3-glucuronosyltransférase (GlcAT-I), qui catalyse une réaction située à la charnière entre la voie de synthèse des chaînes d’héparane-sulfates et de chondroïtine-sulfates. Xyl-T : xylosyltransférase ; Gal-TI : β1,4-galactosyltransférase 7 ; Gal-TII : β1,3-galactosyltransférase 6 ; EXT1/EXT2 : exostose gene 1 and 2 ; EXTL2/3 : extostose like gene 2 and 3.