Article body
Les molécules de classe II du complexe majeur d’histocompatibilité (CMH) sont composées d’une chaîne α et d’une chaîne β associées de façon non covalente. Chez l’humain, trois isotypes (HLA-DR, -DP et -DQ) de molécules de classe II dites « classiques » sont co-exprimés dans la membrane plasmique. Les diverses chaînes α et β montrent une similitude de structure primaire dans une proportion aussi basse que 60 % entre certains isotypes et sont codées par des gènes spécifiques. Chaque molécule de classe II est associée à un peptide antigénique d’une quinzaine d’acides aminés fixé lors d’un passage préalable à l’intérieur des compartiments endosomiques. Par exemple, lors d’une infection, on estime que les quelques 100 000 molécules HLA-DR à la surface d’un lymphocyte B exposent à tout moment jusqu’à 2 000 peptides différents provenant principalement de la dégradation de protéines de l’hôte et de celles de pathogènes [1]. Ces peptides se retrouvent fixés dans une cavité appelée « niche peptidique » mais demeurent en partie exposés pour permettre l’interaction avec le récepteur des cellules T et ainsi amorcer la réponse immunitaire spécifique (Figure 1) [2]. Les gènes codant les molécules HLA (human leukocyte antigens) sont les plus polymorphiques du génome humain et plus de 400 allèles ont été répertoriés [3]. Ce polymorphisme touche principalement des acides aminés localisés dans la niche peptidique et se traduit par des répertoires d’antigènes variés et des réponses immunitaires différentes entre les individus. Le polymorphisme confère d’ailleurs aux molécules du CMH des propriétés antigéniques intrinsèques causant le rejet de greffes lors des transplantations d’organes entre individus incompatibles.
Figure 1
Structure tridimensionnelle de la molécule soluble HLA-DR1 liée à un peptide issu du virus influenza.
La chaîne α (rouge) et la chaîne β (blanche) interagissent avec le peptide antigénique (jaune). Les domaines α1 et β1 forment la niche peptidique tandis que les régions α2/β2 sont ancrées à la membrane par des régions hydrophobes qui sont exclues des formes solubles représentées ici [10].
Il existe aussi des molécules de classe II dites « non classiques », principalement parce qu’elles sont monomorphes. Ces molécules, appelées HLA-DM et HLA-DO, comportent des signaux de ciblage vers la voie endocytaire et sont donc, à toutes fins pratiques, absentes de la surface cellulaire [4]. Ces molécules non classiques ne fixent pas de peptides dans leur propre niche mais jouent plutôt un rôle dans le chargement des antigènes sur les molécules classiques afin de donner naissance à des complexes stables. Plusieurs études soutiennent l’idée d’un modèle selon lequel HLA-DM s’associe aux molécules de classe II instables dans les compartiments lysosomaux et rompt les liens hydrogènes de la liaison de la partie amino-terminale des peptides de faible affinité. Faute de HLA-DM, la diversité du répertoire peptidique est très limitée [5]. Quant à HLA-DO, sa fonction demeure nébuleuse. Ce chaperon est retrouvé principalement chez les cellules B et uniquement en association avec HLA-DM [4]. HLA-DO inhibe le chargement des peptides dans les endosomes précoces et, paradoxalement, son action négative semble favoriser, directement ou indirectement, le chargement de certains peptides [4]. Les règles moléculaires régissant l’activité de HLA-DO restent à définir, mais il a été démontré in vitro que son action inhibitrice ne se manifeste pas à pH acide, suggérant un rôle différent dans les compartiments tardifs de la voie endocytique. Il a été proposé que DO inhibe la présentation des antigènes internalisés en phase fluide et donc non reconnus par l’immunoglobuline de surface. Cela permettrait d’éviter l’activation aléatoire de lymphocytes B potentiellement auto-réactifs [4]. HLA-DO apparaît donc comme un régulateur naturel de la présentation antigénique. Bien que sa fonction précise demeure inconnue, son rôle inhibiteur de la présentation antigénique laisse présumer qu’une meilleure connaissance de son mode d’action et de sa structure pourrait permettre d’améliorer l’efficacité des vaccins ou encore de combattre les maladies auto-immunes.
La détermination de la structure tridimensionnelle des molécules de CMH-I et II par diffraction des rayons X a permis aux groupes de Strominger et Wiley à l’Université Harvard (États-Unis) de définir les bases moléculaires de la fonction de ces molécules, ainsi que la raison d’être du polymorphisme génétique. Depuis la publication de la structure de la molécule HLA-DR en 1993 [2], de nombreuses autres molécules apparentées ont été cristallisées afin de tenter de déterminer, par exemple, une relation possible entre le polymorphisme et les maladies auto-immunes [6].
À l’heure actuelle, les structures tridimensionnelles de HLA-DR et HLA-DQ ont été établies. Du côté des molécules non classiques, la structure de HLA-DM a été déterminée [7]. Quant à la molécule HLA-DO, des problèmes techniques ayant trait aux rendements de production des molécules solubles viennent contrecarrer les efforts de cristallisation. Cette situation pourrait être due au fait que ce chaperon est entièrement dépendant de HLA-DM pour son repliement dans le réticulum endoplasmique et, par la suite, son transport au-delà de l’appareil de Golgi [4].
Afin de pallier le manque de stabilité de HLA-DO et permettre la production de formes solubles dans les systèmes d’expression des cellules d’insectes, nous avons entrepris de caractériser, à l’échelle moléculaire, les problèmes de repliement des chaînes α et β. L’étude des structures primaires a révélé que HLA-DOα comporte, tout comme HLA-DQ, un acide aminé supplémentaire comparativement à la séquence retrouvée chez DRα. En effet, DOα comporte l’insertion d’une glycine en position 10. Cet acide aminé fait preuve d’une très grande liberté dans sa conformation et constitue une protubérance à l’intérieur de la niche peptidique de HLA-DQ, ne modifiant pas la position relative des résidus avoisinants [8]. Cependant, c’est seulement chez HLA-DO que cette glycine est suivie d’une proline dont la nature rigide laisse deviner des modifications importantes de la structure quaternaire (Figure 2). Nous avons donc entrepris de corriger le défaut potentiel par mutagenèse dirigée sur l’ADNc de DOα en remplaçant la proline par la valine retrouvée sur DQα [9]. Lorsque cette chaîne α modifiée fut introduite avec la chaîne DOβ dans des cellules fibroblastiques n’exprimant aucune molécule de classe II, le transport du réticulum endoplasmique vers l’appareil de Golgi a été rapide et similaire à l’hétérodimère de type sauvage en présence de HLA-DM. Le mutant DOP11V, tout comme les molécules de classe II classiques, est donc indépendant de HLA-DM pour sa maturation et son transport. De plus, nous avons démontré in vivo et in vitro qu’en présence de HLA-DM, HLA-DOP11V est toujours fonctionnel et inhibe le chargement des peptides. Nous croyons que ce variant permettra maintenant la production de formes solubles stables et en quantité suffisante pour parvenir à établir la structure tridimensionnelle de HLA-DO et ainsi mieux comprendre son mode de fonctionnement.
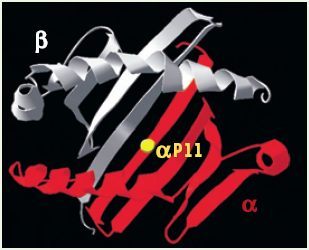
Figure 2
Vue supérieure d’une molécule générique de classe II démontrant la position présumée de l’acide aminé DOα P11 impliqué dans le repliement de la molécule HLA-DO.
La chaîne α est représentée en rouge et la chaîne β en blanc. La position αP11 est indiquée par un point jaune.
Appendices
Références
- 1. Hunt DF, Michel H, Dickinson TA, et al. Peptides presented to the immune system by murine class II major histocompatibility complex molecule I-Ad. Science 1992 ; 256 : 1817-20.
- 2. Brown JH, Jardetzky TS, Gorga JC, et al. Three-dimensional structure of the human class II histocompatibility antigen HLA-DR1. Nature 1993 ; 364 : 33-9.
- 3. Marsh SGE, Parham P, Barber LD. The HLA facts book. London: Academic Press, 2000 : 398 p.
- 4. Karlsson L. DM and DO shape the repertoire of peptide-MHC-class-II complexes. Curr Opin Immunol 2005 ; 17 : 65-70.
- 5. Miyazaki T, Wolf P, Tourne S, et al. Mice lacking H2-M complexes, enigmatic elements of the MHC class II peptide-loading pathway. Cell 1996 ; 84 : 531-41.
- 6. Housset D, Malissen B. What do TCR-pMHC crystal structures teach us about MHC restriction and alloreactivity? Trends Immunol 2003 ; 24 : 429-37.
- 7. Mosyak L, Zaller DM, Wiley DC. The structure of HLA-DM, the peptide exchange catalyst that loads antigen onto class II MHC molecules during antigen presentation. Immunity 1998 ; 9 : 377-83.
- 8. Lee KH, Wucherpfennig KW, Wiley DC. Structure of a human insulin peptide-HLA-DQ8 complex and susceptibility to type 1 diabetes. Nat Immunol 2001 ; 2 : 501-7.
- 9. Deshaies F, Brunet A, Diallo DA, et al. A point mutation in the groove of HLA-DO allows egress from the endoplasmic reticulum independent of HLA-DM. Proc Natl Acad Sci USA 2005 ; 102 : 6443-8.
- 10. Stern LJ, Brown JH, Jardetzky TS, et al. Crystal structure of the human class II MHC protein HLA-DR1 complexed with an inluenza virus peptide. Nature 1994 ; 368 : 215-21.
List of figures
Figure 1
Structure tridimensionnelle de la molécule soluble HLA-DR1 liée à un peptide issu du virus influenza.
Figure 2
Vue supérieure d’une molécule générique de classe II démontrant la position présumée de l’acide aminé DOα P11 impliqué dans le repliement de la molécule HLA-DO.