Abstracts
Résumé
Il a récemment été montré que les plaquettes sanguines exprimaient le CD154 (ligand du CD40), qu’elles extériorisent à leur surface lors de leur activation. Cette découverte a eu des conséquences importantes sur la compréhension de la biologie de la plaquette. D’une part, le CD154 intervient dans la stabilisation du thrombus plaquettaire. D’autre part, l’interaction des plaquettes avec les cellules exprimant le récepteur CD40 a mis en évidence de nouvelles interfaces liant les plaquettes à la réaction inflammatoire, la coagulation et le remodelage de la matrice extracellulaire. Cela est tout particulièrement vrai pour les interactions plaquettes/vaisseaux et le CD154 plaquettaire joue un rôle clé dans la maladie athéromateuse. Enfin, l’expression du CD154 confère aux plaquettes une compétence immunologique, leur faisant jouer un rôle potentiel dans la réponse immune ou dans les pathologies associées à une auto-immunisation antiplaquettaire comme le purpura thrombopénique idiopathique.
Summary
Blood platelets play a crucial part in the blood clotting process by forming the platelet plug. Recent evidence indicates that they are likely to play a key role in the inflammatory reaction via CD154/CD40 interactions. CD40 was known to be widely expressed, for instance on cells of the vasculature including endothelial cells, smooth muscle cells and macrophages. It was also known that the triggering of CD40 on these cells led to the acquisition of an activated pro-inflammatory and pro-coagulant phenotype. It was subsequently shown that platelets express CD154 which is cryptic in unstimulated platelets but is expressed at the platelet surface upon platelet activation. When expressed at the platelet surface and exposed to CD40-expressing vascular cells, the platelet-associated CD154 triggers a variety of pro-inflammatory and pro-coagulant responses including induction of adhesion receptors, release of cytokines and chemokines, induction of tissue factor and of metalloproteinases. Platelet-associated CD154 is also involved in platelet/platelet interactions during platelet aggregation. Furthermore, in vivo models have emphasized the critical role of the platelet-associated CD154 in the progression of atherosclerotic disease and in the stabilization of arterial thrombi. Recent data show that CD40-bearing cells involved in fibrosis such as hepatic stellate cells and glomerular mesangial cells also respond to platelet-associated CD154, thus suggesting a new mechanism by which platelets may be instrumental in the inflammatory diseases of the liver or the kidney. Finally, platelet-associated CD154 has been shown to have immune competence both in vitro and in vivo, observations that open new fields of research on the potential implications of platelets in the immune response and auto-immune diseases.
Article body
Les plaquettes sanguines sont des éléments figurés du sang provenant de la fragmentation du cytoplasme des mégacaryocytes spécialisés dans la formation du clou hémostatique conduisant à l’arrêt du saignement [1-3]. La place de la plaquette dans la réaction inflammatoire a fait l’objet de très nombreux travaux que l’on pourrait schématiser en deux axes, l’un reflétant la participation directe des médiateurs pro-inflammatoires stockés dans les plaquettes et libérés lors de leur activation, l’autre les liens indirects entre activation plaquettaire et réaction inflammatoire, via le système du complément, la cascade des kinines, etc. Différentes revues ont été publiées concernant plaquettes et réaction inflammatoire, auxquelles nous renvoyons le lecteur [4]. La mise en évidence récente de l’expression du CD154 par les plaquettes a repositionné ces dernières dans la coagulation, la réaction inflammatoire et la réponse immunitaire.
CD154 : une molécule indispensable à l’activation des lymphocytes B
Le couple CD154/CD40
Le CD154 est une glycoprotéine membranaire de 30 kDa à 33 kDa présentant des homologies de séquence avec les molécules de la famille du tumor necrosis factor (TNF). Les protéines membranaires de cette famille sont des protéines de classe II, dont l’extrémité carboxyterminale est orientée à l’extérieur de la membrane cellulaire. Le gène codant pour le CD154 humain est localisé sur le chromosome X (locus Xq26.3-Xq27.1) : il est organisé autour de 5 exons, pour une taille de 12 à 13 kb. Le récepteur du CD154, le CD40, est une glycoprotéine membranaire de classe I, comportant un segment transmembranaire et dont la partie extracellulaire est homologue à celle des membres de la famille du récepteur du TNF. Le crosslinking du récepteur du CD154 (le CD40) à la surface des cellules cibles apparaît nécessaire à l’activité biologique du CD154 [5, 6]. Comme d’autres membres de la famille du récepteur du TNF, le CD40 se présenterait à la membrane sous la forme d’un complexe trimérique, complexe préformé [7] plutôt qu’induit par le ligand [8]. L’interaction récepteur/ligand ferait intervenir un complexe trimérique du CD40 avec un complexe trimérique du CD154. Les voies de signalisation activées par l’engagement du CD40 font en particulier intervenir les protéines TRAF (TNF-receptor associated factor) [6].
Rôle immunologique du CD154
Le CD154, exprimé par les lymphocytes T activés, donne un signal de costimulation dans l’activation T-dépendante des lymphocytes B. Il est indispensable aux différentes étapes du programme de différenciation des lymphocytes B, comme la commutation isotypique et la production des lymphocytes B mémoire [6]. Ainsi, l’exemple des souris dont le gène du CD154 a été invalidé montre qu’il n’existe pas de mécanisme compensateur pouvant prendre la place de l’interaction CD40/CD154 dans le processus de différenciation des lymphocytes B : ces souris présentent un déficit de la production d’IgG et d’IgA, associé à un déficit immunitaire et à un défaut de production de lymphocytes B mémoire.
Chez l’homme, l’importance du couple CD40/CD154 est illustrée par le syndrome de déficit immunitaire lié à l’X [9]. Des mutations ponctuelles ou des délétions du gène codant pour le CD154 sont à l’origine de ce désordre immunitaire, cliniquement caractérisé par des infections répétées, où il existe un déficit complet en IgG et en IgA, tandis que les concentrations sériques en IgM sont élevées. Chez ces patients, les lymphocytes T activés n’expriment pas de CD154 fonctionnel et les lymphocytes B sont incapables d’engager un processus de maturation dans les réponses T-dépendantes.
La place centrale du CD154 dans l’activation des lymphocytes B a conduit à des stratégies thérapeutiques de blocage du couple CD40/CD154 par des anticorps dans de nombreux modèles expérimentaux de maladies auto-immunes, avec des effets bénéfiques sur l’évolution de la pathologie. En thérapeutique humaine, des résultats encourageants ont été obtenus grâce à l’utilisation d’un anti-CD154 monoclonal humanisé chez des patients atteints d’un purpura thrombopénique immunologique (PTI) réfractaire [10].
Expression du CD40 en dehors du lymphocyte B
Outre son expression par les lymphocytes B, le CD40 est largement distribué (Tableau I), ce qui suggère que le couple CD154/CD40 intervient également en dehors de l’activation des lymphocytes B. La cellule endothéliale (CE) est notamment une source quantitativement importante de CD40 dans l’organisme, tous les endothéliums analysés à ce jour exprimant la molécule. L’expression du CD40 est, en règle, faible à l’état basal et augmentée par un ensemble de signaux inflammatoires comme ceux délivrés par l’interféron γ, le TNF-α ou l’interleukine-1.
CD154 plaquettaire
Le CD154 est également exprimé par les plaquettes ; cette expression est faible quand elles ne sont pas activées. Il est détectable par immuno-empreinte sur les lysats plaquettaires. De 1 ng à 5 ng de CD154 sont présents dans 108 plaquettes, ce qui représenterait environ 600 à 1 000 molécules de CD154 par plaquette. Après activation par l’ADP, la thrombine ou le collagène, l’expression du CD154 à la surface des plaquettes est accrue et devient détectable par cytométrie en flux. La localisation du CD154 dans la plaquette non activée reste encore controversée : cependant, les conditions d’expression de la molécule à la surface plaquettaire après activation [11-14] évoquent une localisation granulaire suivie d’une sécrétion, ce que semblent confirmer certaines données de microscopie électronique (Figure 1).
Figure 1
Expression du CD154 par les plaquettes sanguines.
Différents arguments suggèrent une localisation du CD154 au niveau des granules α, avec une extériorisation membranaire de la molécule lors de l’activation plaquettaire. A. Représentation schématique d’une plaquette sanguine positionnant les principaux organites et composants moléculaires, dont le CD154 (VWF, facteur von Willebrand ; TSP, thrombospondine ; PF4, facteur plaquettaire 4 ; β-TG, β-thromboglobuline ; PDGF, platelet derived growth factor ; TGF, transforming growth factor ; 5-HT, 5-hydroxytryptophane). B. Immunomarquage du CD154 (flèches rouges) sur la partie cytoplasmique d’une plaquette humaine non stimulée, montrant la présence de billes d’or au niveau des granules α. Image obtenue par microscopie électronique. Barre : 0,2 μm (P. Nurden, résultats non publiés).
Le CD154 plaquettaire provient probablement du mégacaryocyte. Si sa mise en évidence dans le mégacaryocyte normal est difficile, en raison sans doute d’une faible expression, l’expression du CD154 mégacaryocytaire est élevée dans certaines pathologies comme le PTI, et l’ARNm du CD154 y devient alors détectable dans le cytoplasme [15] (Figure 2). Par ailleurs, différentes lignées mégacaryocytaires expriment le CD154. Enfin, l’hypothèse d’une adsorption du CD154 soluble plasmatique par les plaquettes ne peut être retenue, le CD154 plaquettaire se présentant sous sa forme moléculaire entière.
Tableau I
Distribution ubiquitaire du CD40.
Ce tableau répertorie les types cellulaires exprimant le CD40. Il est à noter que l’expression du CD40 est en général faible, rendant difficile sa détection en conditions basales, cette expression étant accrue par un certain nombre de médiateurs de l’inflammation dont l’interféron γ, l’IL-1 ou le TNF-α. Pour l’ensemble de ces cellules, il existe une très abondante littérature concernant les effets de l’engagement du CD40 par le CD154 (voir par exemple [6]). Ce tableau ne mentionne que les conséquences fonctionnelles de l’engagement du CD40 par le CD154 plaquettaire, étudiées à ce jour seulement pour les cellules endothéliales et les cellules mésangiales glomérulaires. MCP-1 : monocyte chemoattractant protein 1 ; MT1-MMP : membrane type MMP1.
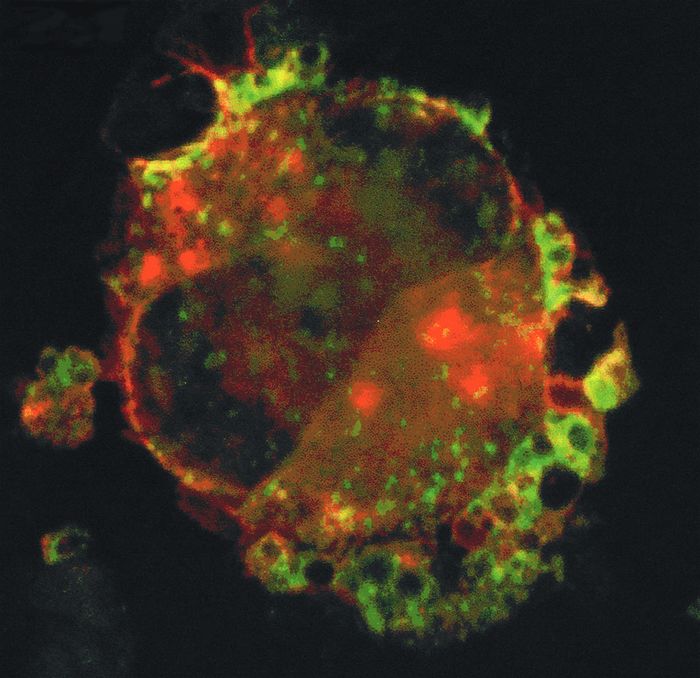
Figure 2
L’origine du CD154 plaquettaire est probablement le mégacaryocyte.
Le CD154 est synthétisé par les mégacaryocytes. L’expression du CD154 est faible dans les mégacaryocytes, rendant sa détection difficile. Son expression est, par un mécanisme non élucidé, accrue dans le PTI (purpura thrombopénique immunologique), rendant possible la détection du CD154 et de son ARN messager dans le cytoplasme des mégacaryocytes de patients atteints. Immunofluorescence sur une préparation de mégacaryocytes d’un patient présentant un PTI. Fluorescence rouge : anti-GPIIb (anticorps polyclonal anti-CD41, C20) ; fluorescence verte : anti-CD154 (anticorps monoclonal anti-CD154, TRAP-1) ; fluorescence jaune : superposition des deux signaux. Image obtenue par microscopie confocale, acquisition de 20 plans sur un Nikon Eclipse E800 et analyse avec le logiciel PCM 2000 (objectif x 60).
Forme soluble du CD154
Des formes solubles du CD154, formes tronquées dérivées de la partie extracellulaire, sont produites à partir du CD154 membranaire lors de l’activation des lymphocytes T, la principale ayant un poids moléculaire de 18 kDa [16, 17]. Qu’elles soient natives ou recombinantes, ces formes solubles semblent se présenter sous forme oligomérique et surtout trimérique [16, 18]. Le CD154 est présent sous sa forme intégrale dans la plaquette, mais une forme soluble du CD154 de 18 kDa est également libérée par la plaquette lors de son activation [13, 19, 20]. Par analogie avec le TNFα [21], il est vraisemblable que la production des formes solubles du CD154 fait appel à un mécanisme protéolytique, qui n’a cependant pas été identifié ; la régulation de ce mécanisme par l’intégrine αIIbβ3 lierait la libération du CD154 soluble à l’adhérence plaquettaire [14]. Compte tenu de leur nombre dans la circulation, le réservoir de CD154 issu des plaquettes est de loin supérieur à celui des lymphocytes T. Cela suggère que les plaquettes pourraient être impliquées de façon prépondérante dans la genèse de la forme soluble du CD154 plasmatique [22].
Le CD154 soluble est capable de se fixer au CD40 et de reproduire la série de réponses biologiques résultant de l’engagement de celui-ci. Ce dernier point est cependant contesté pour le CD154 soluble dérivé des plaquettes, qui ne semble notamment pas capable d’engager le CD40 à la surface de la cellule endothéliale [23]. Cependant, l’augmentation de la concentration plasmatique de la forme soluble du CD154 chez les patients présentant différentes pathologies auto-immunes ou du système cardiovasculaire suggère que cette augmentation pourrait jouer un rôle pathologique [12] : le rôle biologique du CD154 soluble plasmatique reste donc encore une question ouverte. Cet article a pour objectif de faire le point sur les conséquences physiopathologiques de l’expression du CD154 à la surface des plaquettes activées, sans développer les aspects plus spécifiques liés au CD154 soluble.
CD154 plaquettaire : de nouvelles fonctions biologiques pour la plaquette
Agrégation plaquettaire
Les études utilisant des souris CD154-/- ont permis de conclure au rôle clé du CD154 dans la stabilisation de l’agrégat plaquettaire, comme pouvait en témoigner la fréquence de rupture des thrombus dans un modèle de thrombose expérimentale chez ces souris. L’anomalie se situe au niveau des interactions plaquettes/plaquettes à forces de cisaillement élevées, et l’administration de CD154 recombinant restaure ces interactions [24]. Le mécanisme par lequel le CD154 stabilise les interactions plaquettes/plaquettes doit encore être élucidé. Il pourrait interagir avec l’intégrine αIIb/β3 par le biais d’une séquence KGD présente sur la partie extracellulaire du CD154 : en effet, un CD154 soluble recombinant, dont la séquence KGD a été mutée, est incapable de restaurer la stabilité du thrombus chez les souris déficientes en CD154 [24].
Le CD154 plaquettaire tient également une place importante dans la coagulation, grâce à l’induction de l’expression du facteur tissulaire à la surface de la cellule endothéliale et des monocytes [25, 26]. Le facteur tissulaire est l’un des facteurs déclenchant la voie extrinsèque de la coagulation et la production de thrombine. Il est également impliqué dans l’angiogenèse et la réparation tissulaire (voir plus loin). Le CD154 plaquettaire pourrait ainsi participer à ces derniers événements, au moins indirectement par le biais de l’induction de l’expression du facteur tissulaire.
Réaction inflammatoire
Les effets du CD154 plaquettaire peuvent être analysés dans des expériences où les plaquettes activées sont cultivées en présence d’une cellule exprimant le CD40. Les données publiées ont essentiellement concerné la cellule endothéliale. Le CD154 plaquettaire a le même effet que le CD154 recombinant, à savoir une induction (ou une augmentation) de la production de chimiokines et de cytokines pro-inflammatoires et un accroissement de l’expression des molécules d’adhérence [6]. Cette action concourt à donner à l’endothélium un phénotype pro-inflammatoire, faisant du CD154 un inducteur potentiel de l’adhérence des cellules myélomonocytaires à l’endothélium. De plus, l’induction de la synthèse de facteur tissulaire confère à l’endothélium un phénotype procoagulant, contribuant également à la réaction inflammatoire, compte tenu des interactions croisées entre coagulation et inflammation.
Les cellules étoilées du foie et les cellules mésangiales glomérulaires jouent un rôle clé dans la pathologie inflammatoire du foie et du rein, respectivement. Ces cellules expriment le CD40 et répondent au CD154 par une sécrétion de chimiokines [27, 28], suggérant que le CD154 pourrait avoir un rôle important dans la pathologie rénale ou hépatique. La place du CD154 dans la réaction inflammatoire est soulignée dans les modèles de souris CD154-/-, chez qui la réponse inflammatoire à un stimulus antigénique est presque abrogée. Le rôle spécifique du CD154 plaquettaire n’a cependant pas été formellement démontré dans ces modèles [29].
Remodelage de la matrice extracellulaire
L’ensemble du processus de remodelage vasculaire peut être affecté par l’engagement du CD40 sur les cellules endothéliales et musculaires lisses. Le CD154 plaquettaire stimule la biosynthèse des métalloprotéases matricielles (MMP) 1, 2 et 9 et de la membrane typeMMP1 (MT-MMP1) par les cellules endothéliales. Son effet net sur la composition de la matrice extracellulaire est encore à établir. Le rôle du CD154 plaquettaire dans le remodelage vasculaire fait également intervenir le système de la plasmine, puisqu’il augmente l’expression des activateurs du plasminogène [30].
L’ensemble de ces résultats suggère un rôle important du CD154 dans le contrôle de la production de la matrice extracellulaire à la fois directement par le jeu de la régulation de l’expression des MMP et, indirectement, par le biais de la production de plasmine (Figure 3).
Figure 3
Le CD154 plaquettaire est à l’interface de la réaction inflammatoire, de la coagulation et du remodelage vasculaire, dans ses rapports avec l’endothélium.
Le CD40 est exprimé par la cellule endothéliale. L’interaction des plaquettes avec l’endothélium, par l’intermédiaire du couple CD154/CD40, a permis de repositionner la plaquette comme un acteur clé de la réaction inflammatoire, de la coagulation et du remodelage vasculaire, processus qui sont étroitement interdépendants (flèches vertes pointillées). L’induction de l’expression des récepteurs d’adhérence, directement dépendante de l’interaction CD154/CD40 ou secondaire à la production de cytokines/chimiokines pro-inflammatoires, est importante dans le recrutement des cellules myélomonocytaires. L’induction du facteur tissulaire (FT) concourt à donner un phénotype procoagulant à l’endothélium. Les cytokines/chimiokines pro-inflammatoires sont elles-mêmes responsables d’une activation de l’endothélium, avec induction des récepteurs d’adhérence et du facteur tissulaire, notamment, l’ensemble aboutissant à une amplification des signaux pro-inflammatoires et procoagulants. L’induction de la production des activateurs du plasminogène, u-PA et t-PA, est responsable de la production de plasmine, participant à l’activation protéolytique des MMP (métalloprotéases matricielles) 1 et 2. Les facteurs uPAR (récepteur de l’uPA) et MT1-MMP1 fixent et activent uPA et MMP-2, respectivement. Abréviations : voir légende du Tableau I.
Compétence immunologique du CD154 plaquettaire
Il a récemment été montré que le CD154 plaquettaire, comme le CD154 du lymphocyte T activé, pouvait servir de signal de costimulation dans l’activation des lymphocytes B. In vitro, le CD154 plaquettaire est capable d’activer les cellules dendritiques et d’induire la prolifération des lymphocytes B naïfs [15, 31]. Ces données sont renforcées par la démonstration in vivo, dans des modèles murins, du rôle du CD154 plaquettaire dans la réponse immunitaire contre des virus [32].
Le CD154 plaquettaire en pathologie humaine
Athérosclérose
Le CD154 est potentiellement un acteur clé dans la formation et la stabilité de la plaque d’athérome [33], puisqu’il peut influencer des événements majeurs tels que le recrutement des leucocytes ou des lymphocytes et la production de cytokines pro-inflammatoires et des MMP. Sa présence a de fait été mise en évidence sur les plaquettes infiltrant la plaque d’athérome [34]. Les modèles murins ont souligné le rôle critique du CD154 dans le développement de la plaque d’athérome [35] : l’absence du CD154 a pour conséquence non seulement une réduction de la taille de la plaque d’athérome, mais aussi une réduction de son contenu en lipides et une augmentation de son contenu en collagène, peut-être en raison d’un défaut de dégradation par les MMP [36]. Comme l’absence de CD154 réduit également la formation des thromboses [24], il est légitime de penser que le CD154 plaquettaire, du fait aussi de son abondance, tienne une responsabilité de premier plan dans la maladie athéromateuse.
Rejet de greffe
L’intervention du CD154 a été indirectement suggérée par la démonstration de l’augmentation de l’expression du CD40 sur l’endothélium des rejets de greffons [37]. Le lien entre CD154 plaquettaire et rejet de greffe doit cependant encore être précisé. Ainsi, les remarquables effets, sur la prévention du rejet de greffe, du blocage du couple CD40/CD154 par des anticorps [38] ne permettent pas de trancher quant à la contribution de l’effet de l’anticorps sur l’activation des lymphocytes B mais aussi sur celle de l’activation de l’endothélium du greffon par les plaquettes du receveur via leur CD154. Par ailleurs, la réaction du greffon contre l’hôte est également prévenue par la neutralisation du CD154 [39].
Auto-immunité
Le rôle du CD154 plaquettaire a surtout été étudié dans le purpura thrombopénique immunologique (PTI). Cette maladie se caractérise par la présence d’auto-anticorps ciblant des déterminants antigéniques présents sur les plaquettes, essentiellement la glycoprotéine GPIIb/IIIa, et responsables d’une destruction accélérée des plaquettes dans la rate et le foie. La capacité du CD154 plaquettaire à stimuler la prolifération des lymphocytes B et la différenciation des lymphocytes B autoréactifs dans le PTI a permis de suggérer l’implication du CD154 dans le processus d’auto-immunisation [15].
Pathologie rénale
L’implication du couple CD40/CD154 en pathologie rénale a été indirectement suggérée par la réduction marquée de l’incidence comme de la sévérité de la néphrite lupique murine par les anticorps bloquant le CD154 [40]. Ces données, confirmées dans d’autres modèles [41, 42], ont suggéré que les conséquences bénéfiques, sur la glomérulopathie, de la neutralisation du CD154 étaient en rapport avec un effet local, indépendant de l’inhibition de la production des auto-anticorps pathogènes, d’autant qu’il existe une augmentation importante de l’expression du CD40 glomérulaire dans la néphropathie lupique [43]. Des données expérimentales appuient cette hypothèse, puisque le CD154 des plaquettes de patients présentant un LED (lupus étythémateux disséminé) induit l’expression du CD40 sur les cellules mésangiales, stimule leur prolifération et augmente leur production de TGF-β [44]. L’engagement du CD40 des cellules mésangiales par le CD154 plaquettaire induit également la production de MCP-1 (monocyte chemoattractant protein-1) [28]. Ces données soulignent le rôle pathogène potentiel des plaquettes dans la genèse des lésions glomérulaires au cours du LED, et pourraient expliquer l’impact bénéfique potentiel des traitements visant à neutraliser le CD154.
Conclusions et perspectives
Les questions restant posées sont nombreuses et l’étude du CD154 plaquettaire est un domaine de recherche très actif. À titre d'exemple, le CD154 plaquettaire joue-t-il un rôle dans l’activation des cellules endothéliales au cours du LED, et donc dans la genèse des lésions de vascularites ? Quelle est sa responsabilité dans les autres atteintes inflammatoires viscérales ? Quel est son rôle dans le processus de fibrose tissulaire dans les connectivites, compte tenu de son action sur les protéines contrôlant le remodelage de la matrice extracellulaire ? Il est tentant de spéculer que l’ensemble de ces informations devrait élargir significativement la responsabilité des plaquettes en pathologie humaine.
Appendices
Remerciements
Travail soutenu par un Protocole hospitalier de recherche clinique du CHU de Bordeaux et par l’Association pour la recherche contre le cancer.
Références
- 1. Anitua E, Andia I, Ardanza B, et al. Autologous platelets as a source of proteins for healing and tissue regeneration. Thromb Haemost 2004 ; 91 : 4-15.
- 2. George JN. Platelets. Lancet 2000 ; 355 : 1531-9.
- 3. Martinez MC, Kunzelmann C, Freyssinet JM. Remodelage de la membrane plasmique et stimulation cellulaire. Med Sci (Paris) 2004 ; 20 : 189-95.
- 4. Weyrich AS, Zimmerman GA. Platelets: signaling cells in the immune continuum. Trends Immunol 2004 ; 25 : 489-95.
- 5. Fanslow WC, Srinivasan S, Paxton R, et al. Structural characteristics of cd40 ligand that determine biological function. Semin Immunol 1994 ; 6 : 267-78.
- 6. Van Kooten C, Banchereau J. Cd40-cd40 ligand. J Leuk Biol 2000 ; 67 : 2-17.
- 7. Chan FK, Chun HJ, Zheng L, et al. A domain in TNF receptors that mediates ligand-independent receptor assembly and signaling. Science 2000 ; 288 : 2351-4.
- 8. Van Kooten C, Banchereau J. Cd40-cd40 ligand: a multifunctional receptor-ligand pair. Adv Immunol 1996 ; 61 : 1-77.
- 9. Levy J, Espanol-Boren T, Thomas C, et al. Clinical spectrum of X-linked hyper-igM syndrome. J Pediatr 1997 ; 131 : 47-54.
- 10. Kuwana M, Nomura S, Fujimura K, et al. Effect of a single injection of humanized anti-cd154 monoclonal antibody on the platelet-specific autoimmune response in patients with immune thrombocytopenic purpura. Blood 2004 ; 103 : 1229-36.
- 11. Henn V, Slupsky JR, Grafe M, et al.Cd40 ligand on activated platelets triggers an inflammatory reaction of endothelial cells. Nature 1998 ; 391 : 591-4.
- 12. Aukrust P, Muller F, Ueland T, et al. Enhanced levels of soluble and membrane-bound cd40 ligand in patients with unstable angina. Possible reflection of t lymphocyte and platelet involvement in the pathogenesis of acute coronary syndromes. Circulation 1999 ; 100 : 614-20.
- 13. Otterdal K, Pedersen TM, Solum NO. Release of soluble cd40 ligand after platelet activation: studies on the solubilization phase. Thromb Res 2004 ; 114 : 167-77.
- 14. Furman MI, Krueger LA, Linden MD, et al. Release of soluble cd40L from platelets is regulated by glycoprotein iib/iiia and actin polymerization. J Am Coll Cardiol 2004 ; 43 : 2319-25.
- 15. Solanilla A, Pasquet JM, Viallard JF, et al. Platelet-associated cd154 in immune thrombocytopenic purpura. Blood 2005 ; 105 : 215-8.
- 16. Pietravalle F, Lecoanet-Henchoz S, Blasey H, et al. Human native soluble cd40l is a biologically active trimer, processed inside microsomes. J Biol Chem 1996 ; 271 : 5965-7.
- 17. Graf D, Muller S, Korthauer U, et al. A soluble form of trap (cd40 ligand) is rapidly released after t cell activation. Eur J Immunol 1995 ; 25 : 1749-54.
- 18. Karpusas M, Hsu YM, Wang JH, et al. 2A crystal structure of an extracellular fragment of human cd40 ligand. Structure 1995 ; 3 : 1031-9.
- 19. Weber AA, Hermann A, Rauch BH, Schror K. Molecular identity of platelet cd40 ligand (cd40l). Thromb Haemost 2001 ; 86 : 718.
- 20. Henn V, Steinbach S, Buchner K, et al. The inflammatory action of cd40 ligand (cd154) expressed on activated human platelets is temporally limited by coexpressed cd40. Blood 2001 ; 98 : 1047-54.
- 21. Moss ML, Lambert MH. Shedding of membrane proteins by adam family proteases. Essays Biochem 2002 ; 38 : 141-53.
- 22. Viallard JF, Solanilla A, Gauthier B, et al. Increased soluble and platelet-associated cd40 ligand in essential thrombocythemia and reactive thrombocytosis. Blood 2002 ; 99 : 2612-4.
- 23. Henn V, Slupsky JR, Grafe M, et al.Cd40 ligand on activated platelets triggers an inflammatory reaction of endothelial cells. Nature 1998 ; 391 : 591-4.
- 24. Andre P, Prasad KS, Denis CV, et al.Cd40l stabilizes arterial thrombi by a beta3 integrin-dependent mechanism. Nat Med 2002 ; 8 : 247-52.
- 25. Lindmark E, Tenno T, Siegbahn A. Role of platelet p-selectin and cd40 ligand in the induction of monocytic tissue factor expression. Arterioscler Thromb Vasc Biol 2000 ; 20 : 2322-8.
- 26. Slupsky JR, Kalbas M, Willuweit A, et al. Activated platelets induce tissue factor expression on human umbilical vein endothelial cells by ligation of cd40. Thromb Haemost 1998 ; 80 : 1008-14.
- 27. Schwabe RF, Schnabl B, Kweon YO, Brenner DA. Cd40 activates nf-kappa B and c-jun N-terminal kinase and enhances chemokine secretion on activated human hepatic stellate cells. J Immunol 2001 ; 166 : 6812-9.
- 28. Tanaka T, Kuroiwa T, Ikeuchi H, et al. Human platelets stimulate mesangial cells to produce monocyte chemoattractant protein-1 via the cd40/cd40 ligand pathway and may amplify glomerular injury. J Am Soc Nephrol 2002 ; 13 : 2488-96.
- 29. Lei XF, Ohkawara Y, Stampfli MR, et al. Disruption of antigen-induced inflammatory responses in cd40 ligand knockout mice. J Clin Invest 1998 ; 101 : 1342-53.
- 30. May AE, Kalsch T, Massberg S, et al. Engagement of glycoprotein iib/iiia (alpha[iib]beta3) on platelets upregulates cd40l and triggers cd40l-dependent matrix degradation by endothelial cells. Circulation 2002 ; 106 : 2111-7.
- 31. Czapiga M, Kirk AD, Lekstrom-Himes J. Platelets deliver costimulatory signals to antigen-presenting cells: a potential bridge between injury and immune activation. Exp Hematol 2004 ; 32 : 135-9.
- 32. Elzey BD, Tian J, Jensen RJ, et al. Platelet-mediated modulation of adaptive immunity. A communication link between innate and adaptive immune compartments. Immunity 2003 ; 19 : 9-19.
- 33. Prasad KS, Andre P, Yan Y, Phillips DR. The platelet cd40l/gp iib-iiia axis in atherothrombotic disease. Curr Opin Hematol 2003 ; 10 : 356-61.
- 34. Buchner K, Henn V, Grafe M, et al.Cd40 ligand is selectively expressed on cd4+t cells and platelets: implications for cd40-cd40l signalling in atherosclerosis. J Pathol 2003 ; 201 : 288-95.
- 35. Mach F, Schonbeck U, Sukhova GK, et al. Reduction of atherosclerosis in mice by inhibition of cd40 signalling. Nature 1998 ; 394 : 200-3.
- 36. Lutgens E, Gorelik L, Daemen MJ, et al. Requirement for cd154 in the progression of atherosclerosis. Nat Med 1999 ; 5 : 1313-6.
- 37. Reul RM, Fang JC, Denton MD, et al. Cd40 and cd40 ligand (cd154) are coexpressed on microvessels in vivo in human cardiac allograft rejection. Transplantation 1997 ; 64 : 1765-74.
- 38. Kirk AD, Harlan DM, Armstrong NN, et al.Ctla4-ig and anti-cd40 ligand prevent renal allograft rejection in primates. Proc Natl Acad Sci USA 1997 ; 94 : 8789-94.
- 39. Tamada K, Tamura H, Flies D, et al. Blockade of LIGHT/LTbeta and CD40 signaling induces allospecific T cell anergy, preventing graft-versus-host disease. J Clin Invest 2002 ; 109 : 549-57.
- 40. Kalled SL, Cutler AH, Datta SK, Thomas DW. Anti-cd40 ligand antibody treatment of snf1 mice with established nephritis: preservation of kidney function. J Immunol 1998 ; 160 : 2158-65.
- 41. Kairaitis L, Wang Y, Zheng L, et al. Blockade of cd40-cd40 ligand protects against renal injury in chronic proteinuric renal disease. Kidney Int 2003 ; 64 : 1265-72.
- 42. Ruth AJ, Kitching AR, Semple TJ, et al. Intrinsic renal cell expression of cd40 directs th1 effectors inducing experimental crescentic glomerulonephritis. J Am Soc Nephrol 2003 ; 14 : 2813-22.
- 43. Yellin MJ, D’Agati V, Parkinson G, et al. Immunohistologic analysis of renal cd40 and cd40l expression in lupus nephritis and other glomerulonephritides. Arthritis Rheum 1997 ; 40 : 124-34.
- 44. Delmas Y, Viallard JF, Solanilla A, et al. Activation of mesangial cells by platelets in systemic lupus erythematosus via a cd154 dependent induction of cd40. Kidney Int 2005 (sous presse).
List of figures
Figure 1
Expression du CD154 par les plaquettes sanguines.
Différents arguments suggèrent une localisation du CD154 au niveau des granules α, avec une extériorisation membranaire de la molécule lors de l’activation plaquettaire. A. Représentation schématique d’une plaquette sanguine positionnant les principaux organites et composants moléculaires, dont le CD154 (VWF, facteur von Willebrand ; TSP, thrombospondine ; PF4, facteur plaquettaire 4 ; β-TG, β-thromboglobuline ; PDGF, platelet derived growth factor ; TGF, transforming growth factor ; 5-HT, 5-hydroxytryptophane). B. Immunomarquage du CD154 (flèches rouges) sur la partie cytoplasmique d’une plaquette humaine non stimulée, montrant la présence de billes d’or au niveau des granules α. Image obtenue par microscopie électronique. Barre : 0,2 μm (P. Nurden, résultats non publiés).
Figure 2
L’origine du CD154 plaquettaire est probablement le mégacaryocyte.
Le CD154 est synthétisé par les mégacaryocytes. L’expression du CD154 est faible dans les mégacaryocytes, rendant sa détection difficile. Son expression est, par un mécanisme non élucidé, accrue dans le PTI (purpura thrombopénique immunologique), rendant possible la détection du CD154 et de son ARN messager dans le cytoplasme des mégacaryocytes de patients atteints. Immunofluorescence sur une préparation de mégacaryocytes d’un patient présentant un PTI. Fluorescence rouge : anti-GPIIb (anticorps polyclonal anti-CD41, C20) ; fluorescence verte : anti-CD154 (anticorps monoclonal anti-CD154, TRAP-1) ; fluorescence jaune : superposition des deux signaux. Image obtenue par microscopie confocale, acquisition de 20 plans sur un Nikon Eclipse E800 et analyse avec le logiciel PCM 2000 (objectif x 60).
Figure 3
Le CD154 plaquettaire est à l’interface de la réaction inflammatoire, de la coagulation et du remodelage vasculaire, dans ses rapports avec l’endothélium.
Le CD40 est exprimé par la cellule endothéliale. L’interaction des plaquettes avec l’endothélium, par l’intermédiaire du couple CD154/CD40, a permis de repositionner la plaquette comme un acteur clé de la réaction inflammatoire, de la coagulation et du remodelage vasculaire, processus qui sont étroitement interdépendants (flèches vertes pointillées). L’induction de l’expression des récepteurs d’adhérence, directement dépendante de l’interaction CD154/CD40 ou secondaire à la production de cytokines/chimiokines pro-inflammatoires, est importante dans le recrutement des cellules myélomonocytaires. L’induction du facteur tissulaire (FT) concourt à donner un phénotype procoagulant à l’endothélium. Les cytokines/chimiokines pro-inflammatoires sont elles-mêmes responsables d’une activation de l’endothélium, avec induction des récepteurs d’adhérence et du facteur tissulaire, notamment, l’ensemble aboutissant à une amplification des signaux pro-inflammatoires et procoagulants. L’induction de la production des activateurs du plasminogène, u-PA et t-PA, est responsable de la production de plasmine, participant à l’activation protéolytique des MMP (métalloprotéases matricielles) 1 et 2. Les facteurs uPAR (récepteur de l’uPA) et MT1-MMP1 fixent et activent uPA et MMP-2, respectivement. Abréviations : voir légende du Tableau I.
List of tables
Tableau I
Distribution ubiquitaire du CD40.
Ce tableau répertorie les types cellulaires exprimant le CD40. Il est à noter que l’expression du CD40 est en général faible, rendant difficile sa détection en conditions basales, cette expression étant accrue par un certain nombre de médiateurs de l’inflammation dont l’interféron γ, l’IL-1 ou le TNF-α. Pour l’ensemble de ces cellules, il existe une très abondante littérature concernant les effets de l’engagement du CD40 par le CD154 (voir par exemple [6]). Ce tableau ne mentionne que les conséquences fonctionnelles de l’engagement du CD40 par le CD154 plaquettaire, étudiées à ce jour seulement pour les cellules endothéliales et les cellules mésangiales glomérulaires. MCP-1 : monocyte chemoattractant protein 1 ; MT1-MMP : membrane type MMP1.