Abstracts
Résumé
Les mécanismes cellulaires et moléculaires de l’acquisition et de la mémorisation sont extrêmement complexes et mal compris. Ceux de l’oubli le sont moins encore, mais plusieurs théories ont été formulées pour tenter d’en expliquer les causes et les origines. De récentes découvertes ont révélé que l’oubli a des mécanismes et une base anatomique spécifiques, distincts de ceux de l’apprentissage et de la mémoire, mais faisant intervenir des protéines communes. Ils semblent dépendre en grande partie des protéine phosphatases, des enzymes abondantes dans le cerveau et capables de contrôler de nombreuses cibles biochimiques dans les cellules nerveuses. La formation de la mémoire, quant à elle, est assurée surtout par des protéines kinases. Mémoire et oubli sont en fait régis par un équilibre entre phosphatases et kinases qui détermine l’efficacité de l’apprentissage et la persistance des souvenirs. Cet article présente un bref aperçu des connaissances actuelles sur l’oubli. Elle récapitule ses principales caractéristiques et résume certaines des découvertes les plus récentes faites sur ses mécanismes potentiels.
Summary
The cellular and molecular mechanisms of learning and memory are extremely complex and not well understood. The mechanisms of forgetting are even further more unclear, but several theories have been formulated to explain their cause and origin. Forgeting has recently been revealed to recruit specific mechanisms and anatomical basis which some components are distinct from those of learning and memory. Forgetting appears to depend essentially on protein phosphatases, enzymes highly abundant in the brain that are able to regulate numerous biochemical targets in neurons. The formation of memory by contrast depends on protein kinases. Memory and forgeting are indeed reciprocally controlled by a balance between kinases et phosphatases that determines the efficacy of learning and the persistence of memory. This review provides a brief account of the main features of forgetting and a summary of the most recent findings on its potential mechanisms.
Article body
La mémoire est une fonction cérébrale d’une extrême complexité constituant la base fondamentale du comportement humain et animal, et un substrat essentiel à l’identité personnelle. Sa complexité réside dans la multiplicité des étapes nécessaires à sa construction, la variété de ses formes, la diversité des structures cérébrales qu’elle recrute et l’organisation élaborée des mécanismes cellulaires qui la régissent ((→) m/s 2000, n° 11, p. 1296). Les processus de mémorisation s’effectuent en plusieurs étapes successives. La première est le codage des informations reçues par les réseaux neuronaux, permettant un traitement immédiat des informations et leur représentation en traces mnésiques. L’efficacité de cette étape est déterminante car elle conditionne la qualité et la persistance des souvenirs formés. Les conditions d’apprentissage, le degré d’attention, la motivation, l’état physiologique et affectif doivent être optimisés pour un codage et une mémorisation efficaces. Après le codage, intervient une phase de stockage pendant laquelle les informations sont maintenues pour une période courte ou longue selon leur nature, leur contenu et leur importance. Les traces mnésiques ainsi établies sont progressivement consoli-dées et conservées à long terme, pour être ultérieurement rappelées et utilisées. La consolidation est un processus dynamique et graduel qui permet la réorganisation des informations, et confère aux traces acquises la stabilité nécessaire à leur rétention. Afin d’assurer cette stabilité, de nouvelles protéines doivent être synthétisées. C’est une étape qui semble liée au sommeil paradoxal qui, malgré son apparente inactivité, est capital pour la mémoire. Il a été démontré, par exemple, que la période lente du sommeil est essentielle à la consolidation de traces mnésiques acquises dans les circuits reliant le cortex aux noyaux thalamiques pendant les périodes de veille [1].
La capacité du cerveau à apprendre, mémoriser et utiliser de nouvelles informations est fascinante ((→) m/s 2003, n° 5, p. 625). Sa faculté d’évoquer consciemment des données de modalité, nature et origine diverses lui permet de faire rejaillir des souvenirs anciens et de reconstruire des scènes complexes et des expériences passées en quelques millièmes de secondes. Par exemple, si nous devons retrouver un livre dans la maison, notre mémoire nous permet de nous souvenir du livre en question, de sa taille, sa couleur, son contenu, du rayonnage de la bibliothèque où il se trouve, et, peut-être, du visage du libraire qui nous l’a vendu, ou de la voix de l’ami qui nous l’a recommandé. Grâce à notre mémoire, cette multitude d’informations est rapidement restituée, à tout moment et fidèlement, et dans un quelconque ordre chronologique. Pour qu’une telle reconstruction soit efficace et fiable, les traces mnésiques doivent être précises, facilement accessibles et solidement gravées afin d’être récupérées dans leur plus grande entièreté. En même temps, elles doivent rester modulables et actualisables au fil des expériences vécues car leur mise à jour est essentielle à leur utilisation dynamique. Ainsi, le souvenir de l’emplacement du livre devra être modifié au gré de son changement pour être plus tard utile. Ces propriétés constituent un formidable outil mental.
Le phénomène de l’oubli
Oubli, amnésie et extinction
Comme tout système biologique, cependant, l’apprentissage et la mémoire ont des limites et sont sujets à défaillance. Chaque étape conduisant à la formation de nouveaux souvenirs est soumise à de fortes contraintes, notamment temporelles. Durant l’apprentissage, une durée minimale d’exposition aux informations ou d’exercice mental doit être respectée pour un bon codage, car le traitement des informations est un processus lent qui requiert de nombreuses répétitions dont le rythme, la fréquence et l’organisation déterminent l’efficacité. Renouvelé à intervalles espacés, un apprentissage permet généralement un bon codage et une mémorisation durable. Mais lorsqu’il est court et hâtif, il ne forme qu’un souvenir flou et éphémère. Cette influence négative du temps et de la cadence d’entraînement sont des phénomènes universels observés chez l’homme et chez de nombreuses espèces animales.
L’évidence de leur portée a motivé Herman Ebbinghaus à les étudier expérimentalement vers la fin du xixe siècle. En manipulant le nombre de répétitions, leur délai et la durée des intervalles de rétention, H. Ebbinghaus a révélé des propriétés simples de la mémoire comme la relation entre la qualité du souvenir et son contenu, l’effet de la primauté et de la récence des informations sur le rappel, ou l’effet des intervalles sur le déclin de la mémoire [2, 3]. Ses travaux et ceux d’autres chercheurs, par la suite, ont souligné que l’une des plus fortes contraintes temporelles sur la mémoire est l’effet du temps sur sa pérennité. Hormis les souvenirs émotionnels, la mémoire se fragmente graduellement et perd sa stabilité et son acuité avec le temps. C’est le phénomène de l’oubli. L’oubli est caractérisé par une baisse des performances et la disparition involontaire de données acquises, soit après un travail d’apprentissage, soit incidemment par des processus automatiques. La perte d’informations, liée à un codage insuffisant ou superficiel, ne constitue pas l’oubli proprement dit. L’oubli stricto sensu est la perte d’informations dont le codage a été efficace et de bonne qualité. Bien que pénalisant, l’oubli reste néanmoins un phénomène normal et physiologique, nécessaire à l’équilibre du cerveau et permettant d’éviter la saturation des circuits neuronaux.
L’oubli se distingue de l’amnésie en ce qu’il n’est pas pathologique. Bien qu’affectant tout le monde et pouvant survenir à tout moment, il n’est pas systématique mais sporadique, et conduit à la perte de contenus précis et spécifiques. Il affecte davantage les informations de nature épisodique (expériences ou événements vécus) que sémantique (connaissances générales). En revanche, il épargne plus souvent les informations implicites comme les mémoires associatives et procédurales. L’amnésie, quant à elle, atteint souvent une catégorie plus grande et moins sélective de souvenirs et, dans certains cas, peut conduire à l’effacement d’une tranche entière de souvenirs. C’est une atteinte sérieuse et souvent irréversible du fonctionnement cognitif, engendrée par des lésions cérébrales et des troubles du système nerveux. L’oubli se distingue également de l’extinction, qui représente un affaiblissement progressif, par réapprentissage, de souvenirs associatifs. Par exemple, un animal conditionné à craindre un choc électrique associé à un son, réapprend rapidement que le son seul est inoffensif, s’il y est exposé plusieurs fois sans le choc électrique. La mémoire de l’association « son-choc » est mise en veille ou éteinte, et remplacée par celle du son sans le choc. Elle n’est cependant pas définitivement perdue et peut être ravivée par un indice de rappel. C’est le cas dans certains troubles anxieux, chez l’homme, comme les phobies ou l’état de stress post-traumatique, qui sont liés à des mémoires pathologiques contre lesquelles l’extinction peut constituer une thérapie atténuatrice.
Les théories de l’oubli
Les mécanismes de l’oubli sont encore mal connus au niveau moléculaire, mais plusieurs théories ont été proposées pour tenter d’en expliquer les causes et les origines (pour revue, voir [4]).
Le déclin naturel
La première théorie est celle du déclin naturel selon laquelle l’oubli est une perte d’informations résultant de la rareté ou de l’absence de rappel, plus généralement du manque d’exercice mental. Ainsi, un événement non remémoré depuis longtemps aura tendance à disparaître plus facilement de notre mémoire qu’un événement souvent évoqué mentalement ou verbalement. De même, des mots du langage rarement utilisés sont plus sujets à l’oubli que ceux fréquemment employés. Ces phénomènes pourraient s’expliquer par une dégradation passive et naturelle des traces mnésiques, due au passage du temps. Bien qu’initialement écartée par les psychologues expérimentalistes, cette théorie est aujourd’hui toujours valide [5].
L’inaccessibilité ou le rejet
Une autre théorie propose que l’oubli résulte de l’inaccessibilité momentanée d’informations provoquée par une déficience temporaire du rappel. Bien qu’intéressante, cette théorie explique mal, cependant, la perte permanente des souvenirs. Ses principes ont néanmoins servi de base à une autre théorie, celle de l’oubli motivé, dérivée des travaux de Freud. L’oubli motivé est un processus généralement sélectif, induit expérimentalement ou de façon volontaire, au cours duquel des souvenirs liés à un traumatisme ou à un stress sont refoulés dans l’inconscient et réprimés [6]. Mais il peut également affecter des informations neutres comme des mots ou des noms. Certains des réseaux de neurones activés lors de ce genre d’oubli ont récemment été identifiés et résident dans le cortex préfrontal latéral [7].
L’interférence
Une théorie de l’oubli également très étudiée est celle de l’interférence. Elle suggère que l’oubli intervienne lorsque les processus de mémorisation sont perturbés par le traitement simultané de données reçues avant ou après. Un phénomène de collision entre les mécanismes initiaux d’acquisition et de formation de souvenirs, et ceux de consolidation d’informations récemment acquises ou en cours d’acquisition interviendrait et cela sous deux formes : rétroactive ou proactive. Lors de l’interférence rétroactive, les informations les plus récentes perturberaient celles qui sont en cours de traitement, c’est-à-dire que les souvenirs nouvellement acquis et en cours de consolidation seraient vulnérables au réenclenchement de l’activité cérébrale lors d’un nouvel apprentissage. L’interférence rétroactive s’établirait avec un gradient temporel plus intense immédiatement après l’apprentissage. Cette théorie expliquerait, d’une part, la résistance des souvenirs anciens, et, d’autre part, le fait que la consolidation soit plus efficace après que les circuits neuronaux soient mis en veille comme lors du sommeil. Dans l’interférence proactive, c’est la formation de nouveaux souvenirs qui serait perturbée par le traitement en cours d’informations précédemment reçues. Bien que démontrée expérimentalement (par exemple lorsque deux listes de mots associés sont apprises successivement, la première est souvent mieux retenue que la seconde), cette théorie ne s’accorde pas avec l’observation selon laquelle le sommeil après apprentissage (simple ou multiple) a un effet bénéfique. De même, elle s’accorde peu avec des résultats récents d’imagerie cérébrale montrant que des circuits distincts sont recrutés lors de l’acquisition et de la consolidation d’informations [8]. En effet, puisque la théorie de l’interférence suppose que les étapes séquentielles du traitement des souvenirs interférent les unes avec les autres, elle suggère que des circuits et des mécanismes similaires soient mis en jeu. Des études sont donc encore nécessaires pour élucider ces mécanismes.
Défaut de reconsolidation
Une perte momentanée de mémoire peut également résulter de l’altération des processus de reconsolidation normalement enclenchés après évocation d’un souvenir, et nécessaires à la re-stabilisation des traces mnésiques redevenues labiles [9]. Ainsi, il n’est pas rare qu’une idée ou un souvenir soient perdus après avoir été rappelés peu de temps auparavant. C’est une étape indispensable au maintien des souvenirs qui, comme la consolidation, est lente et complexe.
Les mécanismes de l’oubli
Des molécules candidates
Bien que l’oubli ait des caractéristiques cognitives spécifiques, ses mécanismes moléculaires ont des points communs avec ceux de l’apprentissage et de la formation de souvenirs. Ils mobilisent des voies de signalisation similaires, mais qui sont réglées différemment. Ces mécanismes sont en fonctionnement constant chez l’adulte, et constituent des barrières cognitives naturelles, nécessitant un effort d’opposition permanent. Mal neutralisés ou exacerbés par le vieillissement, ils engendrent des déficiences cognitives. Des études génétiques, pharmacologiques et comportementales ont montré que deux familles de protéines jouent un rôle déterminant dans ces mécanismes : les protéine kinases et les protéine phosphatases [10-15]. Les kinases sont des enzymes capables (en général) de stimuler des protéines cibles de signalisation cellulaire, alors que les phosphatases les inhibent. Ensemble, kinases et phosphatases participent au contrôle de l’activité neuronale et de l’efficacité de l’apprentissage et de la formation de souvenirs.
Les protéine kinases
Des études in vitro et in vivo ont montré que les protéine kinases favorisent l’acquisition, la mémorisation, ainsi que la consolidation et la reconsolidation [16-18]. L’activité de plusieurs kinases augmente durant ces processus. Ainsi, des stimulations chimiques ou électriques simulant un apprentissage en culture, ou un entraînement chez l’animal, activent par exemple, la mitogen-activated protein-kinase (MAP-K), la protéine kinase A (PKA), la calcium-calmoduline protéine kinase II (CaMKII) ou la protéine kinase C (PKC) [19-22]. Le type de kinase et le degré d’activation dépendent du rythme et de l’intensité de la stimulation, des stimulus ou exercices répétés et espacés étant les plus efficaces.
Les protéine phosphatases
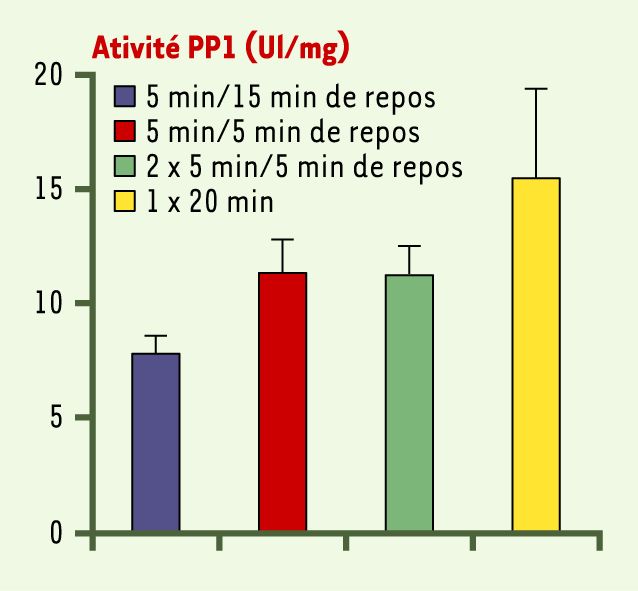
Afin d’assurer une homéostasie moléculaire, le recrutement massif des kinases due à l’activation neuronale est inhibé par la mobilisation simultanée de protéine phosphatases. Des travaux récents chez la souris ont démontré qu’au moins deux phosphatases, la protéine phosphatase 1 (PP1) et la calcineurine (PP2B), interviennent lors de l’acquisition et de la formation de souvenirs. Contrairement aux kinases, elles agissent comme de puissants ralentisseurs de l’acquisition et favorisent l’oubli. Ainsi, lorsque l’activité de la PP1 ou de la calcineurine est diminuée artificiellement dans le cerveau de souris par manipulation génétique, la formation de souvenirs est facilitée et l’oubli atténué [23, 24]. Des souris mutantes ayant une PP1 partiellement inhibée n’ont plus besoin d’un entraînement soutenu et distribué pour bien mémoriser des objets, contrairement aux animaux témoins, mais se contentent d’un exercice court et condensé (Figure 1, A-C) [24]. De même, elles apprennent plus rapidement à s’orienter dans l’espace et à naviguer vers une plate-forme échappatoire dans un bassin d’eau (Figure 2, A, B), et conservent un meilleur souvenir des informations spatiales (Figure 2C). Ces améliorations sont observées même lorsque la PP1 est bloquée seulement après apprentissage (Figure 2D), indiquant un effet positif de l’inhibition de la PP1 sur la consolidation, voire même sur le rappel. Il a été révélé qu’une telle inhibition existe de manière naturelle chez les souris témoins. Ainsi, l’activité de la PP1, élevée dans le cerveau au repos ou en début d’apprentissage, peut être naturellement inhibée lorsque l’apprentissage est suffisamment soutenu et fractionné par de longs intervalles de repos (Figure 3) [24]. Les mécanismes exacts de ce processus naturel restent toutefois inconnus.
Figure 1
La mémoire pour les objets est favorisée par l’inhibition de la protéine phosphatase 1 (PP1).
A. La tâche de reconnaissance d’objets. Une souris est placée en présence de trois objets nouveaux qu’elle apprend à reconnaître pendant une ou plusieurs sessions d’apprentissage. Son souvenir des objets est ensuite testé en plaçant l’animal à nouveau en présence de deux des objets familiers et d’un nouvel objet. Si elle se souvient des objets déjà rencontrés, la souris les explorera peu et sera plus intéressée par le nouvel objet. Une exploration préférentielle de cet objet reflète par conséquent sa mémoire pour les objets familiers. B. Des souris mutantes chez lesquelles la PP1 est inhibée dans le cerveau par expression d’un inhibiteur ont une meilleure mémoire que les souris témoins 5 minutes, 3 heures ou même 24 heures après l’apprentissage, lorsqu’il est répété et entrecoupé de brèves périodes de repos (5 sessions de 5 minutes espacées de 5 minutes). C. Seul un apprentissage avec de longues périodes de repos (15 minutes) permet aux souris témoins d’atteindre des performances comparables à celles des souris mutantes (d’après [24]).
Figure 2
Amélioration de la mémoire spatiale par inhibition de la protéine phosphatase 1 (PP1).
A. Photographie d’un bassin d’eau contenant une plate-forme échappatoire immergée. Les souris doivent retrouver la plate-forme en s’orientant grâce aux repères placés dans la salle d’expérimentation qu’elles doivent mémoriser. B. Courbe d’apprentissage spatial. Les latences représentent le temps passé par l’animal à chercher la plate-forme lors de sessions de 90 secondes (maximum). Une session s’arrête lorsque l’animal monte sur la plate-forme. La diminution progressive des latences reflète un apprentissage spatial. Les souris mutantes apprennent la position de la plate-forme plus rapidement que les souris témoins. C. Effet de l’inhibition de la PP1 sur la mémoire spatiale pendant et après apprentissage. La mémoire spatiale est testée en mesurant le temps passé par l’animal à chercher la plate-forme dans chaque quadrant du bassin après que celle-ci ait été retirée de l’eau. Une recherche préférentielle dans le quadrant d’apprentissage (ayant contenu la plate-forme) indique une bonne mémoire spatiale. La mémoire est testée un jour après l’apprentissage (rétention 0) puis toutes les deux semaines pendant huit semaines. D. Effet de l’inhibition de la PP1 induite uniquement après apprentissage sur la mémoire spatiale (idem C) (d’après [24]).
Figure 3
La protéine phosphatase 1 (PP1) est inhibée naturellement après un apprentissage espacé sur la tâche de reconnaissance d’objets.
L’activité de la PP1 est mesurée dans le cerveau de souris témoins après une ou deux sessions de 5 minutes en présence d’objets nouveaux suivies de 5 ou 15 minutes de repos, ou après une seule session de 20 minutes sans repos (d’après [24]).
L’effet de l’inhibition génétique de la PP1 bénéficie aux animaux mutants jeunes, mais également aux animaux âgés. Il leur permet de recouvrer leur faculté d’apprentissage et de mémorisation, laquelle décline au cours du vieillissement (mêmes effets observés avec l’inhibition de la calcineurine). Ces résultats indiquent que la PP1 et la calcineurine sont vraisemblablement en partie responsables de ce déclin. En effet, des quantités anormalement élevées de PP1 et de calcineurine ont été décelées dans le cerveau de rats âgés [27]. De plus, expérimentalement, lorsqu’un excès de phosphatase calcineurine est induit dans le cerveau de souris par manipulation génétique, la formation de nouveaux souvenirs est ralentie et l’oubli est favorisé [25, 26]. Lorsqu’il est induit brièvement après apprentissage, cet excès empêche le rappel d’informations déjà mémorisées, sans toutefois les effacer totalement [26]. Néanmoins, il est probable qu’un excès prolongé de calcineurine ou de PP1 détruise ces souvenirs définitivement.
Les cibles des protéine phosphatases
La barrière moléculaire sur l’apprentissage et la mémorisation, formée par les kinases et les phosphatases, fonctionne par régulation de multiples composés neuronaux communs aux deux familles de protéines. La plupart de ces composés n’ont pas encore été identifiés, mais il est reconnu que ce sont des protéines membranaires comme des récepteurs de neurotransmetteurs et des canaux ioniques, intracellulaires comme les kinases, les phosphatases (qui se règlent réciproquement), des protéines structurales ou des protéines nucléaires comme les facteurs de transcription. Les substrats de la PP1 (et cibles de kinases) connus pour être impliqués sont le récepteur glutamatergique GluR1, la CaMKII, et le facteur de transcription CREB (cAMP-response element binding protein) [24, 28].
Les bases anatomiques de l’oubli
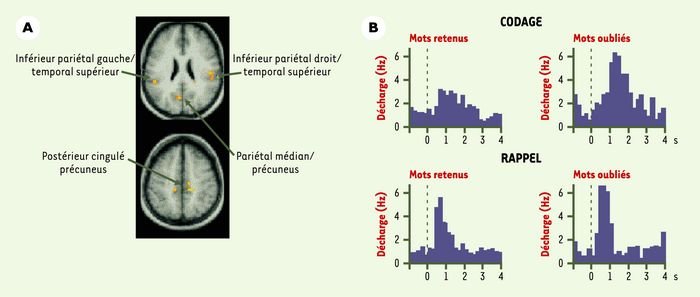
Au-delà de sa spécificité moléculaire, l’oubli a également une spécificité anatomique. Des études récentes d’imagerie fonctionnelle, chez l’homme, ont révélé que des structures ciblées du cerveau s’activent sélectivement lors de l’oubli. Des zones circonscrites du cortex cérébral comme le cortex inférieur pariétal, postérieur cingulé, pariétal médian et précuneus sont, par exemple, plus fortement activées lors du codage de mots ensuite oubliés que des mots retenus [29] (Figure 4A). De même, des neurones de l’hippocampe ont un taux de décharge plus élevé pendant le codage d’associations de mots moins bien mémorisées [30] (Figure 4B). Cette corrélation entre activité neuronale et oubli peut paraître paradoxale car, intuitivement, on s’attendrait à une réduction d’activité cérébrale lors de l’oubli. Cependant, elle indique que l’oubli n’est pas un phénomène passif mais actif, et confirme que des processus cognitifs sélectifs existent pour diminuer l’efficacité du codage et de la mémorisation.
Figure 4
Corrélats anatomiques et électrophysiologiques de l’oubli.
A. Zones du cortex cérébral préferentiellement activées lors du traitement de mots plus facilement oubliés (d’après [31]). B. Histogramme des réponses de décharge électrique de cellules de l’hippocampe lors de l’apprentissage de paires de mots, correctement retenues ou oubliées (d’après [30]).
Conclusions
Le développement et l’exploitation de nouvelles techniques d’analyse fine ont permis d’élucider certains aspects fondamentaux de la mémoire et de ses défaillances, comme l’existence de processus spécifiques de l’oubli. La juste appréciation et l’analyse détaillée de ces processus constituent un point critique à une meilleure compréhension des mécanismes intimes des fonctions cognitives.
Appendices
Remerciements
Le laboratoire est financé par l’école Fédérale Polytechnique de Zurich, le Fond National Suisse, le Pôle National de Recherche « Plasticité Neurale et Réparation », Human Frontier Science Program, EMBO, UBS, Novartis Research Foundation, Roche Research Foundation. Mes remerciements aux arbitres pour leurs critiques constructives.
Références
- 1. Steriade M, Timofeev I. Neuronal plasticity in thalamocortical networks during sleep and waking oscillations. Neuron 2003 ; 37 : 563-76.
- 2. Ebbinghaus H. Uber das Gedachtnis. New York : Dover, 1885.
- 3. Hintzman DL. Theoretical implications of the spacing effect. In : Solso RL, ed. Theories in cognitive psychology : the Loyola Symposium. Hillsdale : Erlbaum, 1974 : 77-99.
- 4. Wixted JT. The psychology and neuroscience of forgetting. Annu Rev Psychol 2004 ; 55 : 235-69.
- 5. Altmann EM, Gray WD. Forgetting to remember : the functional relationship of decay and interference. Psychol Sci 2002 ; 13 : 27-33.
- 6. Anderson MC, Green C. Suppressing unwanted memories by executive control. Nature 2001 ; 410 : 319-20.
- 7. Anderson MC, Ochsner KN, Kuhl B, et al. Neural systems underlying the suppression of unwanted memories. Science 2004 ; 303 : 232-5.
- 8. Finkenauer C, Luminet O, Gisle L, et al. Flashbulb memories and the underlying mechanisms of their formation : toward an emotional-integrative model. Mem Cognit 1998 ; 26 : 516-31.
- 9. Nader K, Schafe GE, LeDoux JE. The labile nature of consolidation theory. Nat Rev Neurosci 2000 ; 1 : 216-9.
- 10. Wang JH, Ko GY, Kelly PT. Cellular and molecular bases of memory : synaptic and neuronal plasticity. J Clin Neurophysiol 1997 ; 14 : 264-93.
- 11. Tokuda M, Hatase O. Regulation of neuronal plasticity in the central nervous system by phosphorylation and dephosphorylation. Mol Neurobiol 1998 ; 17 : 137-56.
- 12. Lisman JE, McIntyre CC. Synaptic plasticity : a molecular memory switch. Curr Biol 2001 ; 11 : R788-91.
- 13. Weeber EJ, Sweatt JD. Molecular neurobiology of human cognition. Neuron 2002 ; 33 : 845-8.
- 14. Izquierdo LA, Barros DM, Vianna MR, et al. Molecular pharmacological dissection of short- and long-term memory. Cell Mol Neurobiol 2002 ; 22 : 269-87.
- 15. Abel T, Lattal KM. Molecular mechanisms of memory acquisition, consolidation and retrieval. Curr Opin Neurobiol 2001 ; 11 : 180-7.
- 16. Wallenstein GV, Vago DR, Walberer AM. Time-dependent involvement of PKA/PKC in contextual memory consolidation. Behav Brain Res 2002 ; 133 : 159-64.
- 17. Kelly A, Laroche S, Davis S. Activation of mitogen-activated protein kinase/extracellular signal-regulated kinase in hippocampal circuitry is required for consolidation and reconsolidation of recognition memory. J Neurosci 2003 ; 23 : 5354-60.
- 18. Abel T, Lattal KM. Molecular mechanisms of memory acquisition, consolidation and retrieval. Curr Opin Neurobiol 2001 ; 11 : 180-7.
- 19. Wu GY, Deisseroth K, Tsien RW. Activity-dependent CREB phosphorylation : convergence of a fast, sensitive calmodulin kinase pathway and a slow, less sensitive mitogen-activated protein kinase pathway. Proc Natl Acad Sci USA 2001 ; 98 : 2808-13.
- 20. Lisman J, Schulman H, Cline H. The molecular basis of CaMKII function in synaptic and behavioural memory. Nat Rev Neurosci 2002 ; 3 : 175-90.
- 21. Shobe J. The role of PKA, CaMKII, and PKC in avoidance conditioning : permissive or instructive ? Neurobiol Learn Memory 2001 ; 77 : 291-312.
- 22. Selcher JC, Weeber EJ, Varga AW, et al. Protein kinase signal transduction cascades in mammalian associative conditioning. Neuroscientist 2002 ; 8 : 122-31.
- 23. Malleret G, Haditsch U, Genoux D, et al. Reversible enhancement of learning, memory and long-term potentiation by genetic inhibition of the protein phosphatase calcineurin. Cell 2001 ; 104 : 675-86.
- 24. Genoux D, Haditsch U, Knobloch M, et al. The protein phosphatase 1 is a molecular constraint on learning and memory. Nature 2002 ; 418 : 970-5.
- 25. Mansuy IM, Mayford M, Jacob B, et al. Restricted and regulated overexpression reveals calcineurin as a key component of the transition from short-term to long-term memory. Cell 1998 ; 92 : 39-49.
- 26. Mansuy IM, Winder DG, Moallem TM, et al. Inducible and reversible gene expression with the rtTA system for the study of memory. Neuron 1998 ; 21 : 257-65.
- 27. Foster TC, Sharrow KM, Masse JR, et al. Calcineurin links Ca2+ dysregulation with brain aging. J Neurosci 2001 ; 21 : 4066-73.
- 28. Silva AJ, Kogan JH, Frankland PW, Kida S. CREB and memory. Annu Rev Neurosci 1998 ; 21 : 127-48.
- 29. Otten LJ, Rugg MD. When more means less : neural activity related to unsucessful memory encoding. Curr Biol 2001 ; 11 : 1528-30.
- 30. Cameron KA, Yashar S, Wilson CL, Fried I. Human hippocampal neurons predict how well word pairs are later remembered. Neuron 2001 ; 30 : 289-98.
- 31. Wagner A, Davachi L. Forgetting of things past. Curr Biol 2001 ; 11 : R964-7.
List of figures
Figure 1
La mémoire pour les objets est favorisée par l’inhibition de la protéine phosphatase 1 (PP1).
A. La tâche de reconnaissance d’objets. Une souris est placée en présence de trois objets nouveaux qu’elle apprend à reconnaître pendant une ou plusieurs sessions d’apprentissage. Son souvenir des objets est ensuite testé en plaçant l’animal à nouveau en présence de deux des objets familiers et d’un nouvel objet. Si elle se souvient des objets déjà rencontrés, la souris les explorera peu et sera plus intéressée par le nouvel objet. Une exploration préférentielle de cet objet reflète par conséquent sa mémoire pour les objets familiers. B. Des souris mutantes chez lesquelles la PP1 est inhibée dans le cerveau par expression d’un inhibiteur ont une meilleure mémoire que les souris témoins 5 minutes, 3 heures ou même 24 heures après l’apprentissage, lorsqu’il est répété et entrecoupé de brèves périodes de repos (5 sessions de 5 minutes espacées de 5 minutes). C. Seul un apprentissage avec de longues périodes de repos (15 minutes) permet aux souris témoins d’atteindre des performances comparables à celles des souris mutantes (d’après [24]).
Figure 2
Amélioration de la mémoire spatiale par inhibition de la protéine phosphatase 1 (PP1).
A. Photographie d’un bassin d’eau contenant une plate-forme échappatoire immergée. Les souris doivent retrouver la plate-forme en s’orientant grâce aux repères placés dans la salle d’expérimentation qu’elles doivent mémoriser. B. Courbe d’apprentissage spatial. Les latences représentent le temps passé par l’animal à chercher la plate-forme lors de sessions de 90 secondes (maximum). Une session s’arrête lorsque l’animal monte sur la plate-forme. La diminution progressive des latences reflète un apprentissage spatial. Les souris mutantes apprennent la position de la plate-forme plus rapidement que les souris témoins. C. Effet de l’inhibition de la PP1 sur la mémoire spatiale pendant et après apprentissage. La mémoire spatiale est testée en mesurant le temps passé par l’animal à chercher la plate-forme dans chaque quadrant du bassin après que celle-ci ait été retirée de l’eau. Une recherche préférentielle dans le quadrant d’apprentissage (ayant contenu la plate-forme) indique une bonne mémoire spatiale. La mémoire est testée un jour après l’apprentissage (rétention 0) puis toutes les deux semaines pendant huit semaines. D. Effet de l’inhibition de la PP1 induite uniquement après apprentissage sur la mémoire spatiale (idem C) (d’après [24]).
Figure 3
La protéine phosphatase 1 (PP1) est inhibée naturellement après un apprentissage espacé sur la tâche de reconnaissance d’objets.
Figure 4
Corrélats anatomiques et électrophysiologiques de l’oubli.