Abstracts
Résumé
La localisation et l’identification de deux gènes de prédisposition au cancer du sein et/ou de l’ovaire, BRCA1 et BRCA2, ont permis l’introduction dans les nouvelles pratiques cliniques, de tests biologiques de prédisposition génétique destinés aux personnes supposées à haut risque. La diffusion de ces nouvelles pratiques médicales et biologiques se fait avec les difficultés traditionnelles de toute activité innovante, auxquelles peuvent s’ajouter de fortes incertitudes relatives à la revendication de droits de propriété sur les gènes et au financement des actes médicaux et biologiques. Dans ce contexte, l’évolution de l’offre de tests de prédisposition génétique est analysée à travers deux enquêtes réalisées pour décrire les profils d’activité en 1998 et en 2001 de l’ensemble des acteurs médicaux impliqués en France dans ces nouvelles pratiques : les médecins assurant les consultations d’oncologie génétique, les centres où ont lieu ces consultations spécialisées et les laboratoires associés réalisant les analyses de biologie moléculaire.
Summary
One example of the recent advances of scientific research on the human genome is the identification of two susceptibility genes to breast/ovarian cancer, BRCA1 and BRCA2, making possible the introduction in medical practices of genetic testing to detect patients with an increased risk of developing such cancers. In this context of diffusion, two surveys were carried out to appraise the activity profiles in 1998 and in 2001 of all the different participants in those new medical practices in France, physicians in charge of genetic counselling, medical centres where consultations take place and laboratories. Results show that over the period 1998-2001, few changes occurred, mainly the reduction of the average waiting time to get the result of a genetic test, the increase in the annual number of BRCA2 families identified to a level similar to the one of BRCA1 and the automation of the biological analyses without noting a considerable increase in the annual output of laboratories till 2001 however. This surprising moderate evolution must be connected to the existence of some particular external factors making the framework of the development of these new medical and biological practices and their future really uncertain. The diffusion of BRCA1/2 genetic testing has been carried out facing the traditional difficulties of any innovating activities, but also the uncertainties related to intellectual property rights on genes and the reimbursement of genetic counselling and biological testing. These uncertainties have certainly restrained the pace of change as many actors in this field have opted for a wait and see strategy bearing in mind the possible future constraints imposed to their future activity, especially if European patents on the BRCA1/2 genes are finally granted by the European patent office (EPO).
Article body
Le débat sur la brevetabilité des gènes humains, apparu en Europe dès l’adoption par le Parlement européen en 1998 de la directive 98/44 CE sur les inventions biotechnologiques [1] et alimenté par l’octroi de brevets par l’office européen (OEB), a fait découvrir les enjeux autour des nouvelles pratiques médicales issues de la recherche sur le génome, comme les tests de prédisposition génétique au cancer du sein ou de l’ovaire.
Les consultations d’oncologie génétique ont été introduites en France entre 1986 et 1989 [2]. Elles ont pour but d’informer les sujets et d’évaluer leurs risques d’être génétiquement prédisposés, c’est-à-dire d’être porteurs d’une mutation délétère sur un gène de prédisposition, BRCA1 [3] ou BRCA2 [4] pour le cancer du sein/ovaire. La prédisposition génétique au cancer du sein est caractérisée par un risque élevé de cancer du sein (multiplié par un facteur 6 à 8 par rapport à celui de la population générale), transmis selon le mode autosomique dominant, et qui représente environ 5 % des cancers du sein. La recherche de prédisposition génétique commence par l’analyse biologique de la personne associée au risque le plus élevé dans la famille d’être porteur d’une mutation. Cette personne est définie sur la base de l’histoire individuelle (âge plus précoce de survenue du cancer, plusieurs cancers associés…) et familiale. Cette première recherche est techniquement lourde : elle nécessite l’analyse de la séquence codante des gènes. Si une mutation est identifiée, un test peut être réalisé chez les autres membres de la famille supposés à risque et venant en consultation. Ce test est alors simple et consiste à vérifier la présence ou l’absence de la mutation reconnue chez le cas index.
En cas d’identification de la mutation, une surveillance clinique et mammographique particulière et des mesures prophylactiques telles que la chirurgie peuvent être proposées ((→) m/s 2001, n° 10, p. 1027).
Ces pratiques médicales et biologiques innovantes se sont structurées en France au sein de chaque centre de consultation spécialisé en intégrant au fur et à mesure les nouveautés en termes de dispositifs législatifs (décret n°2000-570 du 23 juin 2000 fixant les conditions de prescription et de réalisation des examens des caractéristiques génétiques), de recommandations médicales [5-7], et de technologie de biologie moléculaire. Le développement de ces pratiques s’est aussi accompagné d’une incertitude liée à une absence de financement garanti et à l’issue incertaine de l’examen des brevets, donc des contraintes d’exercice qui pourraient en découler.
L’objectif de cet article est d’analyser, à travers deux enquêtes menées en 1998 et 2001, l’évolution de l’activité clinique et biologique autour des tests BRCA1/2 en fonction des mesures de régulation qui lui ont été appliquées.
Évolution de l’offre de tests de prédisposition génétique au cancer du sein ou de l’ovaire
Deux enquêtes transversales ont été menées en France respectivement en 1998 et en 2001 auprès de l’ensemble des médecins assurant les consultations d’oncologie génétique spécialisées sein/ovaire. Les consultations ont été réalisées dans des centres qui, en 1998 (39 médecins répartis dans 32 centres) comme en 2001 (34 médecins répartis dans 28 centres), sont en majorité des centres régionaux de lutte contre le cancer (CRLCC), des centres hospitaliers régionaux universitaires (CHRU) et dans le reste des cas, d’autres structures, principalement des établissements privés.
En 2001, 797 familles avec une mutation BRCA1/2 (cas index) ont été identifiées depuis le début de l’activité, 573 pour BRCA1 (72 %) et 224 pour BRCA2 (28 %), ce qui représente en moyenne par centre, 25 familles BRCA1 et 10 familles BRCA2. Le délai moyen pour un résultat de première recherche était encore supérieur à un an en 2001.
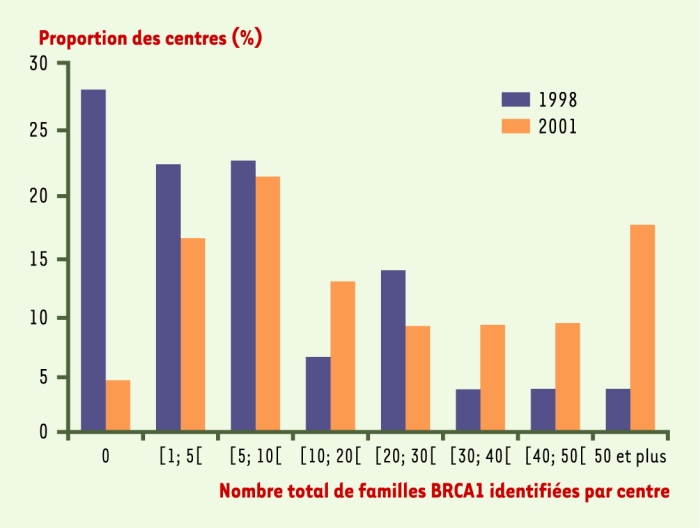
L’évolution de la répartition des centres en fonction du nombre total de familles identifiées est détaillée dans la Figure 1 pour BRCA1 et dans la Figure 2 pour BRCA2.
Figure 1
Répartition des centres en fonction du nombre total de familles identifiées avec une mutation BRCA1 (n = 32 en 1998 ; n = 28 en 2001).
Figure 2
Répartition des centres en fonction du nombre total de familles identifiées avec une mutation BRCA2 (N = 32 en 1998 ; N = 28 en 2001).
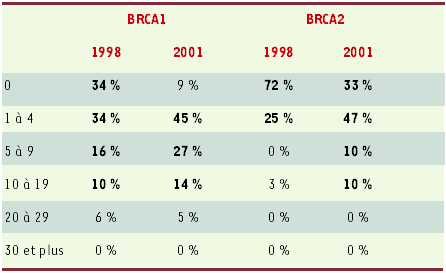
L’évolution de l’activité annuelle des centres est détaillée dans le Tableau I. Pour BRCA1, il existe une augmentation entre 1998 et 2001, toutefois cette évolution n’est pas spectaculaire : en 2001, 19 % des centres ont au moins 10 mutations de plus par an contre 16 % en 1998. Pour BRCA2, le changement est plus net : 67 % des centres déclarent en 2001 avoir eu dans l’année au moins une nouvelle famille BRCA2 contre 28 % en 1998. Ainsi, en matière d’identification de nouvelles mutations familiales, si l’on constate une augmentation de l’activité annuelle des centres, celle-ci est due principalement à un rattrapage du niveau d’identification de familles BRCA2 par rapport à l’activité qui existait déjà sur BRCA1.
Tableau I
Nombre annuel de nouvelles familles identifiées avec une mutation BRCA1/2 : répartition des centres et comparaison 1998-2001 (n = 32 en 1998 ; n = 28 en 2001).
En 2001, le nombre total d’apparentés avec une mutation BRCA1/2 détectée est de 570 pour BRCA1 dont 176 en 2001 et de 191 pour BRCA2 dont 82 en 2001. Ainsi, fin 2001, pour chaque cas index avec une mutation BRCA1/2 identifiée, les consultations avaient jusqu’alors permis de mettre en évidence en moyenne un parent porteur de la mutation familiale (BRCA1 : 570 familles sur 573 ; BRCA2 : 191 familles sur 224).
Parmi les centres interrogés, en 1998, on comptait 14 laboratoires pour BRCA1 et 7 pour BRCA2. En 2001, 14 (50 %) disposaient sur place d’un laboratoire pour BRCA1 et 12 (43 %) pour BRCA2. Si les centres n’ont pas de laboratoire sur place, ils font appel à un prestataire, le plus souvent CRLCC ou CHRU.
Enfin, en trois ans, les laboratoires ont massivement opté pour une automatisation des analyses avec l’utilisation de la DHPLC (denaturing high performance liquid chromatography). En 2001, 79 % (11/14) des laboratoires emploient la technique de DHPLC pour BRCA1 et 75 % (9/12) pour BRCA2. La DHPLC est utilisée par 73 % de ces laboratoires (8/11) pour cribler la totalité de la séquence codante de BRCA1, suivie du séquençage direct ciblé des fragments d’ADN susceptibles de porter des mutations, et par 67 % (6/9) pour BRCA2.
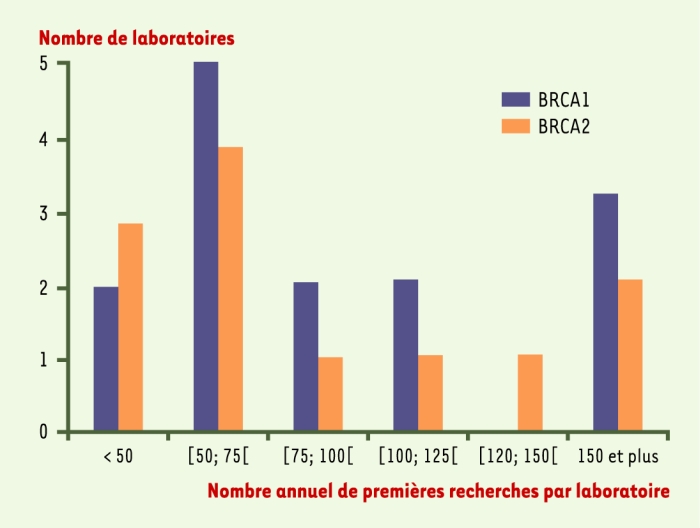
Sur le plan de l’activité de tests pour BRCA1/2, les laboratoires font les analyses pour leur centre, mais aussi très souvent pour des consultations extérieures. La part des échantillons « hors centre » représente en 2001, selon les laboratoires, entre 10 % et 90 % (médiane : 20 %) de leur activité BRCA1/2. En 2001, les laboratoires ont une activité de premières recherches assez hétérogène qui se situe encore très souvent à un niveau faible : environ 65 % des laboratoires en réalisent annuellement moins de 100 respectivement sur BRCA1 et BRCA2 (Figure 3).
Figure 3
L’activité 2001 de premières recherches de mutation familiale sur BRCA1/2 des laboratoires français interrogés (N = 14 pour BRCA1 ; N = 12 pour BRCA2).
Pour BRCA1, 36 % (5/14) réalisent annuellement au moins 100 premières recherches et 14 % moins de 50 (2/14). Pour BRCA2, 33 % (4/12) en réalisent au moins 100 et 25 % (3/12) moins de 50.
Au total, ces enquêtes montrent une évolution en France de l’activité des centres de consultations d’oncologie génétique spécialisée sein/ovaire et des laboratoires associés sur la période 1998-2001, mais les changements sont assez limités.
Les raisons de cette évolution
Cette évolution modeste, observée en France, s’explique certainement par la situation d’attente dans laquelle se trouvent les professionnels exerçant dans ce domaine du fait de l’incertitude portant sur certains facteurs extérieurs comme les brevets sur les gènes et le financement des actes. Rappelons le contexte de diffusion de ces pratiques.
En Europe, l’Office européen des brevets (OEB) a accordé à la firme Myriad Genetics trois brevets sur BRCA1/2, actuellement en cours de procédure d’opposition [8, 9]. Les laboratoires européens réalisent donc les analyses tout en craignant devoir tout arrêter si l’OEB devait finalement accorder ces brevets vivement contestés [10].
Aux États-Unis, les brevets sur BRCA1/2 accordés par l’office américain (USPTO) à Myriad Genetics ont créé une situation de monopole absolu dont certaines caractéristiques limitent fortement l’efficience de la diffusion de ces examens et les investissements de recherche de firmes concurrentes [11, 12]. Ils ont en effet permis à la firme d’organiser seule l’activité de tests BRCA1/2 sur le territoire américain et d’écarter les laboratoires qui avaient commencé à commercialiser ces nouveaux diagnostics ((→) m/s 2000, n° 1, p. 26) [13, 14]. Cette firme est actuellement la seule à réaliser la première recherche de mutation chez les cas index, avec un délai de 2 à 3 semaines, par la technique du séquençage direct qui n’est pas la plus coût-efficace (plus de 2 500 $ par recherche) [12]. Toutefois, des accords ont été signés en 2000, entre Myriad Genetics et les instituts de recherche américains NCI (National Cancer Institute) [15] et NIH (National Institute of Health) [16] pour garantir au NCI et au NIH un coût plus bas pour leurs recherches diagnostiques en échange d’une exclusivité sur leurs travaux, et en 2001 avec la compagnie LabCorp pour lui donner l’exclusivité aux États-Unis de la réalisation des tests des apparentés et des mutations fréquentes contre la diffusion commerciale, à travers son réseau de distribution, des tests de Myriad Genetics.
En France, pour le financement des actes, il n’existe pas de cotation à la nomenclature. Jusqu’en 2002, cette activité était financée par le budget des établissements auquel s’ajoutait une aide financière nécessaire, prise sur des fonds de recherche et émanant d’associations caritatives ou de programmes hospitaliers de recherche clinique. Cette situation s’est modifiée fin 2002 grâce à un appel d’offres de la DHOS (Direction des hôpitaux et de l’organisation des soins) (circulaire DHOS/OPRC n° 454 du 14 août 2002) visant à attribuer sous condition aux laboratoires un budget de fonctionnement pour leur activité de tests de prédisposition génétique. Ainsi, plus d’une dizaine de laboratoires sont désormais financés pour la réalisation des tests BRCA1/2. En Europe, l’organisation du remboursement des tests est variable. Aux États-Unis, quelques accords ont été signés avec des sociétés privées d’assurance et des HMO (health maintenance organization) [17].
Ces facteurs spécifiques, surtout réglementaires, ont vraisemblablement conduit à la situation de statu quo observée au niveau de la diffusion et de l’organisation des pratiques en France. L’évolution décrite révèle que la diffusion des tests BRCA1/2, et plus largement de l’activité d’oncologie génétique, se trouvait encore dans une situation intermédiaire, caractérisée par une hésitation des acteurs de santé concernés à augmenter l’offre de conseil et de diagnostic du fait des incertitudes qui subsistent concernant les droits de propriété intellectuelle sur les gènes ((→) m/s 2000, n° 1, p. 94). Deux évolutions alternatives apparaissent encore possibles pour cette activité en France.
La première est l’absence de monopolisation des tests par la firme en raison, soit du refus de l’OEB d’accorder les brevets, soit du recours au principe de licence d’office en cas d’attribution des brevets [8, 18]. Dans ce cas, l’organisation existante ne serait pas remise en cause par un facteur extérieur, mais une réflexion devrait toutefois s’amorcer, d’une part sur certaines lacunes du système comme les délais de réalisation des analyses, et d’autre part sur l’optimisation économique des pratiques [12].
La deuxième évolution est au contraire la reconnaissance pour la firme d’une position de monopole, qui conduirait soit à une distribution directement sur le marché privé, soit plus probablement à la « capture » du système socialisé par la firme. Cette mainmise s’accompagnerait vraisemblablement d’une réorganisation profonde du réseau actuel avec l’octroi d’une licence exclusive à un seul laboratoire sur les 17 existants (dont trois hors de cette étude). Les premières recherches seraient faites par la firme aux États-Unis, donc par une stratégie d’analyse peu efficiente (coût-efficacité), et les tests des apparentés et des mutations fréquentes seraient réalisés par le laboratoire licencié. Comme dans notre pays, la prescription directe des tests pour les personnes déjà malades, peut être faite par les médecins spécialistes d’organes (décret d’application des lois de bioéthique de 1994 n° 2000-570 du 23 juin 2000), la maîtrise des coûts de l’offre d’examens deviendrait plus difficile. Se poserait aussi le problème délicat du financement du prestataire étranger, que ce soit dans le contexte d’un financement à l’acte, avec un risque d’explosion du nombre de tests dû à la logique de profit du laboratoire privé, ou dans le cas d’une dotation globale, mode de remboursement retenu en France, avec un risque cette fois de limitation du nombre de tests dû à l’utilisation par la firme d’une stratégie d’analyse très coûteuse.
En outre, cette activité de transfert se trouve dans une situation où l’on retrouve les facteurs classiques de diffusion de l’innovation, mais aussi ceux plus spécifiques de l’identification d’un risque sur une base biologique, susceptibles de jouer beaucoup sur la demande réelle d’examens. Nous ne ferons qu’évoquer parmi ces derniers, la question de l’assurance [19-21] et les risques de discrimination [14, 22] qui peuvent dissuader les patients de réaliser ces tests [23, 24]. Si ces risques sont très présents outre-Atlantique, où 68 % des généticiens spécialisés en cancérologie craindraient pour eux-mêmes une discrimination de la part de leur assurance maladie [23], il semble que la législation française, beaucoup plus protectrice, soit un facteur favorisant davantage la demande de tests (lois de bioéthique et loi n° 2002-303 de mars 2002 relative aux droits des malades et à la qualité du système de santé). Dans tous les cas, la notion de diffusion de l’information dans les familles est essentielle à prendre en compte, car les médecins ne peuvent pas informer directement les apparentés à risque de l’existence d’une mutation familiale. Les chiffres rapportés dans notre étude d’un proche testé positif pour un cas index prédisposé confirment les résultats précédemment trouvés de deux apparentés testés suivant l’identification d’une mutation chez un cas index [25]. L’interprétation de ces résultats doit cependant tenir compte de la dynamique de demande de tests à l’intérieur des familles, modulée notamment par l’âge des apparentés non malades et par le fait que la circulation de cette information se fait majoritairement en direction des femmes apparentées au premier degré [26].
Conclusions
Dans le domaine de l’oncologie génétique, l’évolution en France du contexte de réalisation de ces actes médicaux et biologiques, notamment sur les plans réglementaire et financier, laisse prévoir une réorganisation profonde du système actuel imposée par de nouvelles contraintes d’exercice et de service rendu aux patients.
Appendices
Remerciements
Nous souhaitons vivement remercier les médecins du Groupe Génétique et Cancer qui ont participé à ces enquêtes : Claude Adenis, Jacques-Olivier Bay, Catherine Bélichard, Pascaline Berthet, Yves-Jean Bignon, Valérie Bonadona, Hélène Cannoni, Anne-Marie Capodano, Annie Chevrier, Agnès Chompret, Suzette Delaloge, Liliane Demange, Hélène Dreyfus, Catherine Dugast, Marc Frenay, Jean-Pierre Fricker, Marion Gauthier-Villars, Paul Gesta, Brigitte Gilbert, Rosine Guimbaud, Philippe Jonveaux, Christine Lasset, Dominique Leroux, Jean-Marc Limacher, Michel Longy, Alain Lortholary, Elisabeth Luporsi, Christine Maugard, Hervé Mignotte, Mireille Mousseau, Tan Dat Nguyen, Sonia Nizard, Sylviane Olschwang, Fabienne Prieur, Pascal Pujol, Annick Rossi, Florent Soubrier, Dominique Stoppa-Lyonnet, Hélène Stora de Novion et Philippe Vennin. Nous voulons remercier tout particulièrement le docteur François Eisinger qui en plus d’avoir participé à ces deux enquêtes, a aussi contribué à l’amélioration de ce manuscrit.
Références
- 1. Blumberg-Mokri M. Les inventions biotechnologiques. Biofutur 2002 ; 218 : 42-3.
- 2. Sobol H, Bignon YJ, Bonaiti C, et al. Four years analysis of cancer genetic clinics activity in France form 1994 to 1997 : a survey on 801 patients. Dis Markers 1999 ; 15 : 1-15.
- 3. Miki Y, Swensen J, Shattuck-Eiders D, et al. A strong candidate for the breast and ovarian susceptibility gene BRCA1. Science 1994 ; 266 : 66-71.
- 4. Wooster R, Bignell G, Lancaster J, et al. Identification of the breast cancer susceptibility gene BRCA2. Nature 1995 ; 378 : 789-92.
- 5. Expertise collective Inserm. Risques héréditaires de cancer du seinet de l’ovaire : quelle prise en charge? Paris : Inserm, 1998 : 636 p.
- 6. Eisinger F, Alby N, Bremond A, et al. Recommendations for medical management of hereditary breast and ovarian cancer : the French National Ad Hoc Committee. Ann Oncol 1998 ; 9 : 939-50.
- 7. American Society of Clinical Oncology. Statement of the American Society of Clinical Oncology : Genetic testing for cancer susceptibility. J Clin Oncol 1996 ; 14 : 1730-6.
- 8. Butler D, Goodman S. French researchers take a stand against cancer gene patent. Nature 2001 ; 413 : 95-6.
- 9. Benowitz S. French challenge to BRCA1 patent underlies European discontent. J Natl Cancer Inst 2002 ; 94 : 80-1.
- 10. Wadman M. Testing time for gene patent as Europe rebels. Nature 2001 ; 413 : 443.
- 11. Sevilla C, Julian-Reynier C, Eisinger F, et al. The impact of gene patents on the cost-effective delivery of care : The case of BRCA1 genetic testing. Int J Technol Assess Health Care 2003 ; 19 : 287-300.
- 12. Sevilla C, Moatti JP, Julian-Reynier C, et al. Testing for BRCA1 mutations : A cost-effectiveness analysis. Eur J Hum Genet 2002 ; 10 : 599-606.
- 13. Brower V. Testing, testing… testing ? Nat Med 1997 ; 3 : 131-2.
- 14. Kaufert PA. Health policy and the new genetics. Soc Sci Med 2000 ; 51 : 821-9.
- 15. Reynolds T. NCI-Myriad agreement offers BRCA testing at reduced cost. J Natl Cancer Inst 2000 ; 92 : 596.
- 16. Hollon T. NIH researchers receive cut-price BRCA test. Nat Med 2000 ; 6 : 610.
- 17. Cassier M, Gaudillière JP. Recherche, médecine et marché : la génétique du cancer du sein. Sci Soc Santé 2000 ; 18 : 29-49.
- 18. Gold ER, Caulfield TA. The moral tollbooth : A method that makes use of the patent system to address ethical concerns in biotechnology. Lancet 2002 ; 359 : 2268-70.
- 19. Zick CD, Smith KR, Mayer RN, Botkin JR. Genetic testing, adverse selection, and the demand for life insurance. Am J Med Genet 2000 ;93 : 29-39.
- 20. Hoel M, Iversen T. Genetic testing when there is a mix of compulsory and voluntary health insurance. J Health Econ 2002 ; 21 : 253-70.
- 21. Strohmenger R, Wambach A. Adverse selection and categorical discrimination in the health insurance markets: the effects of genetic tests. J Health Econ 2000 ; 19 : 197-218.
- 22. Müller H. Genetic testing for cancer predisposition-an ongoing debate. Lancet Oncol 2000 ; 1 : 118-9.
- 23. Matloff ET, Shappell H, Brierley K, et al. What would you do ? Specialists’ perspectives on cancer genetic testing, prophylactic surgery, and insurance discrimination. J Clin Oncol 2000 ; 18 : 2484-92.
- 24. Peterson EA, Milliron KJ, Lewis KE, et al. Health insurance and discrimination concerns and BRCA1/2 testing in a clinic population. Cancer Epidemiol Biomarker Prev 2002 ; 11 : 79-87.
- 25. Julian-Reynier C, Sobol H, Sevilla C, et al. Uptake of hereditary breast/ovarian cancer genetic testing in a French national sample of BRCA1 families. Psycho- Oncology 2000 ; 9 : 504-10.
- 26. Julian-Reynier C, Eisinger F, Chabal F, et al. Disclosure to the family of breast/ovarian cancer genetic test results : patient’s willingness and associated factors. Am J Med Genet 2000 ; 94 : 13-8.
List of figures
Figure 1
Répartition des centres en fonction du nombre total de familles identifiées avec une mutation BRCA1 (n = 32 en 1998 ; n = 28 en 2001).
Figure 2
Répartition des centres en fonction du nombre total de familles identifiées avec une mutation BRCA2 (N = 32 en 1998 ; N = 28 en 2001).
Figure 3
L’activité 2001 de premières recherches de mutation familiale sur BRCA1/2 des laboratoires français interrogés (N = 14 pour BRCA1 ; N = 12 pour BRCA2).
List of tables
Tableau I
Nombre annuel de nouvelles familles identifiées avec une mutation BRCA1/2 : répartition des centres et comparaison 1998-2001 (n = 32 en 1998 ; n = 28 en 2001).