Abstracts
Résumé
Les mucines sont des macromolécules recouvrant les cellules en contact avec le milieu extérieur et protégeant les épithéliums contre toutes sortes d’agressions d’origine endogène ou exogène (sucs digestifs, micro-organismes, polluants, toxines…). Les mucines représentent le composant principal du mucus et sont le plus souvent synthétisées par des cellules épithéliales spécialisées dans les fonctions de stockage et de sécrétion. Les gènes codant pour les apomucines chez l’homme partagent des éléments communs : ARNm de très grande taille, longues régions codantes répétitives de type VNTR (variable number of tandem repeats), expression tissulaire et cellulaire complexe. Depuis 1987, 21 symboles MUC ont été utilisés pour désigner des gènes codant pour des glycoprotéines possédant le plus souvent un domaine peptidique de type mucin-like, riche en proline, thréonine et sérine, et organisé en répétitions en tandem de motifs élémentaires plus ou moins conservés. Cette terminologie tend donc à faire perdre toute signification fonctionnelle au terme mucine. Si les « mucinistes » parlent de dérive ou d’abus de langage, ils ont néanmoins des difficultés à proposer des limites nettes à la définition des mucines, dans la mesure où le rôle précis joué par ces molécules dans l’homéostasie ou la tumorigenèse épithéliales n’est pas encore élucidé. Cet article propose des éléments susceptibles de définir et de classer les gènes MUC et leurs produits.
Summary
Mucins are macromolecules lying the cells in contact with external environment and protect the epithelium against constant attacks such as digestive fluids, microorganisms, pollutants, and toxins. Mucins are the main components of mucus and are synthesized and secreted by specialized cells of the epithelium (goblet cells, cells of mucous glands) or non mucin-secreting cells. Human mucin genes show common features : large size of their mRNAs, large nucleotide tandem repeat domains, complex expression both at tissular and cellular level. Since 1987, 21 MUC symbols have been used to designate genes encoding O-glycoproteins containing tandem repeat domains rich in serine, threonine and proline. Some of these genes encode true mucins while others encode non mucin adhesion O-glycoproteins. In this paper, we propose a classification based on sequence similarities and expression areas. Two main families can be distinguished : secreted mucins or gel-forming mucins (MUC2, MUC5AC, MUC5B, MUC6), and membrane-bound mucins (MUC1, MUC3, MUC4, MUC12, MUC17). Muc-deficient mice will provide important models in the study of functional relationships between these two mucin families.
Article body
Les termes mucus, muqueuse et mucines sont apparus il y a plusieurs siècles dans le vocabulaire médical[1]. Le concept de « rôle protecteur des organes creux » attribué à la sécrétion de mucus et à ses constituants les plus caractéristiques, les mucines, est donc très ancien, mais reste toujours très actuel. Pourtant, les mucines, de même que la notion de protection, sont difficiles à définir aujourd’hui pour deux raisons. D’une part, les mucines, initialement étudiées par les glycobiologistes, intéressent maintenant d’autres disciplines, et les critères de définition les concernant sont donc de nature extrêmement variable selon les biologistes moléculaires (combien de gènes ? Quels symboles ? Quelle nomenclature ?), les biologistes cellulaires (quelles fonctions à l’extérieur et à l’intérieur des cellules, et dans quelles cellules ?), les immunologistes (spécificité de l’anticorps antimucine ? Épitope « sucre » ou « peptide » ? Masqué par la glycosylation ? Spécifique de cellules tumorales ?) ou les anatomopathologistes (quel type de marqueur ? Associé à la différenciation cellulaire, la progression tumorale, la réaction inflammatoire ?). D’autre part, l’idée selon laquelle le mucus serait un piège, un filtre ou un écran protecteur inerte semble correspondre à une notion trop restrictive du concept de protection épithéliale. Il semble bien que les propriétés de protection requièrent la mise en oeuvre de processus intégrant le concept d’homéostasie épithéliale et sont indissociables des fonctions d’échanges et d’informations des cellules épithéliales, et des mécanismes de renouvellement des épithéliums. Les cellules épithéliales qui, dans l’organisme, constituent souvent la frontière naturelle entre le « dehors » et le « dedans », ont la propriété remarquable, sur le plan morphologique et fonctionnel, d’être polarisées. Cette polarité cellulaire résulte de processus spécifiques de synthèse et de routage de molécules qui permettent la sécrétion de mucus au pôle apical et, au pôle basolatéral, l’établissement de connexions avec la matrice extracellulaire et entre les cellules par l’intermédiaire des jonctions serrées [1].
Le mucus est un gel très hydraté (95 % d’eau) qui recouvre la lumière des organes creux de l’organisme tels que le tractus digestif, les voies respiratoires ou l’appareil génital. Les mucines, qui sont des glycoprotéines filamenteuses de très haute masse moléculaire, porteuses de milliers de chaînes O-glycanniques et capables de former un réseau macromoléculaire par l’établissement de ponts disulfures, sont responsables des propriétés rhéologiques (élasticité, viscosité, filance, adhérence) du mucus. Les travaux de la période 1960-1990 ont permis la caractérisation physicochimique des chaînes glycanniques et du squelette peptidique, à partir de préparations de mucines purifiées d’origine tissulaire provenant d’espèces variées de mammifères. Ces travaux ont montré des constantes structurales : masse moléculaire élevée (pouvant atteindre plusieurs millions de Da, sous forme polymérique), richesse en chaînes O-glycanniques (60 % à 80 % du poids sec), richesse en proline, thréonine, sérine (20 % à 55 % de la composition en acides aminés), présence de vastes domaines glycosylés résistant à la protéolyse et, enfin, existence de courtes régions « nues » libérées par protéolyse.
La communauté des « mucinistes » s’attendait donc à ce que le clonage des gènes d’apomucines (gènes MUC) révèle une très vaste famille de gènes. Par ailleurs, la détection des ARNm de mucines sous forme de longues traînées (smears) sur les Northern blots a constitué immédiatement un argument supplémentaire en faveur de l’hétérogénéité moléculaire des mucines observées dans les préparations de mucines purifiées [2].
Qu’en est-il, quinze ans après le clonage du gène MUC1 ? Les mucines ont toujours été l’objet d’études biochimiques délicates. Le clonage moléculaire de gènes contenant de longues régions codantes répétitives de 10 à 20 kb s’est avéré lui aussi très laborieux. À ce jour, 21 symboles MUC existent dans la littérature, qui ne désigneraient pas tous des mucines. Les glycoprotéines de type « mucine » ne peuvent pas être classées selon des critères liés à leur chaînes glycanniques. La seule base consensuelle actuelle est celle reposant sur les gènes codant pour les apomucines. Deux familles s’individualisent assez clairement, un troisième groupe rassemblant les « inclassables » et les gènes pour lesquels la légitimité du symbole MUC peut être discutée [3] (Tableau I).
Tableau I
Classification des mucines.
Mucines sécrétées (« vraies mucines »), exprimées par le complexe MUC
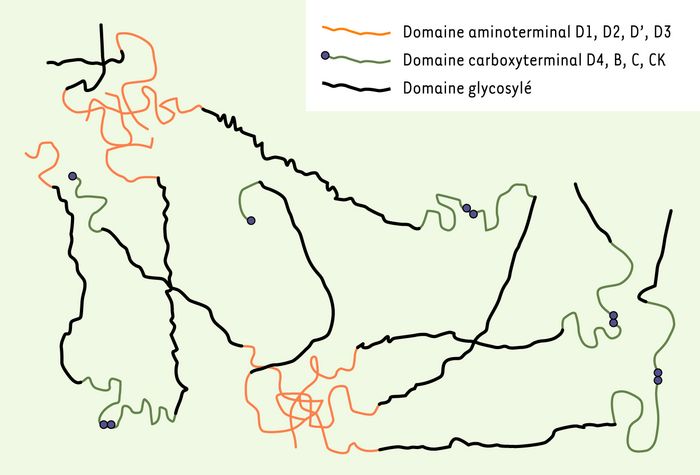
Il s’agit des mucines codées par quatre gènes volumineux, physiquement proches et localisés sur le chromosome 11 en p15.5 [4]. MUC2, MUC5AC et MUC5B sont transcrits dans un sens, alors que MUC6 est transcrit dans l’autre sens. Les membres de ce complexe présentent de très grandes homologies de séquence et dérivent probablement d’un gène ancestral commun [5]. Leurs séquences peptidiques déduites sont organisées selon un même schéma structural (Figure 1).
Figure 1
Représentation d’une apomucine sécrétée.
Ces apomucines sont sécrétées par des cellules spécialisées de l’épithélium, cellules caliciformes et cellules des glandes muqueuses. Elles sont constituées de domaines juxtaposés, D1, D2, D’, D3, D4, B, C et CK (cystin knot, domaine à « noeud cystine »), qui montrent un degré élevé d’homologie avec les domaines correspondants du préprofacteur von Willebrand. Le domaine CK permet la dimérisation.
Les domaines riches en cystéine D1, D2, D’, D3, D4, B, C et CK (cystein knot, domaine à noeud cystine) sont ordonnés de façon similaire dans le préprofacteur von Willebrand (vWF) : ils apparaissent donc comme des modules doués de propriétés de polymérisation efficaces dans la constitution de macromolécules ayant des propriétés d’adhérence [6]. Les molécules mosaïques que sont les apomucines MUC2, MUC5AC, MUC5B et MUC6 (la séquence de MUC6 humaine est encore partielle, celle de MUC6 murine est publiée) ont chacune un domaine caractéristique et spécifique, le domaine TR, constitué d’unités répétitives potentiellement O-glycosylables.
Les monomères d’apomucines, dont la taille varie de 600 à 1 200 kDa, se dimériseraient d’abord par leur domaine CK et, grâce aux nombreux résidus cystéine de la partie aminoterminale, formeraient des oligomères puis des multimères responsables de la formation du réseau tridimensionnel du gel de mucus [7] (Figure 2). C’est la raison pour laquelle ces mucines doivent être considérées comme les « vraies » mucines (gel forming mucins), au sens donné par les glycobiologistes.
Figure 2
Formation d’oligomères de mucines sécrétées grâce à l’établissement de ponts disuflure.
Les domaines carboxyterminaux contribuent à l’étape initiale de dimérisation par leur domaine CK (cystein knot) (•), tandis que les domaines aminoterminaux permettent l’oligomérisation et l’organisation de la structure tridimensionnelle du gel de mucus.
Une caractéristique essentielle de ces quatre apomucines sécrétées est leur expression typique de cellules épithéliales spécialisées dans le stockage et la sécrétion apicale de grains de mucus : cellules caliciformes pour MUC2 et MUC5AC, glandes muqueuses pour MUC5B et MUC6. Les organes mucipares d’origine endodermique présentent les niveaux d’expression les plus élevés. Les ARNm des apomucines sécrétées sont exprimés en continu au cours du développement, dans les organes mucipares formés à partir de l’intestin primitif et selon des profils d’expression cellulaire et tissulaire complexes, différents de ceux des organes adultes [8].
Le rôle des apomucines du complexe MUC au cours de la différenciation ou de la croissance des cellules mucipares conduit à s’intéresser à leur domaine CK. En effet, celui-ci est présent à l’extrémité carboxyterminale de nombreuses protéines constituant la famille des protéines à noeud cystine. Cette famille, riche de plus de quarante membres - TGF-β (transforming growth factor β), activines, inhibines, NGF (nerve growth factor), GDNF (glial cell derived neurotrophic factor), NDP (Norrie disease protein [pseudoglioma]), protéines morphogénétiques de l’os… - est impliquée dans des fonctions biologiques très variées, ayant toutefois en commun la différenciation cellulaire, le contrôle de la croissance et la morphogenèse [9, 10].
Les mucines sécrétées sont considérées comme des acteurs importants dans les mécanismes de protection des épithéliums (barrière sélective, hydratation, lubrification, piégeage de micro-organismes) [6] et de réparation des épithéliums lésés [11], et jouent un rôle dans la tumorigenèse épithéliale [12, 13].
Mucines épithéliales membranaires
MUC1 (1q21) et MUC4 (3q29) codent pour les mucines de ce groupe les mieux caractérisées sur les plans structural et fonctionnel. Les données concernant MUC3A, MUC3B, MUC11, MUC12, et récemment MUC17 [14, 15], accréditent l’hypothèse d’un complexe multigénique appelé jusque là MUC3(Figure 3).
Figure 3
Représentation des apomucines membranaires.
Les apomucines épithéliales membranaires sont synthétisées par l’ensemble des cellules épithéliales. Ces mucines possèdent un domaine transmembranaire. MUC1 et MUC4 sont les protéines de ce groupe les mieux caractérisées. MUC3A, 3B, MUC12 et MUC17, dont les gènes sont localisés en 7q22, pourraient représenter un complexe multigénique. EGF : epidermal growth factor ; SEA : sea urchin sperm protein enterokinase agrin ; AMOP : adhesion-associated domain in MUC4 and other proteins.
Par opposition aux mucines sécrétées, ces macromolécules ont été désignées parfois mucin-like. Elles peuvent être détectées en grande quantité dans le mucus et contribuent à ses propriétés physicochimiques et biologiques, même si elles sont dépourvues des domaines peptidiques responsables de l’assemblage tridimensionnel du gel de mucus. Comme en témoignent les nombreuses études réalisées sur tissus épithéliaux adultes ou en développement, les cellules mucosécrétrices coexpriment le plus souvent une ou plusieurs mucines sécrétées et une ou plusieurs mucines membranaires. Dans la cellule mucosécrétrice et les cellules de son lignage, il semble exister une coordination d’expression et vraisemblablement de fonction entre mucines sécrétées et mucines membranaires. Sur des modèles cellulaires en culture, le blocage du trafic intracellulaire des mucines sécrétées entraîne une expression compensatrice de mucines membranaires [16].
À la différence des mucines sécrétées, les mucines membranaires sont exprimées par de nombreux types de cellules épithéliales non spécialisées de l’organisme. Comme les mucines sécrétées, elles sont de volumineuses O-glycoprotéines de structure filamenteuse, porteuses de centaines, voire de milliers, de chaînes O-glycanniques, et dont le squelette peptidique est agencé en domaines juxtaposés. Le domaine répétitif porteur des sucres est également codé par un seul exon volumineux (7 à 19 kb pour MUC4), ce qui favorise un polymorphisme interindividuel de longueur de type VNTR (variable number of tandem repeats) [17].
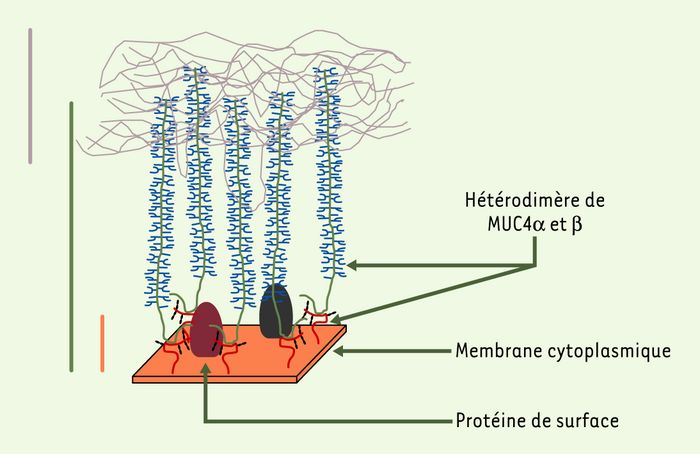
Les mucines membranaires existent sous différentes formes moléculaires, selon les types cellulaires, les organes et l’état physiopathologique [14, 18]. Au total, les formes moléculaires multiples de MUC1 et de MUC4 se présentent sous la forme de variants membranaires (présence du domaine transmembranaire), sécrétés (absence du domaine transmembranaire) ou solubles (clivage protéolytique d’un variant transmembranaire). La signification biologique et physiopathologique des différentes formes moléculaires de ces mucines est encore inconnue. En raison de leur conformation rigide et étirée (200 à 500 nm pour MUC1, 1 200 à 2 000 nm pour MUC4), ces molécules chargées négativement dépassent largement au pôle apical l’ensemble des molécules du glycocalyx (10 nm) et contribueraient à maintenir ouvertes les lumières canalaires (pour MUC1) et à la protection des surfaces épithéliales des muqueuses (pour MUC4) (Figure 4).
Figure 4
Mucines membranaires et protection cellulaire.
Ce schéma montre une première ligne de défense (trait vertical gris) constituée par le gel de mucus (mucines sécrétées du complexe 11p15) pouvant inclure des formes sécrétées d’autres mucines. Une deuxième ligne de défense (trait vertical vert) est constituée par les mucines membranaires. MUC4 est représentée à la surface cellulaire sous la forme d’une structure hétérodimérique comportant un domaine MUC4 α de type VNTR (variable number of tandem repeats), représenté en vert, et un domaine MUC4 β associé à la membrane, représenté en rouge. Ces deux domaines sont liés de façon non covalente. La taille de MUC4 varie entre 1,2 et 2 μm selon les individus. Le trait vertical orange délimite le glycocalyx, d’une épaisseur estimée à 10 nm.
La région carboxyterminale de MUC4 comporte 12 domaines, dont deux de type EGF-like. Son homologue chez le rat a une organisation peptidique très similaire et interagit avec le proto-oncogène ErbB2 [19, 20].
Les mucines MUC1 et MUC4 sont surexprimées dans de nombreux carcinomes. Les molécules produites par les cellules carcinomateuses présentent des anomalies de routage (distribution membranaire circonférentielle et non plus apicale). Leur structure filamenteuse rigide déstabiliserait les interactions cellule-cellule (fonction d’anti-adhérence) et cellule-matrice extracellulaire, et permettrait la mobilité cellulaire au cours de l’organogenèse épithéliale ou de la progression tumorale et de la dissémination métastatique.
Les « inclassables »
Le gène MUC7 code pour une petite O-glycoprotéine sécrétée spécifiquement par les cellules séreuses des glandes salivaires et bronchiques. Cette protéine adhère à de nombreux micro-organismes et se comporte comme un agent antimicrobien de la cavité orale [3]. MUC8 est représenté par un ADN complémentaire (ADNc) partiel isolé en 1994. Il n’a pas fait depuis l’objet d’autres études de caractérisation [3]. MUC9 (OVGP1) est le gène codant pour une petite O-glycoprotéine appelée oviductine, exprimée spécifiquement par l’épithélium sécrétoire de la trompe de Fallope. Le gène MUC13 code pour une petite O-glycoprotéine transmembranaire récemment identifiée, dont la région carboxyterminale présente des similarités avec MUC3 [3]. Le gène MUC15 code pour une N- et pour une O-glycoprotéine dont la forme longue est transmembranaire et la forme courte, résultant d’un épissage alternatif, est sécrétée [21]. Le gène MUC 16 code pour une volumineuse O-glycoprotéine de type mucin-like, dépourvue des domaines caractéristiques des mucines et exprimée dans les cellules de cancer de l’ovaire (AgCA125) [3]. Très récemment, deux gènes MUC19 ont été mis en évidence : l’un coderait pour une protéine sécrétée et apparentée structuralement à la famille des gènes du complexe MUC localisé en 11p15 [22], l’autre coderait pour une protéine membranaire [23]. Les éléments actuellement disponibles sont insuffisants pour définir le statut de ces deux gènes.
Gènes MUC « intrus »
Des O-glycoprotéines sécrétées ou membranaires, possédant des propriétés modulatrices de l’adhérence de type cellule-cellule ou cellule-matrice extracellulaire, sont parfois désignées improprement sous les termes de mucines endothéliales, mucines leucocytaires ou encore endomucines [24, 25]. Certains des gènes codant pour ces molécules ont été désignés par des symboles MUC (Muc10/Muc14), vraisemblablement parce qu’il s’agit de O-glycoprotéines dont le domaine peptidique porteur des chaînes glycanniques contient des répétitions en tandem [26].
MUC18 code pour une glycoprotéine membranaire dont le domaine extracellulaire comporte cinq domaines répétés de type immunoglobulin-like, et qui présente des homologies de séquence avec des molécules d’adhérence du système nerveux central comme N-CAM (neural cell adhesion molecule) [27].
Conclusions
En fonction des critères actuels de structure et d’expression des apomucines, nous considérons que la définition des mucines englobe deux groupes : les mucines sécrétées et les mucines membranaires. Quelques éléments fonctionnels récents obtenus par l’étude des premiers modèles de souris dont les gènes codant pour ces mucines ont été invalidés montrent que ces deux groupes de molécules contribuent à l’homéostasie épithéliale. Les souris Muc1-/- présentent un phénotype normal et une surexpression compensatoire de MUC4 est observée dans tous les tissus épithéliaux [28]. Le seul modèle actuellement disponible d’invalidation d’un gène de mucine secrétée, les souris Muc2-/-, présente des anomalies d’architecture de l’épithélium colique avec disparition des cellules caliciformes et réduction du volume de mucus, ce qui conduit au développement d’adénomes [29]. Les expériences d’invalidation d’un ou de plusieurs gènes codant pour les mucines, tentées par quelques laboratoires, dont le nôtre, devraient permettre de mieux révéler les complémentarités et les synergies fonctionnelles de tous ces gènes dans l’homéostasie épithéliale.
Appendices
Note
-
[1]
Le Dictionnaire historique de la langue française (Paris : Dictionnaires Le Robert, 1998 : 2320) atteste de l’usage dès 1520 du terme muqueux : « qui contient du mucus, en sécrète », le terme mucus étant lui-même un emprunt savant tardif (1750) du latin visqueux, gluant. La mucine (terme anglais mucin) a été initialement définie comme une « substance transparente semi-fluide élaborée par les cellules du tissu muqueux ». Dès le xviiie siècle, le terme anatomique muqueux est associé aux termes glande (1762) et membrane (1801).
Références
- 1. Friedlander G, Clerici C. Biologie et pathologie des épithéliums. Paris : Éditions EDK, 2000 : 290 p.
- 2. Debailleul V, Laine A, Huet G, et al. Human mucin genes MUC2, MUC3, MUC4, MUC5AC, MUC5B, and MUC6 express stable and extremely large mRNAs and exhibit a variable length polymorphism. An improved method to analyse large mRNAs. J Biol Chem 1998 ; 273 : 881-90.
- 3. Dekker J, Rossen JW, Büller HA, Einerhand AW. The MUC family : An obituary. Trends Biochem Sci 2002 ; 27 : 126-31.
- 4. Pigny P, Guyonnet-Duperat V, Hill AS, et al. Human mucin genes assigned to 11p15.5 : identification and organization of a cluster of genes. Genomics 1996 ; 38 : 340-52.
- 5. Desseyn JL, Aubert JP, Porchet N, Laine A. Evolution of the large secreted gel-forming mucins. Mol Biol Evol 2000 ; 17 : 1175-84.
- 6. Van Klinken BJ, Dekker J, Buller HA, Einerhand AW. Mucin gene structure and expression : protection vs.adhesion. Am J Physiol 1995 ; 269 : G613-27
- 7. Van Klinken BJ, Einerhand AW, Buller HA, Dekker J. The oligomerization of a family of four genetics clustered human gastrointestinal mucins. Glycobiology 1998 ; 8 : 67-75.
- 8. Porchet N, Buisine MP, Desseyn JL, et al. Gènes MUC : une superfamille de gènes ? Vers une classification fonctionnelle des apomucines humaines. J Soc Biol 1999 ; 193 : 85-99.
- 9. Meindl A, Berger W, Meitinger T, et al. Norrie disease is caused by mutations in an extracellular protein resembling C-terminal globular domain of mucins. Nat Genet 1992 ; 2 : 139-43.
- 10. Sun PD, Davies DR. The cystine-knot growth-factor superfamily. Annu Rev Biophys Biomol Struct 1995 ; 24 : 269-91.
- 11. Buisine MP, Desreumaux P, Leteurtre E, et al. Mucin gene expression in intestinal epithelial cells in Crohn’s disease. Gut 2001 ; 49 : 544-51.
- 12. Devine PL, McKenzie IF. Mucins : Structure, function, and associations with malignancy. Bioassays 1992 ; 14 : 619-25.
- 13. Kim YS, Gum J, Jr, Brockhausen I. Mucin glycoproteins in neoplasia. Glycoconj J 1996 ; 13 : 693-707.
- 14. Moniaux N, Escande F, Porchet N, et al. Structural organization and classification of the human mucin genes. Front Biosci 2001 ; 6 : D1192-206.
- 15. Gum JR, Jr, Crawley SC, Hicks JW, et al. MUC17, a novel membrane-tethered mucin. Biochem Biophys Res Commun 2002 ; 291 : 466-75.
- 16. Gouyer V, Leteurtre E, Zanetta JP, et al. Inhibition of the glycosylation and alteration in the intracellular trafficking of mucins and other glycoproteins by GalNAcalpha-O-bn in mucosal cell lines : An effect mediated through the intracellular synthesis of complex GalNAcalpha-O-bn oligosaccharides. Front Biosci 2001 ; 6 : D1235-44.
- 17. Fowler J, Vinall L, Swallow D. Polymorphism of the human MUC genes. Front Biosci 2001 ; 6 : D1207-15.
- 18. Gendler SJ. MUC1, the renaissance molecule. J Mammary Gland Biol Neoplasia 2001 ; 6 : 339-53.
- 19. Carraway KL, Spielman J. Structural and functional aspects of tumor cell sialomucins. Mol Cell Biochem 1986 ; 72 : 109-20.
- 20. Carraway KL, Price-Schiavi SA, Komatsu M, et al. Multiple facets of sialomucin complex/MUC4, a membrane mucin and erbb2 ligand, in tumors and tissues (Y2Kupdate). Front Biosci 2000 ; 5 : D95-107.
- 21. Pallesen LT, Berglund L, Rasmussen LK, et al. Isolation and characterization of MUC15, a novel cell membrane-associated mucin. Eur J Biochem 2002 ; 269 : 2755-63.
- 22. Chen Y, Zhao YH, Kalaslavadi TB, et al. Genome-wide search and identification of a novel gel-forming mucin MUC19/Muc19 in glandular tissues. Am J Respir Cell Mol Biol 2004 (sous presse).
- 23. Higuchi T, Orita T, Nakanishi S, et al. Molecular cloning, genomic structure and expression analysis of MUC19, a novel mucin protein, upregulated in injured kidney. J Biol Chem 2004 ; 279 : 1968-79.
- 24. Shimizu Y, Shaw S. Cell adhesion, mucins in the mainstream. Nature 1993 ; 366 : 630-31.
- 25. Carninci P, Shibata Y, Hayatsu N, et al. Normalization and subtraction of cap-trapper-selected cDNAs to prepare full-length cDNA libraries for rapid discovery of new genes. Genome Res 2000 ; 10 : 1431-2.
- 26. Kinoshita M, Nakamura T, Ihara M, et al. Identification of human endomucin-1 and-2 as membrane-bound O-sialoglycoproteins with anti-adhesive activity. FEBS Lett 2001 ; 499 : 121-26.
- 27. Wu GJ, Wu MWH, Wang SW, et al. Isolation and characterization of the major form of human MUC18 cDNA gene and correlation of MUC18 over-expression in prostate cancer cell lines and tissues with malignant progression. Gene 2001 ; 279 : 17-31.
- 28. Parmley RR, Gendler SJ. Cystic fibrosis mice lacking Muc1 have reduced amounts of intestinal mucus. J Clin Invest 1998 ; 102 : 1798-806.
- 29. Velcich A, WanCai Y, Heyer J, et al. Colorectal cancer in mice genetically deficient in the mucin Muc2. Science 2002 ; 295 : 1726-9.
List of figures
Figure 1
Représentation d’une apomucine sécrétée.
Ces apomucines sont sécrétées par des cellules spécialisées de l’épithélium, cellules caliciformes et cellules des glandes muqueuses. Elles sont constituées de domaines juxtaposés, D1, D2, D’, D3, D4, B, C et CK (cystin knot, domaine à « noeud cystine »), qui montrent un degré élevé d’homologie avec les domaines correspondants du préprofacteur von Willebrand. Le domaine CK permet la dimérisation.
Figure 2
Formation d’oligomères de mucines sécrétées grâce à l’établissement de ponts disuflure.
Figure 3
Représentation des apomucines membranaires.
Les apomucines épithéliales membranaires sont synthétisées par l’ensemble des cellules épithéliales. Ces mucines possèdent un domaine transmembranaire. MUC1 et MUC4 sont les protéines de ce groupe les mieux caractérisées. MUC3A, 3B, MUC12 et MUC17, dont les gènes sont localisés en 7q22, pourraient représenter un complexe multigénique. EGF : epidermal growth factor ; SEA : sea urchin sperm protein enterokinase agrin ; AMOP : adhesion-associated domain in MUC4 and other proteins.
Figure 4
Mucines membranaires et protection cellulaire.
Ce schéma montre une première ligne de défense (trait vertical gris) constituée par le gel de mucus (mucines sécrétées du complexe 11p15) pouvant inclure des formes sécrétées d’autres mucines. Une deuxième ligne de défense (trait vertical vert) est constituée par les mucines membranaires. MUC4 est représentée à la surface cellulaire sous la forme d’une structure hétérodimérique comportant un domaine MUC4 α de type VNTR (variable number of tandem repeats), représenté en vert, et un domaine MUC4 β associé à la membrane, représenté en rouge. Ces deux domaines sont liés de façon non covalente. La taille de MUC4 varie entre 1,2 et 2 μm selon les individus. Le trait vertical orange délimite le glycocalyx, d’une épaisseur estimée à 10 nm.
List of tables
Tableau I
Classification des mucines.