Article body
L’hypothèse d’une influence de l’horloge circadienne sur le cycle cellulaire reste controversée depuis de nombreuses années en dépit de nombreuses observations en faveur d’un tel lien. Ainsi, chez certaines algues unicellulaires et cyanobactéries, les cellules ne peuvent se diviser que pendant une fenêtre de temps au cours du cycle de 24h [1]. Chez la souris, la destruction de l’horloge circadienne centrale située dans les noyaux suprachiasmatiques de l’hypothalamus accélère la croissance de tumeurs implantées et la mutation du gène de l’horloge Per2 augmente la fréquence de tumeurs spontanées ou induites par irradiation [2, 3]. Enfin, chez l’homme, des variations circadiennes de l’expression de protéines du cycle cellulaire ont été décrites dans l’épithélium intestinal et la peau [4]. L’équipe d’Hitoshi Okamura à l’Université de Kobe (Japon) vient d’apporter un élément décisif en faveur de ce lien en démontrant que, lors de la régénération hépatique, l’horloge circadienne contrôle l’expression de gènes du cycle cellulaire et finalement la mitose [5].
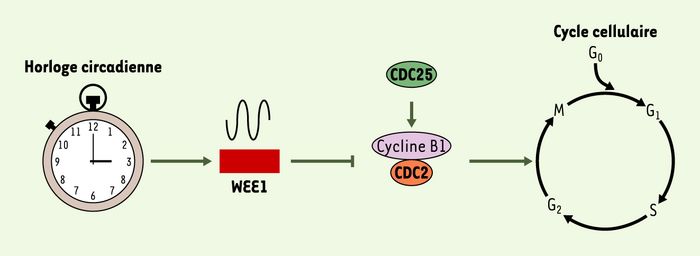
Chez l’adulte, la grande majorité des hépatocytes sont arrêtés en phase G0 du cycle cellulaire. Après l’ablation chirurgicale des deux tiers du foie, la plupart des hépatocytes entrent simultanément en mitose pour reconstituer la masse hépatique en quelques jours [6]. C’est en utilisant ce modèle de régénération hépatique chez la souris que cette équipe démontre que la transition G2/M est contrôlée par l’horloge circadienne. Quand l’hépatectomie est pratiquée 8heures après le début de la phase lumineuse, une entrée massive des hépatocytes en phase M est observée dans les 40heures suivant l’opération. En revanche, si elle est pratiquée au début de la phase lumineuse, seuls quelques hépatocytes entrent en phase M après 44heures et le pic mitotique est atteint seulement après 48heures. Le moment de l’opération a donc un impact important sur la première vague de mitose. L’activité de la kinase CDC2, un régulateur crucial pour l’entrée en mitose est elle aussi dépendante du moment de l’hépatectomie. Les auteurs de cette étude ont alors examiné l’expression temporelle de 68gènes du cycle cellulaire et identifié un profil d’expression rythmique pour les gènes Cyclin B1,Cdc2 et Wee1, suggérant qu’ils sont des cibles de l’horloge circadienne. La protéine WEE1 phosphoryle et inactive la kinase CDC2 qui, avec la cycline B1, forme un complexe nécessaire à la transition G2/M. Quand WEE1 est exprimée à des niveaux élevés, l’activité du complexe CDC2-cycline B1 est inhibée et la progression G2/M des hépatocytes est différée jusqu’à ce que les niveaux de WEE1 diminuent. À ce moment, la phosphatase CDC25 déphosphoryle CDC2 permettant ainsi au complexe CDC2-Cycline B1 d’être actif (Figure 1).
Figure 1
Liens entre l’horloge circadienne et le cycle cellulaire dans le foie en régénération.
Dans les organes périphériques ainsi que dans les noyaux suprachiasmatiques, le coeur de l’horloge circadienne est un oscillateur moléculaire constitué d’une boucle de rétroaction négative. Ce mécanisme fait principalement intervenir deux facteurs de transcription, CLOCK et BMAL1 qui stimulent la transcription des gènes codant pour les protéines PER1, PER2, CRY1, et CRY2, qui elles, agissent comme des inhibiteurs de l’hétérodimère CLOCK:BMAL1, réprimant ainsi leur propre expression; la précision et la robustesse de cet oscillateur moléculaire étant assurées par le récepteur nucléaire orphelin REV-ERBα [7, 8]. Les auteurs montrent que les souris invalidées pour les gènes Cry1 et Cry2 qui n’ont plus d’horloge circadienne fonctionnelle, présentent des niveaux d’expression de WEE1 constitutivement élevés. Des expériences réalisées in vitro montrent de plus que le promoteur du gène Wee1 est activé par l’hétérodimère CLOCK:BMAL1 et réprimé par CRY1. Cela suggère donc fortement que Wee1 est une cible directe de l’horloge circadienne. Lorsque l’hépatectomie est réalisée chez les souris mutantes Cry1/Cry2, le niveau élevé et constant de WEE1 se traduit par une inhibition de l’activité CDC2, un ralentissement des mitoses et par conséquent de la régénération. Cependant les souris mutantes parviennent finalement à reconstituer leur masse hépatique comme les souris normales. La régulation circadienne des mitoses est donc nécessaire à une cinétique normale de la régénération hépatique, mais n’est pas totalement indispensable à cette fonction.
Ces travaux apportent pour la première fois des bases moléculaires expliquant comment certains aspects du cycle cellulaire peuvent être contrôlés par l’horloge circadienne. L’enjeu va maintenant être de déterminer dans quelle mesure l’existence d’un tel lien peut jouer un rôle dans le contexte d’un processus prolifératif malin.
Appendices
Références
- 1. Mori T, Binder B, Johnson CH. Circadian gating of cell division in cyanobacteria growing with average doubling times of less than 24 hours. Proc Natl Acad Sci USA 1996; 93: 10183-8.
- 2. Filipski E, King VM, Li X-M, et al. Host circadian clock as a control point in tumor progression. J Natl Cancer Inst 2002; 94: 690-7.
- 3. Fu L, Pelicano H, Liu J, Huang P, Lee CC. The circadian gene Period2 plays an important role in tumor suppression and DNA damage response in vivo. Cell 2002; 111: 41-50.
- 4. Bjarnason GA, Jordan R. Rhythms in human gastrointestinal mucosa and skin. Chronobiol Int 2002; 19: 129-40.
- 5. Matsuo T, Yamaguchi S, Mitsui S, Emi A, Shimoda F, Okamura H. Control mechanism of the circadian clock for timing of cell division in vivo. Science 2003; 302: 255-9.
- 6. Fausto N, Campbell JS. The role of hepatocytes and oval cells in liver regeneration and repopulation. Mech Dev 2003; 120: 117-30.
- 7. Reppert SM, Weaver DR. Coordination of circadian timing in mammals. Nature 2002; 418: 935-41.
- 8. Teboul M, Delaunay F. Le récepteur nucléaire orphelin Rev-erba oscille entre répression et activation. Med Sci (Paris) 2003; 19: 411-3.
List of figures
Figure 1
Liens entre l’horloge circadienne et le cycle cellulaire dans le foie en régénération.