Abstracts
Résumé
FAK (focal adhesion kinase) est une protéine cytoplasmique ubiquitaire retrouvée au sein du complexe d’adhérence. Son activation par les intégrines mais aussi par différents facteurs de croissance, cytokines ou hormones se traduit par l’autophosphorylation d’un résidu tyrosine (397) libérant un site de liaison pour la protéine Src. Cette liaison va permettre l’activation des protéines du complexe d’adhérence, aboutissant à la transmission de signaux régulateurs pour la migration, la survie et la prolifération cellulaires. Un dérèglement de ce système peut limiter ainsi plusieurs fonctions cellulaires, voire entraîner l’apoptose, et pourrait participer aux processus de cancérogenèse. Cet article présente les mécanismes par lesquels FAK contribue à la régulation cellulaire.
Summary
Focal adhesion kinase (FAK) is a cytoplasmic protein tyrosine kinase localized to regions called focal adhesions. Many stimuli can induce tyrosine phosphorylation and activation of FAK, including integrins and growth factors. The major site of autophosphorylation, tyrosine 397, is a docking site for the SH2 domains of Src family proteins. The other sites of phosphorylation are phosphorylated by Src kinases. Phosphorylated FAK binds proteins of focal adhesion and can activate them directly or indirectly by phosphorylation. These activated proteins forming the FAK complex facilitate the generation of downstream signals necessary to regulate cell functions, like motility, survival and proliferation. Dysregulation of FAK could participate in the development of cancer. This review will focus upon the mechanisms by which FAK transmits biochemical signals and elicits biological effects.
Article body
La phosphorylation de résidus tyrosine de protéines du cytosquelette en réponse aux propriétés d’adhérence des intégrines est un mécanisme majeur de la transmission de signaux contrôlant divers processus cellulaires. Plusieurs protéines de type tyrosine kinase (PTK) peuvent participer à ces phosphorylations. FAK (focal adhesion kinase) est une protéine particulièrement importante dans la transmission du signal relayé par les intégrines ((→) m/s 2001, n° 1, p. 111). Elle est localisée préférentiellement près des intégrines au niveau des complexes d’adhérence (ou d’adhérences focales) et a été impliquée dans le contrôle de plusieurs processus cellulaires comme la migration et la survie. Parmi les autres protéines de ces complexes, on retrouve les protéines du cytosquelette telles que l’actine, la paxilline, la taline, et des protéines participant au remaniement du cytosquelette telles que la phosphatidylinositol 3-kinase (PI3-kinase) et la protéine de 130 kDa associée à Crk (P130CAS). L’ensemble de ces protéines forme ainsi de larges structures sous-membranaires (Figure 1 et Tableau I).
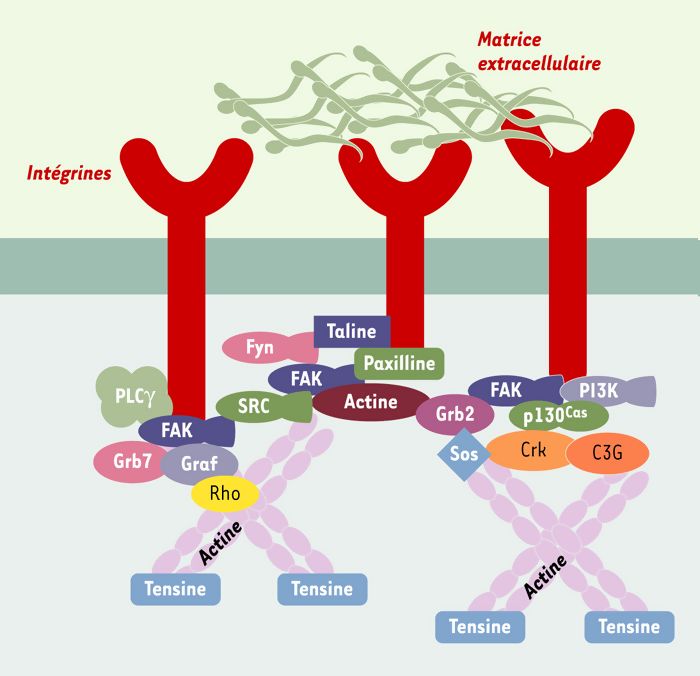
Figure 1
Le complexe d’adhérence focale.
Le complexe d’adhérence est une large structure composée de protéines connectées entre elles par leur domaine SH2 ou SH3 (Src homology regions 2 and 3). Au sein de ces complexes, FAK est l’un des points centraux de ces connexions en étant l’intermédiaire entre les signaux activateurs des intégrines ou des facteurs de croissance et les autres protéines. Le nombre de protéines nécessite l’association de plusieurs protéines FAK pour permettre une bonne cohésion du système. FAK: focal adhesion kinase; Fyn: tyrosine kinase Fyn; Graf: GTPase regulator associated with focal adhesion kinase; Grb2, Grb7: growth factor receptor-bound protein 2, 7; p130Cas: protéine de 130 kDa associée à Crk (Crk-associated substrate); PI3K: phosphatidylinositol 3-kinase; PLCγ: phospholipase C γ; Rho: protéines Rho; Sos: protéine sos; SRC: tyrosine kinase src.
Tableau I
Les principaux intervenants du complexe d’adhérence.
D’autres stimulus peuvent induire l’activation de FAK en dehors des intégrines, comme les facteurs de croissance, les neuropeptides, ou l’engagement des récepteurs couplés aux protéines G. Toutefois, le mode de régulation essentiel est réalisé par l’adhérence à la matrice extracellulaire par les intégrines. FAK a été retrouvée dans de nombreuses lignées cellulaires ainsi que dans la plupart des tissus étudiés. Elle est notamment exprimée sur toutes les lignées hématopoïétiques en dehors, peut-être, de la lignée érythroïde [1]. FAK est surexprimée dans différentes lignées cancéreuses [2, 3].
Structure et activation de FAK
FAK fait partie d’une famille récemment décrite, la famille des kinases de l’adhérence focale correspondant à des protéine tyrosine kinases (PTK) cytoplasmiques riches en proline, dépourvues de récepteur membranaire. Cette famille se compose actuellement deux protéines: Pyk2 (proline-rich tyrosine kinase 2) (pour revue, voir [4]) et FAK.
Structure
FAK est une protéine d’un poids moléculaire de 125 kDa, de structure très conservée au sein des espèces. Son gène est localisé sur le chromosome 8. Elle ne possède ni région transmembranaire ni domaines SH2 ou SH3 (Src homology regions 2 and 3) ((→) m/s 2000, n° 5, p. 611). Elle est divisée en trois domaines, un domaine amino-terminal et un domaine carboxy-terminal délimitant un domaine central portant l’activité catalytique (Figure 2) [5]. La région FAT (focal adhesion targeting), située dans le domaine carboxy-terminal est nécessaire pour la localisation dans le complexe d’adhérence par l’intermédiaire de liaisons avec la taline et la paxilline. La taline, médiateur de l’activation de FAK par les intégrines, permet l’interaction avec le réseau de filaments d’actine nécessaire pour l’activation de FAK [6]. En utilisant la cytochalasine D, qui bloque le réseau des filaments d’actine, des études ont confirmé que l’intégrité du cytosquelette d’actine est nécessaire pour la phosporylation de FAK en réponse aux stimulus initiaux [7]. Le domaine amino-terminal contient une séquence homologue à celles des protéines du groupe bande 4.1/ERM (ezrine, radixine et moésine) correspondant au domaine FERM (F pour protéine 4.1, E pour ezrine, R pour radixine, M pour moésine) impliqué dans les interactions avec les domaines cytoplasmiques des récepteurs transmembranaires [8]. Même si les fonctions de cette réponse ne sont pas déterminées avec certitude, des fonctions similaires à celles décrites pour d’autres protéines ont été proposées, avec notamment un rôle pour la transmission des signaux dépendants de facteurs de croissance et d’hormones [9]. Le domaine amino-terminal semble pouvoir lier FAK à la sous-unité β des intégrines mais cette liaison ne semble pas indispensable pour l’activation de FAK par les intégrines [10].
Figure 2
Structure de FAK.
La protéine FAK est divisée en trois domaines, un domaine amino-terminal et un domaine carboxy-terminal délimitant un domaine central portant l’activité catalytique. L’autophosphorylation de la tyrosine en Y397 permet la liaison avec les kinases de la famille Src. Ces kinases vont phosphoryler les autres résidus tyrosine de FAK ainsi que des résidus de protéines liées à FAK. Dans la partie amino-terminale, on retrouve un domaine homologue avec les protéines du groupe bande 4.1/ERM (ezrine, radixine, moésine). Ce domaine permet l’association de FAK avec des récepteurs de facteurs de croissance. La région FAT (focal adhesion targeting), située dans son domaine carboxy-terminal est nécessaire, pour la localisation dans le complexe d’adhérence par l’intermédiaire de liaisons avec la taline et la paxilline. La liaison et le mode d’activation des intégrines ne sont pas déterminés avec certitude. Sur la figure sont représentées les principales protéines interagissant avec FAK et leur site de liaison respectif. ASAP1: ARF (ADP ribosylation factor)-GAP (GTPase-activating protein) containing SH3, Ank repeats, and pH domain; Graf: GTPase regulator associated with focal adhesion kinase; Grb2, Grb7: growth factor receptor-bound protein 2, 7; PI3K: phosphatidylinositol 3-kinase; p85: sous-unité régulatrice de la PIP3K; PLCγ: phospholipase C γ; p130Cas: protéine de 130 kDa associée à Crk (Crk-associated substrate); c-SRC: tyrosine kinase src; bandes bleu foncé: sites riches en proline, permettant les liaisons avec des domaines SH3; Y: résidus tyrosine permettant des liaisons avec des domaines SH2
Activation de FAK
Les intégrines, les facteurs de croissance comme l’IGF (insulin-like growth factor) et des hormones peuvent activer FAK [1, 7, 9, 11]. Les interactions entre la partie amino-terminale et les récepteurs de facteurs de croissance et les intégrines, et celles entre la partie FAT et la taline, suggèrent une régulation différente de FAK en fonction de l’origine du stimulus initial (facteurs de croissance ou intégrines) avec un rôle plus important de la partie amino-terminale pour l’activation par les facteurs de croissance et, à l’inverse, un rôle plus important de la partie carboxy-terminale pour l’activation par les intégrines [10]. Si l’intégrité du cytosquelette, de la taline et de la paxilline semblent nécessaires, la transmission du signal activateur via les intégrines reste encore inconnue [12].
La protéine FAK activée va subir une phosphorylation en cascade de résidus tyrosine. C’est d’abord l’autophosphorylation du résidu tyrosine 397 qui est le témoin de son activation [7]. Une mutation au niveau de ce résidu entraîne l’incapacité pour FAK d’avoir une activité biologique. Cette phosphorylation libère un site de liaison de forte affinité pour des protéines contenant un domaine SH2. Les kinases de la famille Src, Fyn et c-Src, vont être recrutées et activées sur ce site. Elles vont phosphoryler d’autres résidus tyrosine dans le domaine catalytique (Y407, Y576 et Y577) ainsi que dans la région carboxy-terminale (Y861 et Y925). Les phosphorylations des tyrosines Y576 et 577 par c-Src augmentent l’activité enzymatique de FAK et permettent la création de nouveaux sites de liaison pour d’autres effecteurs (voirplus loin) [13, 14]. L’activation de FAK et de c-Src est donc le point central du signal de transduction.
Si l’autophosphorylation du résidu 397 est reconnue comme le témoin de l’activation de FAK, il a été décrit dans les cellules épithéliales que FAK pouvait être retrouvée sous forme phosphorylée à l’état basal mais avec une répartition intracellulaire diffuse et non plus focale, sous-membranaire. Lors de la migration cellulaire, on ne retrouve pas d’augmentation majeure de la phosphorylation de Tyr397 mais plutôt une redistribution de toutes les autres formes phosphorylées sur tyrosine de FAK au niveau des complexes d’adhérence [15].
Si l’activation de FAK est généralement liée aux intégrines, il existe d’autres modèles où son activation est réalisée par d’autres mécanismes. Par exemple, dans les plaquettes sanguines, son activation semble indépendante des intégrines mais nécessite plutôt une régulation par les flux intracellulaires du calcium et l’activation de la PKC (protein kinase C) [16].
Les interactions protéiques
Après son activation, FAK phosphorylée libère plusieurs sites de fixation pour des protéines contenant des domaines SH2. Ces sites vont permettre le recrutement successif de protéines du complexe (Figure 2). Dans un second temps, les différentes protéines vont subir à leur tour une activation entraînant la mise en route de cascades de voies régulatrices intracellulaires importantes comme Erk/MAPK, PI3-kinase et les réarrangements du cytosquelette (Figure 3). Une nouvelle interaction entre FAK et STAT1 (signal transducer and activator of transcription 1) a été décrite récemment. Le signal des STAT est généralement une voie de transduction de signaux de récepteurs de surface pour la régulation de l’expression génique. B. Xie et al. ont montré que, parmi les différentes protéines STAT, STAT-1 pouvait être activée par FAK après l’adhérence à la matrice et que cette activation influençait la migration cellulaire en limitant l’adhérence ((→) m/s 1997, n° 11, p. 1277) [17].
Figure 3
Les voies de signalisation de l’adhérence focale.
Le schéma simplifié propose un résumé des possibilités d’interaction entre les protéines du complexe d’adhérence et les voies de signalisation sous-jacentes. FAK est initialement activée par l’intermédiaire d’intégrines et/ou de facteurs de croissance. Cette activation va permettre la liaison et l’activation de plusieurs protéines. (1) Graf, Grb7, PLC-γ. vont participer au remaniement du cytosquelette d’actine, engendrant ainsi un cycle de migration et d’adhérence cellulaires avec pour chaque étape une restructuration et une déstructuration des complexes d’adhérence. p130Cas, Grb2, PI3-kinase vont secondairement participer à l’activation en cascade de plusieurs voies intracellulaires, la voie de Erk (2 et 3), la voie de JNK (4) et la voie de la PI3-kinase (5). Elles vont permettre in fine de régler plusieurs processus vitaux pour la cellule telles que la survie, la prolifération et la migration cellulaires en favorisant l’activation de facteurs de transcription. AKT: protéine kinase AKT; FAK: focal adhesion kinase; ERK: extracellular signal-regulated kinases; Fyn: tyrosine kinase Fyn; Graf: GTPase regulator associated with focal adhesion kinase; Grb2, Grb7: growth factor receptor-bound protein 2, 7; JNK: jun N-terminal kinases; MEK: MAP erk kinase; NFΚB: nuclear factor ΚB; p130Cas: protéine de 130 kDa associée à Crk (Crk-associated substrate); PI3K: phosphatidylinositol 3 kinase; PIP2: phosphatidyl inositol bisphosphate; PLCγ: phospholipase C γ; Raft1: rapamycine FΚBP target 1; Rac: GTPase rac; Ras: GTPase ras; SRC: tyrosine kinase src; Sos: protéine sos.
Le système de régulation faisant intervenir un tel nombre de protéines susceptibles d’être activées par différentes voies rend la schématisation parfois difficile. À travers les modèles proposés par les études récentes, nous allons tenter de synthétiser les principales interactions protéiques.
Les mitogen-activated protein kinases
Les protéines de la super famille des MAPK (mitogen-activated protein kinases) participent à des mécanismes cellulaires majeurs pour transcrire un signal extracellulaire en une réponse cellulaire. Trois membres de la famille sont particulièrement importants: Erk (extracellular signal-regulated kinase), la protéine p38 et JNK (c-jun N-terminal kinase). Ces protéines sont impliquées dans la transcription de gènes par l’activation de protéines nucléaires telles que c-Myc et c-Jun. Au moins 25 cibles ont été trouvées intervenant dans divers programmes cellulaires telles que la division et la prolifération. La régulation de ces voies dépend essentiellement de la coopération entre les messages activateurs des facteurs de croissance et de l’adhérence (pour revue, voir [18-20]).
FAK est reliée à la paxilline par sa région FAT, qui est nécessaire et suffisante pour la liaison et dont l’intégrité est indispensable pour l’activation de la paxilline [7, 10]. Elle permet de stabiliser les interactions protéiques dans le complexe et facilite l’activation de certaines d’entre elles [7, 21]. Elle participe par ailleurs, par l’intermédiaire de PAK (p21-activated serine-threonine kinase), à l’activation des Erk/MAPK kinases ((→) m/s 2000, n° 4, p. 563).
Dans différents modèles cellulaires, la voie de Ras est une voie importante pour l’activation de Erk. La phosphorylation de la tyrosine 925 de FAK forme un site de liaison pour le complexe Grb2-Sos [22]. Grb2 est une protéine adaptatrice qui, en se liant à Sos, va permettre l’activation de Ras enclenchant la cascade des MAP-kinases. Le domaine carboxy-terminal de FAK, riche en résidus proline, permet des interactions avec des protéines par leurs domaines SH3. p130Cas ou Cas (Crk-associated substrate) se lie au niveau de la première séquence riche en proline (PxxP718) [23]. Cas fait partie de la famille des protéines adaptatrices, comme Grb2. Elle se lie par une liaison SH2/SH3 avec la protéine Crk [24]. Ce complexe, renforcé par la paxilline, transmet un signal activateur pour une autre protéine de la famille de Ras, Rac1, aboutissant à une activation de PAK puis de Erk [25]. p130Cas est aussi impliquée dans l’activation de la voie de JNK (Figure 3).
Il est clairement démontré, par ailleurs, que l’adhérence et les facteurs de croissance sont étroitement impliqués dans la transmission de signaux de migration et de prolifération. Les facteurs de croissance peuvent régler l’activité des complexes d’adhérence. Cette régulation par les facteurs de croissance est due essentiellement à une potentialisation de la transmission des signaux intracellulaires par la voie de Erk. Cet effet passe non seulement par une augmentation de l’activation de Erk mais aussi, et peut-être surtout, permet de favoriser la migration de Erk vers le noyau. [20]. Inversement, les complexes peuvent contrôler les signaux déclenchés par les facteurs de croissance en passant notamment par une régulation de l’expression des récepteurs ou des substrats. Par exemple, dans un modèle de fibroblastes, P. Lebrun et al. ont montré que FAK, activée par l’adhérence, potentialise l’expression de l’IRS-1 (insulin receptor substrate 1) amorcée par l’insuline. Ces résultats ont été confirmés par la suite en montrant que l’expression de IRS-1 est nettement plus faible dans les cellules en suspension par rapport aux cellules adhérentes [26].
PI3-kinase
La PI3-kinase est une protéine kinase ayant un rôle prédominant dans les processus apoptotiques. Son activation engendre des seconds messagers en phosphorylant des lipides inositols impliqués dans l’activation de la protéine Akt (protéine kinase B). Celle-ci va alors participer à l’inhibition de la cascade apoptotique déclenchée par BAD (Bcl2-antagonist of cell death) et va activer NF-κB (nuclear factor κB) dont la fonction première est de régler l’expression de gènes anti-apoptotiques et est particulièrement impliquée dans l’anoikis (apoptose par perte d’adhérence). PI3-kinase est liée à FAK par le résidu Tyr397 qui libère des sites pour la sous-unité régulatrice de 85 kDa (p85) [27] ((→) m/s 2000, n° 2, p. 265). La fixation de p85 va permettre son activation par le complexe FAK-Src entraînant secondairement la phosphorylation des lipides inositols puis l’activation d’Akt.
Organisation du cytosquelette et des complexes d’adhérence
Une migration cellulaire correcte nécessite un système intracellulaire souple et finement réglé qui permet l’organisation et la désorganisation des différentes structures impliquées.
Si le site libéré par le résidu tyrosine 397 permet une liaison avec les protéines Src et la protéine PI3-kinase, elle permet aussi la liaison avec deux autres protéines, la phospholipase C γ (PLCγ) et Grb7 (growth factor receptor-bound protein 7), impliquées toutes deux dans la régulation de la migration [28, 29]. L’impossibilité pour plusieurs protéines de se lier en même temps sur un seul résidu tyrosine implique que l’autophosphorylation doit permettre une activation en cascade de plusieurs protéines FAK distinctes se liant chacune aux différentes protéines. La réunion de ces « mini-complexes » aboutit à une large structure dans l’adhérence focale facilitant ainsi la co-localisation de protéines distinctes de signalisation [8].
La deuxième séquence riche en proline (PxxP881) de FAK permet la liaison de deux GAP (GTPase activating protein), une GAP pour Rho et ASAP1, une GAP pour des Arf (ADP-ribosylation factors) et de Graf (GTPase regulator associated with FAK). Rho activée induit la contractilité des filaments d’actine et participe à l’activation de FAK en favorisant l’assemblage des complexes d’adhérence. Par un rétrocontrôle négatif, FAK, parl’intermédiaire de Graf, va inhiber Rho, aboutissant secondairement à un remodelage de la structure des complexes d’adhérence. Ces différentes données suggèrent donc que FAK peut régler le turn-over de l’adhérence focale en modulant l’activité de Rho [8]. De même, ASAP1 en modulant les Arf est susceptible de réduire l’adhérence et la formation des complexes d’adhérence [30].
Il existe d’autres mécanismes participant à la régulation des adhérences. Le complexe Grb2-Crk permet de créer un cycle de phosphorylation-déphosphorylation de FAK [31]. On retrouve aussi une participation des facteurs de croissance. C’est le cas notamment du récepteur IGF-R (insulin growth factor-R) qui active dans un premier temps l’adhérence en potentialisant le recrutement de complexes d’adhérence et qui, en activant la phosphatase SHP2, entraîne ensuite une déphosphorylation de FAK aboutissant dans un second temps à une augmentation de la migration par inhibition des complexes [11].
Régulation de FAK
Actuellement, des mécanismes régulateurs de l’activation de FAK ont été décrits dans différents modèles cellulaires.
Le premier mécanisme régulateur est réalisé par la protéine FRNK (FAK-related non-kinase), correspondant au domaine carboxy-terminal de FAK dépourvue du domaine catalytique. Son expression est liée à une régulation autonome par un promoteur localisé dans un intron de la séquence carboxy-terminale permettant la seule expression du domaine carboxy-terminal. Par ailleurs, à la différence de FAK exprimée de façon ubiquitaire, la région régulatrice du promoteur contient des éléments spécifiques de tissus. Les cellules intestinales et pulmonaires ont les taux d’expression d’ARN de FRNK les plus importants [32]. FRNK entre en compétition par sa partie terminale FAT avec FAK au sein des complexes d’adhérence. Cette compétition, en limitant les différentes interactions protéiques, permet une régulation de l’adhérence, de la migration, du cycle cellulaire et éventuellement de la mort cellulaire [33, 34].
Lors de l’activation plaquettaire par la thrombine, une protéase, la calpaïne, règle négativement FAK en la clivant en deux fragments inactifs. Ce clivage intervient directement dans la régulation des complexes d’adhérence et bloque la transmission des messages sous-jacents [35].
PTEN (phosphatase and tensin homolog deleted on chromosome ten) est une lipide-phosphatase aux propriétés de suppresseur de tumeur. Par sa propriété de phosphatase protéique, elle permet une déphosphorylation de FAK empêchant l’interaction avec la PI3-kinase. Et par sa propriété de phosphatase lipidique, elle dégrade les produits engendrés par la PI3-kinase, comme le phosphatidyl inositol (3, 4, 5) triphosphate. De cette façon, PTEN peut inhiber efficacement le signal de la PI3-kinase déclenché par l’adhérence dépendante des intégrines, aboutissant in fine à une augmentation de l’anoikis [36]. D’autres phosphatases comme PTP-1B (protein phosphotyrosyl phosphatase), une tyrosine phosphatase ubiquitaire, et PTP-PEST agissent au sein des complexes en inhibant différentes protéines [37, 38].
Si FAK permet de potentialiser certaines voies issues des facteurs de croissance, à l’inverse, il a été montré que des facteurs de croissance peuvent inhiber l’activation de FAK. C’est le cas de l’EGF (epidermal growth factor) dont la stimulation entraîne une déphosphorylation de FAK. Cette déphosphorylation a été montrée notamment sur une lignée de carcinome avec pour conséquence une perte de l’adhérence et une augmentation de la migration cellulaire, favorisant ainsi l’invasion tumorale [39].
Les fonctions de FAK
Les différentes interactions décrites se retrouvent in fine toutes intriquées au coeur d’un système régulateur complexe impliquant les intégrines et les facteurs de croissance. Dans ce système, la voie régulatrice principale semble toutefois être la voie de Erk participant à la régulation globale de la vie cellulaire (cycle, migration et donc survie) (Figure 3).
Migration cellulaire et FAK
À travers toutes ses interactions, FAK est donc impliquée dans la migration cellulaire (pour revue, voir [40]). En effet (1) les cellules déficitaires en FAK, liées à la fibronectine, ont une forte diminution de leur capacité migratoire et cette capacité dépend de la phosphorylation des tyrosines 397, 576 et 577. Ces résultats sont bien démontrés pour des lignées fibroblastiques dérivées de cellules embryonnaires invalidées pour le gène FAK a été invalidé [41]; (2) l’augmentation de l’expression de FRNK bloque la migration [33]; (3) l’augmentation de l’expression de FAK augmente la migration; (4) enfin, la mutation au niveau du site de liaison de FAK à la famille Src, Grb7, PI3 kinase ou à Caslimite la migration. Si FAK est de nouveau exprimée correctement, on retrouve une migration normale [27, 29, 33, 42].
Au cours de l’embryogenèse, la régulation de la migration fait intervenir l’adhérence cellulaire avec en particulier une participation importante des intégrines. Dans l’embryon, les intégrines sont réglées dans le temps et dans l’espace, suggérant ainsi que l’adhérence, et donc les voies sous-jacentes, sont impliquées dans le développement. Si le rôle de FAK dans la prolifération et la migration semble clairement établi, son rôle dans la différenciation cellulaire reste encore à définir. Cependant, son expression est constante dans les cellules embryonnaires durant les huit premiers jours avec par la suite une décroissance progressive, ce qui fait supposer un rôle de FAK dans le développement précoce. Cette hypothèse semble confirmée par des essais avec des cellules embryonnaires le gène de FAK a été invalidé, aboutissant à une limitation de la migration cellulaire notamment au niveau du mésoderme. On retrouve des résultats similaires au niveau neuronal avec une expression et un taux de phosphorylation plus importants que dans les cellules adultes. Les interactions protéiques intracellulaires sont similaires à celles des cellules en culture, suggérant que les voies décrites in vitro sont impliquées au cours de l’embryogenèse (pour revue, voir [43]).
La coopération entre adhérence et facteurs de croissance semble intervenir dans les processus d’angiogenèse au niveau des cellules endothéliales comme au niveau des cellules musculaires lisses. Dans les cellules endothéliales, il existe en effet une coopération étroite entre les intégrines et le VEGFR-2 (vascular endothelial growth factor receptor-2) passant par l’intermédiaire de FAK [44]. Cette coopération est nécessaire pour une migration correcte de ces cellules [45]. De même, dans les cellules musculaires lisses vasculaires, l’activation de FAK potentialise l’activation de Erk par le PDGF (platetelet derived growth factor) favorisant la prolifération et la migration [46].
Parallèlement à son action sur la migration cellulaire, de nombreuses études ont montré clairement la participation de FAK dans les processus du développement tumoral (voir plus loin).
Survie, prolifération cellulaire et apoptose
Les interactions entre les intégrines et la matrice extracellulaire participent aux processus vitaux cellulaires. Si le message est généralement transmis par la sous-unité β, la sous-unité α semble être l’élément orientant dans le sens de la prolifération ou de la quiescence [47]. FAK, par ses interactions avec les intégrines est nécessaire pour la prolifération cellulaire [48]. J. H. Zhao et al. ont montré à travers plusieurs études que la régulation de la prolifération se faisait par son intermédiaire. En activant les voies de Erk et de JNK, FAK permet d’accélérer le passage de la phase G1 à à la phase S de la mitose, participant ainsi au cycle cellulaire [49]. Plus récemment, la même équipe a montré que la voie de Erk, en réglant directement le promoteur de la cycline D1, une protéine nécessaire pour le déclenchement du cycle cellulaire, permettait une augmentation d’expression de celle-ci [50]. Par ses interactions avec les récepteurs des facteurs de croissance, FAK semble jouer un rôle au cours de l’hématopoïèse et au cours de la différenciation neuronale. A. Kume et al. ont en effet montré que, dans les cellules hématopoïétiques médullaires, FAK pouvait être réglée par des cytokines. Si l’interleukine-3 influence peu son activation, en revanche, le GM-CSF (granulocyte-macrophage colony-stimulating factor) l’active et oriente, in vitro, la différenciation vers la lignée monocytaire [1]. Au cours de la différenciation neuronale, P. J. Bruce-Staskal et al., en inhibant les complexes FAK-p130Cas-Crk, ont montré que les cellules étaient limitées dans leur différenciation [51]. Dans un modèle de cellules épithéliales, il a été démontré que l’interaction entre l’adhérence cellulaire et le facteur de croissance MSP (macrophge stimulating protein) est nécessaire pour assurer correctement la survie des cellules par un effet de potentialisation entre les deux partenaires sur les signaux intracellulaires qui limitent l’anoikis [52].
En potentialisant la prolifération cellulaire et la survie, FAK est donc indirectement une protéine anti-apoptotique. Ce rôle a été confirmé sur différentes lignées cellulaires. L’inhibition de l’expression de FAK entraîne l’apoptose par perte d’adhérence [53, 54]. Dans les cellules HL60 (lignée leucémique) et dans des lignées fibroblastiques, l’activation de Erk et de JNK est requise pour l’inhibition de l’apoptose [55, 56]. La PI3-kinase en activant la voie de NF-κB augmente les protéines inhibitrices de l’apoptose (IAP), aboutissant à l’inhibition du clivage de la procaspase-3, protégeant la cellule de l’anoikis [52, 55]. Le signal de survie engendré par FAK pourrait par ailleurs inhiber la voie apoptotique de p53 [56]. Dans les différents modèles, l’hyperexpression de FAK protège les cellules de l’apoptose en réponse à d’autres stimulus. En revanche, lorsqu’un signal apoptotique est engagé, les caspases 3 et 7 puis la caspase 6 vont cliver FAK [57].
Cancérogenèse
Par son implication dans la migration et la survie cellulaires, FAK pourrait jouer un rôle dans le développement tumoral. Ainsi, l’expression de FAK est élevée dans des tumeurs du sein, du côlon, de la prostate, de la thyroïde, des ovaires ou du mésenchyme [58]. Plusieurs études suggèrent que FAK intervient dans les premiers événements conduisant au développement tumoral [8]. Dans les cellules transformées surexprimant v-Src, FAK présente une phosphorylation trois à dix fois plus élevée et ne nécessite pas obligatoirement l’adhérence préalable à la matrice extracellulaire pour être activée. Ces résultats suggèrent la possibilité d’une autonomisation des complexes d’adhérence dans certains modèles tumoraux occasionnant une hyperactivation et participant ainsi à la prolifération et à la migration cellulaires [59].
En raison de son rôle dans la migration cellulaire, il a été supposé que FAK pouvait participer à la formation des métastases. Quelques modèles tumoraux semblent actuellement confirmer cette hypothèse. K. Nakagawa et al. ont montré dans des lignées de tumeur colique que la perte d’expression de FAK était corrélée avec la possibilité de dissémination [2]. G. Scott et al ont comparé des lignées de mélanome adhérentes et non adhérentes et ont montré une diminution de l’activation, FAK dans des lignées métastatiques à la différence de lignées adhérentes. Cette perte de régulation semble par ailleurs en partie liée à une différence d’expression des intégrines dans ces cellules [60]. Par l’intermédiaire des facteurs de croissance, on retrouve une deuxième possibilité expliquant son implication dans la dissémination. L’EGF, en inhibant l’activité de FAK, potentialise les capacités migratoires de la cellule [39]. À partir d’un modèle tumoral in vitro sur des cellules épithéliales, Z. Lu et al. suggèrent cette possibilité dans les processus de tumorigenèse. En inhibant FAK, ils aboutissent à une augmentation de la migration et donc de la dissémination [39]. Il existe encore peu de données dans les maladies hématologiques, pouvant expliquer notamment la dissémination de certains types leucémiques par rapport à d’autres. Cependant, nous avons pu constater que plusieurs lignées leucémiques en culture et des cellules de malades exprimaient FAK à des taux variables et que certaines de ces lignées présentaient des copies additionnelles d’ARNm, suggérant que l’hyperexpression retrouvée pourrait être en partie liée à une amplification génique [61, 62]. Dans la leucémie myéloïde chronique, la tyrosine kinase Bcr-Abl peut activer directement FAK et les complexes d’adhérence sans intervention des intégrines [63].
Le rôle de FAK dans la survie cellulaire en fait aussi un candidat potentiel pour le développement tumoral. Dans un modèle de lignée leucémique, l’hyperexpression de FAK a un rôle protecteur de l’apoptose induite par des drogues anticancéreuses ou un stress oxydatif [55]. Dans des modèles de tumeurs cellulaires coliques et de mélanome, des oligonucléotides antisens anti-FAK ont permis de montrer que la diminution de l’expression de FAK était associée à un état apoptotique des cellules avec une perte de l’adhérence à la matrice extracellulaire [53, 54].
Conclusions
FAK est donc au coeur d’un système régulateur impliquant l’adhérence à la matrice extracellulaire mais aussi les facteurs de croissance, les hormones, des chimiokines. Ce système est indispensable pour la migration, la survie et la prolifération cellulairse. Tous les modèles actuels sont essentiellement décrits sur des lignées cellulaires et on ne connaît pas encore le rôle réel de FAK dans les cellules in vivo. Même si FAK a un rôle potentiel dans le développement tumoral comme le suggèrent plusieurs études, on ne connaît pas encore sa fonction avec certitude. Toutefois, FAK semble être un bon candidat pour régler plusieurs aspects de ce développement, comme la prolifération cellulaire, la dissémination et, enfin, l’apoptose. D’autres études restent toutefois nécessaires pour déterminer avec exactitude le rôle réel de FAK dans ces différentes étapes, rôle qui est probablement différent selon le type cellulaire.
Appendices
Références
- 1. Kume A, Nishiura H, Suda J, Suda T. Focal adhesion kinase upregulated by granulocyte-macrophage colony-stimulating factor but not by interleukin-3 in differentiating myeloid cells. Blood 1997; 89: 3434-42.
- 2. Nakagawa K, Sogo S, Hioki K, Tokunaga R, Taketani S. Acquisition of cell adhesion and induction of focal adhesion kinase of human colon cancer Colo 201 cells by retinoic acid-induced differentiation. Differentiation 1998; 62: 249-57.
- 3. Weisberg E, Sattler M, Ewaniuk DS, Salgia R. Role of focal adhesion proteins in signal transduction and oncogenesis. Crit Rev Oncog 1997; 8: 343-58.
- 4. Avraham H, Park SY, Schinkmann K, Avraham S. RAFTK/Pyk2-mediated cellular signalling. Cell Signal 2000; 12: 123-33.
- 5. Schaller MD, Borgman CA, Cobb BS, Vines RR, Reynolds AB, Parsons JT. pp125FAK, a structurally distinctive protein-tyrosine kinase associated with focal adhesions. Proc Natl Acad Sci USA 1992; 89: 5192-6.
- 6. Chen HC, Appeddu PA, Parsons JT, Hildebrand JD, Schaller MD, Guan JL. Interaction of focal adhesion kinase with cytoskeletal protein talin. J Biol Chem 1995; 270: 16995-9.
- 7. Schaller MD, Hildebrand JD, Shannon JD, Fox JW, Vines RR, Parsons JT. Autophosphorylation of the focal adhesion kinase, pp125FAK, directs SH2-dependent binding of pp60src. Mol Cell Biol 1994; 14: 1680-8.
- 8. Schaller MD. Biochemical signals and biological responses elicited by the focal adhesion kinase. Biochim Biophys Acta 2001; 1540 :1-21.
- 9. Sieg DJ, Hauck CR, Ilic D, et al. FAK integrates growth-factor and integrin signals to promote cell migration. Nat Cell Biol 2000; 2: 249-56.
- 10. Shen Y, Schaller MD. Focal adhesion targeting: the critical determinant of FAK regulation and substrate phosphorylation. Mol Biol Cell 1999; 10: 2507-18.
- 11. Manes S, Mira E, Gomez-Mouton C, Zhao ZJ, Lacalle RA, Martinez AC. Concerted activity of tyrosine phosphatase SHP-2 and focal adhesion kinase in regulation of cell motility. Mol Cell Biol 1999; 19: 3125-35.
- 12. Zhao J, Zheng C, Guan J. Pyk2 and FAK differentially regulate progression of the cell cycle. J Cell Sci 2000; 113: 3063-72.
- 13. Calalb MB, Polte TR, Hanks SK. Tyrosine phosphorylation of focal adhesion kinase at sites in the catalytic domain regulates kinase activity: a role for Src family kinases. Mol Cell Biol 1995; 15: 954-63.
- 14. Eide BL, Turck CW, Escobedo JA. Identification of Tyr-397 as the primary site of tyrosine phosphorylation and pp60src association in the focal adhesion kinase, pp125FAK. Mol Cell Biol 1995; 15: 2819-27.
- 15. Nakamura K, Yano H, Schaefer E, Sabe H. Different modes and qualities of tyrosine phosphorylation of Fak and Pyk2 during epithelial-mesenchymal transdifferentiation and cell migration: analysis of specific phosphorylation events using site-directed antibodies. Oncogene 2001; 20: 2626-35.
- 16. Achison M, Elton CM, Hargreaves PG, Knight CG, Barnes MJ, Farndale RW. Integrin-independent tyrosine phosphorylation of p125(fak) in human platelets stimulated by collagen. J Biol Chem 2001; 276: 3167-74.
- 17. Xie B, Zhao J, Kitagawa M, et al. Focal adhesion kinase activates Stat1 in integrin-mediated cell migration and adhesion. J Biol Chem 2001; 276: 19512-23.
- 18. Schaeffer HJ, Weber MJ. Mitogen-activated protein kinases: specific messages from ubiquitous messengers. Mol Cell Biol 1999; 19: 2435-44.
- 19. Arbadi S, Maier RV. Mitogen-activated protein kinases. Crit Care Med 2002; 30: S74-9.
- 20. Howe AK, Aplin AE, Juliano RL. Anchorage-dependent ERK signaling-mechanisms and consequences. Curr Opin Genet Dev 2002; 12:30-5.
- 21. Schaller MD, Parsons JT. pp125FAK-dependent tyrosine phosphorylation of paxillin creates a high-affinity binding site for Crk. Mol Cell Biol 1995; 15: 2635-45.
- 22. Schlaepfer DD, Hanks SK, Hunter T, van der Geer P. Integrin-mediated signal transduction linked to Ras pathway by GRB2 binding to focal adhesion kinase. Nature 1994; 372: 786-91.
- 23. Polte TR, Hanks SK. Interaction between focal adhesion kinase and Crk-associated tyrosine kinase substrate p130cas. Proc Natl Acad Sci USA 1995; 92: 10678-82.
- 24. Vuori K, Hirai H, Aizawa S, Ruoslahti E. Introduction of p130cas signaling complex formation upon integrin-mediated cell adhesion: a role for Src family kinases. Mol Cell Biol 1996; 16: 2606-13.
- 25. Klemke RL, Leng J, Molander R, Brooks PC, Vuori K, Cheresh DA. CAS/Crk coupling serves as a molecular switch for induction of cell migration. J Cell Biol 1998; 140: 961-72.
- 26. Lebrun P, Baron V, Hauck CR, Schlaepfer DD, Van Obberghen E. Cell adhesion and focal adhesion kinase regulate insulin receptor substrate-1 expression. J Biol Chem 2000; 275: 38371-7.
- 27. Reiske HR, Kao SC, Cary LA, Guan JL, Lai JF, Chen HC. Requirement of phosphatidylinositol 3-kinase in focal adhesion kinase-promoted cell migration. J Biol Chem 1999; 274: 12361-6.
- 28. Zhang X, Chattopadhyay A, Ji QS, et al. Focal adhesion kinase promotes phospholipase C-γ1 activity. Proc Natl Acad Sci USA 1999; 96: 9021-6.
- 29. Han DC, Guan JL. Association of focal adhesion kinase with Grb7 and its role in cell migration. J Biol Chem 1999; 274: 24425-30.
- 30. Randazzo PA, Andrade J, Miura K, et al. The Arf GTPase-activating protein ASAP1 regulates the actin cytoskeleton. Proc Natl Acad Sci USA 2000; 97: 4011-6.
- 31. Zvara A, Fajardo JE, Escalante M, et al. Activation of the focal adhesion kinase signaling pathway by structural alterations in the carboxyl-terminal region of c-Crk II. Oncogene 2001; 20: 951-61.
- 32. Nolan K, Lacoste J, Parsons JT. Regulated expression of focal adhesion kinase-related nonkinase, the autonomously expressed C-terminal domain of focal adhesion kinase. Mol Cell Biol 1999; 19: 6120-9.
- 33. Sieg DJ, Hauck CR, Schlaepfer DD. Required role of focal adhesion kinase (FAK) for integrin-stimulated cell migration. J Cell Sci 1999; 112: 2677-91.
- 34. Mortier E, Cornelissen F, van Hove C, Dillen L, Richardson A. The focal adhesion targeting sequence is the major inhibitory moiety of Fak-related non-kinase. Cell Signal 2001; 13: 901-9.
- 35. Cooray P, Yuan Y, Schoenwaelder SM, Mitchell CA, Salem HH, Jackson SP. Focal adhesion kinase (pp125FAK) cleavage and regulation by calpain. Biochem J 1996; 318: 41-7.
- 36. Yamada KM, Araki M. Tumor suppressor PTEN: modulator of cell signaling, growth, migration and apoptosis. J Cell Sci 2001; 114: 2375-82.
- 37. Garton AJ, Tonks NK. Regulation of fibroblast motility by the protein tyrosine phosphatase PTP-PEST. J Biol Chem 1999; 274: 3811-8.
- 38. Hassid A, Huang S, Yao J. Role of PTP-1B in aortic smooth muscle cell motility and tyrosine phosphorylation of focal adhesion proteins. Am J Physiol 1999; 277: H192-8.
- 39. Lu Z, Jiang G, Blume-Jensen P, Hunter T. Epidermal growth factor-induced tumor cell invasion and metastasis initiated by dephosphorylation and downregulation of focal adhesion kinase. Mol Cell Biol 2001; 21: 4016-31.
- 40. Parsons JT, Martin KH, Slack JK, Taylor JM, Weed SA. Focal adhesion kinase: a regulator of focal adhesion dynamics and cell movement. Oncogene 2000; 19: 5606-13.
- 41. Owen JD, Ruest PJ, Fry DW, Hanks SK. Induced focal adhesion kinase (FAK) expression in FAK-null cells enhances cell spreading and migration requiring both auto- and activation loop phosphorylation sites and inhibits adhesion-dependent tyrosine phosphorylation of Pyk2. Mol Cell Biol 1999; 19: 4806-18.
- 42. Cary LA, Han DC, Polte TR, Hanks SK, Guan JL. Identification of p130Cas as a mediator of focal adhesion kinase-promoted cell migration. J Cell Biol 1998; 140: 211-21.
- 43. Ridyard MS, Sanders EJ. Potential roles for focal adhesion kinase in development. Anat Embryol (Berl) 1999; 199: 1-7.
- 44. Soldi R, Mitola S, Strasly M, Defilippi P, Tarone G, Bussolino F. Role of αvβ3 integrin in the activation of vascular endothelial growth factor receptor-2. Embo J 1999; 18: 882-92.
- 45. Qi JH, Claesson-Welsh L. VEGF-induced activation of phosphoinositide 3-kinase is dependent on focal adhesion kinase. Exp Cell Res 2001; 263: 173-82.
- 46. Hauck CR, Hsia DA, Schlaepfer DD. Focal adhesion kinase facilitates platelet-derived growth factor-BB-stimulated ERK2 activation required for chemotaxis migration of vascular smooth muscle cells. J Biol Chem 2000; 275: 41092-9.
- 47. Sastry SK, Lakonishok M, Wu S, et al. Quantitative changes in integrin and focal adhesion signaling regulate myoblast cell cycle withdrawal. J Cell Biol 1999; 144: 1295-309.
- 48. Gilmore AP, Romer LH. Inhibition of focal adhesion kinase (FAK) signaling in focal adhesions decreases cell motility and proliferation. Mol Biol Cell 1996; 7: 1209-24.
- 49. Zhao JH, Reiske H, Guan JL. Regulation of the cell cycle by focal adhesion kinase. J Cell Biol 1998; 143: 1997-2008.
- 50. Zhao J, Pestell R, Guan JL. Transcriptional activation of cyclin D1 promoter by FAK contributes to cell cycle progression. Mol Biol Cell 2001; 12: 4066-77.
- 51. Bruce-Staskal PJ, Bouton AH. PKC-dependent activation of FAK and src induces tyrosine phosphorylation of Cas and formation of Cas-Crk complexes. Exp Cell Res 2001; 264: 296-306.
- 52. Danilkovitch A, Donley S, Skeel A, Leonard EJ. Two independent signaling pathways mediate the antiapoptotic action of macrophage-stimulating protein on epithelial cells. Mol Cell Biol 2000; 20: 2218-27.
- 53. Xu LH, Owens LV, Sturge GC, et al. Attenuation of the expression of the focal adhesion kinase induces apoptosis in tumor cells. Cell Growth Differ 1996; 7: 413-8.
- 54. Maung K, Easty DJ, Hill SP, Bennett DC. Requirement for focal adhesion kinase in tumor cell adhesion. Oncogene 1999; 18: 6824-8.
- 55. Sonoda Y, Matsumoto Y, Funakoshi M, Yamamoto D, Hanks SK, Kasahara T. Anti-apoptotic role of focal adhesion kinase (FAK). Induction of inhibitor-of-apoptosis proteins and apoptosis suppression by the overexpression of FAK in a human leukemic cell line, HL-60. J Biol Chem 2000; 275: 16309-15.
- 56. Almeida EA, Ilic D, Han Q, et al. Matrix survival signaling: from fibronectin via focal adhesion kinase to c-Jun NH2-terminal kinase. J Cell Biol 2000; 149: 741-54.
- 57. Wen LP, Fahrni JA, Troie S, Guan JL, Orth K, Rosen GD. Cleavage of focal adhesion kinase by caspases during apoptosis. J Biol Chem 1997; 272: 26056-61.
- 58. Jones RJ, Brunton VG, Frame MC. Adhesion-linked kinases in cancer: emphasis on src, focal adhesion kinase and PI 3-kinase. Eur J Cancer 2000; 36: 1595-606.
- 59. Guan JL, Shalloway D. Regulation of focal adhesion-associated protein tyrosine kinase by both cellular adhesion and oncogenic transformation. Nature 1992; 358: 690-2.
- 60. Scott G, Liang H. pp125FAK in human melanocytes and melanoma: expression and phosphorylation. Exp Cell Res 1995; 219: 197-203.
- 61. Campos L, Boudard D, Chautard S, Viallet A, Piselli S, Guyotat D. Expression of focal adhesion kinase (FAK) and proline-rich tyrosine kinase 2 (Pyk2) in acute myeloid leukemia cells. 5th Annual meeting of the European Haematology Association. Birmingham, Juin 2000, abstract 370.
- 62. Cottier M, Parmentier B, Giollant M, et al. Combined conventional and molecular cytogenetic investigations of cancer cell lines with different focal adhesion kinase expression patterns. Congrès AFC cytométrie. Saint-Étienne, 2001, abstract 44.
- 63. Turhan A. Biologie de la protéine de fusion BCR-ABL: progrès récent. Hématologie 2002; 8: 35-45.
List of figures
Figure 1
Le complexe d’adhérence focale.
Le complexe d’adhérence est une large structure composée de protéines connectées entre elles par leur domaine SH2 ou SH3 (Src homology regions 2 and 3). Au sein de ces complexes, FAK est l’un des points centraux de ces connexions en étant l’intermédiaire entre les signaux activateurs des intégrines ou des facteurs de croissance et les autres protéines. Le nombre de protéines nécessite l’association de plusieurs protéines FAK pour permettre une bonne cohésion du système. FAK: focal adhesion kinase; Fyn: tyrosine kinase Fyn; Graf: GTPase regulator associated with focal adhesion kinase; Grb2, Grb7: growth factor receptor-bound protein 2, 7; p130Cas: protéine de 130 kDa associée à Crk (Crk-associated substrate); PI3K: phosphatidylinositol 3-kinase; PLCγ: phospholipase C γ; Rho: protéines Rho; Sos: protéine sos; SRC: tyrosine kinase src.
Figure 2
Structure de FAK.
La protéine FAK est divisée en trois domaines, un domaine amino-terminal et un domaine carboxy-terminal délimitant un domaine central portant l’activité catalytique. L’autophosphorylation de la tyrosine en Y397 permet la liaison avec les kinases de la famille Src. Ces kinases vont phosphoryler les autres résidus tyrosine de FAK ainsi que des résidus de protéines liées à FAK. Dans la partie amino-terminale, on retrouve un domaine homologue avec les protéines du groupe bande 4.1/ERM (ezrine, radixine, moésine). Ce domaine permet l’association de FAK avec des récepteurs de facteurs de croissance. La région FAT (focal adhesion targeting), située dans son domaine carboxy-terminal est nécessaire, pour la localisation dans le complexe d’adhérence par l’intermédiaire de liaisons avec la taline et la paxilline. La liaison et le mode d’activation des intégrines ne sont pas déterminés avec certitude. Sur la figure sont représentées les principales protéines interagissant avec FAK et leur site de liaison respectif. ASAP1: ARF (ADP ribosylation factor)-GAP (GTPase-activating protein) containing SH3, Ank repeats, and pH domain; Graf: GTPase regulator associated with focal adhesion kinase; Grb2, Grb7: growth factor receptor-bound protein 2, 7; PI3K: phosphatidylinositol 3-kinase; p85: sous-unité régulatrice de la PIP3K; PLCγ: phospholipase C γ; p130Cas: protéine de 130 kDa associée à Crk (Crk-associated substrate); c-SRC: tyrosine kinase src; bandes bleu foncé: sites riches en proline, permettant les liaisons avec des domaines SH3; Y: résidus tyrosine permettant des liaisons avec des domaines SH2
Figure 3
Les voies de signalisation de l’adhérence focale.
Le schéma simplifié propose un résumé des possibilités d’interaction entre les protéines du complexe d’adhérence et les voies de signalisation sous-jacentes. FAK est initialement activée par l’intermédiaire d’intégrines et/ou de facteurs de croissance. Cette activation va permettre la liaison et l’activation de plusieurs protéines. (1) Graf, Grb7, PLC-γ. vont participer au remaniement du cytosquelette d’actine, engendrant ainsi un cycle de migration et d’adhérence cellulaires avec pour chaque étape une restructuration et une déstructuration des complexes d’adhérence. p130Cas, Grb2, PI3-kinase vont secondairement participer à l’activation en cascade de plusieurs voies intracellulaires, la voie de Erk (2 et 3), la voie de JNK (4) et la voie de la PI3-kinase (5). Elles vont permettre in fine de régler plusieurs processus vitaux pour la cellule telles que la survie, la prolifération et la migration cellulaires en favorisant l’activation de facteurs de transcription. AKT: protéine kinase AKT; FAK: focal adhesion kinase; ERK: extracellular signal-regulated kinases; Fyn: tyrosine kinase Fyn; Graf: GTPase regulator associated with focal adhesion kinase; Grb2, Grb7: growth factor receptor-bound protein 2, 7; JNK: jun N-terminal kinases; MEK: MAP erk kinase; NFΚB: nuclear factor ΚB; p130Cas: protéine de 130 kDa associée à Crk (Crk-associated substrate); PI3K: phosphatidylinositol 3 kinase; PIP2: phosphatidyl inositol bisphosphate; PLCγ: phospholipase C γ; Raft1: rapamycine FΚBP target 1; Rac: GTPase rac; Ras: GTPase ras; SRC: tyrosine kinase src; Sos: protéine sos.
List of tables
Tableau I
Les principaux intervenants du complexe d’adhérence.