Abstracts
Résumé
La maladie de Parkinson est caractérisée par la mort progressive et préférentielle des neurones dopaminergiques de la substantia nigra et la présence d’inclusions protéiques ubiquitinylées, les corps de Lewy. Durant ces six dernières années, quatre gènes impliqués dans de rares formes familiales de maladie de Parkinson ont été identifiés: des mutations des gènes de l’α-synucléine et de l’ubiquitine hydrolase UCH-L1 (ubiquitin carboxyterminal hydrolase L1) sont associées à des formes autosomiques dominantes, tandis que des mutations des gènes de la parkine et de DJ-1 sont responsables de formes autosomiques récessives. Un gain de fonction toxique, associé à l’assemblage de l’α-synucléine en fibrilles insolubles de type amyloïde, pourrait rendre compte de la mort neuronale dans les syndromes parkinsoniens dus à des mutations du gène de l’α-synucléine. En revanche, une perte de fonction serait à l’origine de la maladie de Parkinson provoquée par des mutations des gènes de la parkine et d’UCH-L1, deux enzymes clés de la voie protéolytique ubiquitine-protéasome. La présence d’α-synucléine, de parkine et d’UCH-L1 dans les corps de Lewy suggère qu’un dysfonctionnement des voies de repliement et de dégradation des protéines pourrait jouer un rôle non seulement dans les formes familiales de maladie de Parkinson, mais également dans la forme sporadique, plus fréquente.
Summary
Parkinson’s disease is characterized by the progressive and selective loss of the dopaminergic neurons in the substantia nigra and the presence of ubiquitinated protein inclusions termed Lewy bodies. In the past six years, four genes involved in rare inherited forms of Parkinson’s disease have been identified: mutations in the α-synuclein and ubiquitin carboxyterminal hydrolase L1 genes (UCH-L1) cause autosomal dominant forms, whereas mutations in the Parkin and DJ-1 genes are responsible for autosomal recessive forms of the disease. A toxic gain of function related to the ability of α-synuclein to assemble into insoluble amyloid fibrils may underlie neuronal cell death in parkinsonism due to α-synuclein gene mutations. In contrast, loss of protein function appears to be the cause of the disease in parkinsonism due to mutations in the genes encoding Parkin and UCH-L1, which are key enzymes of the ubiquitin-proteasome pathway. The presence of α-synuclein, Parkin and UCH-L1 in Lewy bodies suggests that dysfunction of pathways involved in protein folding and degradation is not only involved in the pathogenesis of familial Parkinson’s disease, but could also play a role in the frequent sporadic form of the disease (idiopathic Parkinson’s disease).
Article body
La maladie de Parkinson est une affection neurodégénérative invalidante, deuxième en fréquence après la maladie d’Alzheimer, avec une prévalence supérieure à 2 % après l’âge de 65 ans. Elle se manifeste cliniquement par un tremblement, une rigidité, une difficulté à déclencher les mouvements et une lenteur à les exécuter. Cette triade de symptômes moteurs est due à une perte massive, progressive et préférentielle d’une population de neurones, située dans la substantia nigra, producteurs du neurotransmetteur dopamine ((→) m/s 2000, n° 11, p. 1289). À cette lésion caractéristique s’associe un stigmate neuropathologique, le corps de Lewy, inclusion neuronale cytoplasmique éosinophile et ubiquitinylée [1].
La raison de la dégénérescence neuronale dans la maladie de Parkinson demeure une énigme. Au début des années 1980, cette affection était considérée comme étant essentiellement d’origine environnementale, étant donné la variabilité géographique observée dans l’incidence de la maladie. Fondée sur des données épidémiologiques, cette hypothèse fut corroborée par la découverte, en Californie, d’un syndrome parkinsonien cliniquement très proche de la maladie sporadique, chez des jeunes toxicomanes ayant consommé une drogue de synthèse. L’analyse chimique de cette drogue permit d’identifier le contaminant, le 1-méthyl-4-phényl-1, 2, 3, 6-tétrahydropyridine (MPTP), et son produit d’oxydation, le 1-méthyl-4-phénylpyridine (MPP+), une puissante neurotoxine ayant une ressemblance structurale avec certains herbicides [2].
Près de vingt ans plus tard, la contribution de facteurs génétiques à la pathogénie de la maladie de Parkinson ne fait aucun doute. Des études de jumeaux - fondées sur une évaluation de l’intégrité des neurones dopaminergiques à l’état préclinique à l’aide de la technique de tomographie par émission de positons - ont mis en évidence un taux de concordance plus élevé chez les jumeaux monozygotes que chez les dizygotes. Le risque d’incidence de la maladie est également significativement plus élevé, par rapport à la population générale, chez les parents de premier degré de sujets atteints. Enfin, au moins huit locus (PARK 1 à 8) responsables de formes monogéniques de maladie de Parkinson ont été identifiés (Tableau I) [3]. Trois gènes sont clairement associés à la maladie, les gènes de l’α-synucléine (PARK 1), de la parkine (PARK 2) et de DJ-1 (PARK7). Divers arguments plaident en faveur de l’implication d’un quatrième gène codant pour l’ubiquitine hydrolase UCH-L1 (ubiquitin carboxy-terminal hydrolase L1) (PARK 5).
Tableau I
Locus impliqués dans les formes familiales monogéniques de maladie de Parkinson.
α-synucléine: fonction et mécanismes de toxicité
En 1997, le gène de l’α-synucléine fut le premier a être reconnu responsable d’une forme rare de maladie de Parkinson, transmise selon le mode autosomique dominant, lorsqu’il porte l’une des deux mutations faux-sens Ala30Pro et Ala53Thr [3] ((→) m/s 2000, n° 8-9, p. 956). Les patients porteurs de ces mutations présentent une maladie de Parkinson sévère, dont le début se situe entre la 4e et la 6e décennie. L’α-synucléine est une protéine neuronale de 140 acides aminés, extrêmement conservée chez les vertébrés. Elle est enrichie dans de nombreuses régions cérébrales (néocortex, hippocampe, gyrus denté, bulbe olfactif, striatum, thalamus, cervelet) dans lesquelles elle se concentre au niveau des terminaisons synaptiques. Sa fonction est loin d’être élucidée [4].
In vivo, l’α-synucléine est étroitement associée aux vésicules synaptiques. In vitro, elle s’associe avec des vésicules de phospholipides synthétiques ou purifiées à partir de cerveau. Cette interaction s’effectue par l’intermédiaire de la région amino-terminale et pourrait être perturbée par les mutations Ala30Pro et Ala53Thr qui, toutes deux, affectent ce domaine. L’α-synucléine inhibe de manière sélective les phospholipases D1 et D2, enzymes membranaires dont l’activité d’hydrolyse de phospholipides est réglée par une série de protéines effectrices indispensables aux phénomènes d’endocytose impliquant la clathrine. L’homologie de l’α-synucléine avec les protéines de la famille des FABP (fatty acid-binding proteins) indique qu’elle pourrait transporter des acides gras à proximité des lieux de synthèse de vésicules synaptiques. En agissant telle un chaperon des lipides, l’α-synucléine pourrait également régler le turnover ou l’organisation locale d’acides gras poly-insaturés ayant un rôle au cours du processus d’endocytose dépendant de la clathrine. Ces données suggèrent un rôle majeur de l’α-synucléine dans le recyclage de vésicules synaptiques [4].
Agrégation, synonyme de toxicité?
Le dysfonctionnement de la neurotransmission dopaminergique provoqué par l’invalidation du gène de l’α-synucléine chez la souris suggère que cette protéine exerce une fonction clé dans la transmission synaptique [4, 5]. Cependant, l’absence de signes comportementaux ou neuropathologiques évidents chez ces souris invalidées indique qu’un gain de fonction toxique, et non une perte de fonction, pourrait être à l’origine de la maladie de Parkinson liée à une mutation du gène de l’α-synucléine. La mise en évidence de fibrilles insolubles d’α-synucléine, en tant que composant majeur des corps de Lewy, a constitué un argument convaincant en faveur de cette hypothèse [6]. La toxicité de l’α-synucléine semblait donc être en relation avec sa tendance à former des fibrilles de type amyloïde; la présence de celles-ci rendrait compte de la neurodégénerescence observée aussi bien dans les syndromes parkinsoniens dus aux mutations du gène de l’α-synucléine que dans la maladie de Parkinson idiopathique ou la démence avec corps de Lewy.
La surexpression de l’α-synucléine par transgenèse chez la souris ou chez la drosophile, ou par injection directe de vecteurs viraux recombinants dans la substantia nigra chez le rat, nous a appris qu’une surproduction de la protéine humaine normale ou de ses variants pathogènes peut conduire à une dégénérescence de la voie dopaminergique nigro-striatale [4, 5, 7-9]. Selon les modèles, cette dégénérescence peut s’accompagner d’inclusions cytoplasmiques immunoréactives à l’α-synucléine et/ou de symptômes moteurs. Ces études ont également montré que l’accumulation d’α-synucléine ne touche pas obligatoirement les neurones de la substantia nigra, et qu’elle peut en revanche être néfaste pour d’autres populations neuronales. Ces observations rejoignent certaines données neuropathologiques obtenues chez l’homme: la présence de dépôts anormaux d’α-synucléine est en effet observée au sein de différents types de neurones, mais aussi de cellules gliales, comme dans l’atrophie systématisée multiple, d’où le regroupement de ces maladies sous le terme d’α-synucléinopathies. Une accumulation d’α-synucléine n’est cependant pas synonyme de dégénérescence, comme le montrent plusieurs études chez l’animal où la formation d’inclusions immunoréactives à l’α-synucléine n’est pas accompagnée d’une mort neuronale.
Dopamine et toxicité sélective de l’α-synucléine
La question des mécanismes sous-tendant la dégénérescence neuronale et la sélectivité des lésions dans la maladie de Parkinson s’est dès lors posée. Des études très récentes suggèrent que la dopamine elle-même est responsable de la vulnérabilité des neurones dopaminergiques à l’accumulation d’α-synucléine. Ainsi, il a été montré que des neurones dopaminergiques humains en culture primaire peuvent être sauvés de la mort provoquée par une surexpression d’α-synucléine si l’on prévient la production de dopamine endogène [10]. La dopamine pourrait donc contribuer à la pathogénie de la maladie de Parkinson, en synergie avec l’α-synucléine [4]. Auparavant, déjà, il avait été proposé que le métabolisme physiologique de la dopamine pourrait rendre les neurones dopaminergiques particulièrement vulnérables à une situation de stress oxydant. L’auto-oxydation chimique de la dopamine et son catabolisme par la monoamine oxydase B conduisent en effet à la production de radicaux libres toxiques. Des données récentes suggèrent également qu’un produit d’oxydation de la dopamine stabilise in vitro des protofibrilles d’α-synucléine, empêchant la production de fibrilles insolubles [11]. Ainsi, la formation de protofibrilles d’α-synucléine, plutôt que l’accumulation de fibrilles insolubles au sein des corps de Lewy, serait à mettre en relation avec les effets neurotoxiques de l’α-synucléine et leur sélectivité pour les neurones dopaminergiques (Figure 1). Cette hypothèse est renforcée par des données, obtenues in vitro, montrant que les mutations Ala30Pro et Ala53Thr accélèrent toutes deux la formation d’oligomères protofibrillaires d’α-synucléine, alors que seule la mutation Ala53Thr favorise l’assemblage en fibrilles de type amyloïde [12]; pourtant, les deux types de mutations sont associés à une neurodégénérescence.
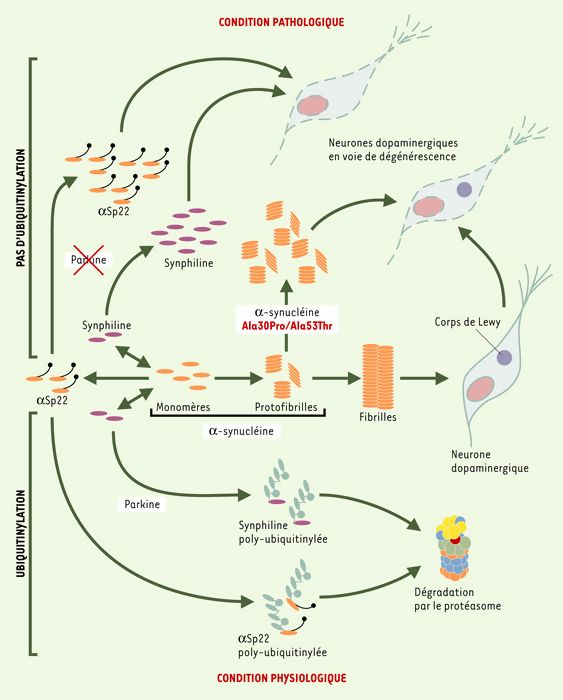
Figure 1
Voies moléculaires impliquées dans la pathogénie de la maladie de Parkinson.
Dans la maladie de Parkinson due aux mutations Ala30Pro ou Ala53Thr de l’α-synucléine, un gain de fonction toxique, lié vraisemblablement à la stabilisation de protofibrilles délétères d’α-synucléine, pourrait être à l’origine de la dégénérescence des neurones dopaminergiques de la substantia nigra. Comme dans la maladie de Parkinson idiopathique, cette dégénérescence est associée à la présence de corps de Lewy composés principalement de fibrilles insolubles d’α-synucléine. Dans la maladie de Parkinson due à des mutations du gène de la parkine, une perte de fonction de cette protéine conduirait à l’accumulation aberrante d’une forme O-glycosylée d’α-synucléine (αSp22) ainsi que de la synphiline, protéine partenaire de l’α-synucléine. La mort neuronale qui s’ensuit apparaît en l’absence de corps de Lewy. Dans des conditions physiologiques (partie inférieure de la figure), l’αSp22 et la synphiline seraient poly-ubiquitinylées par la parkine et dégradées par le protéasome.
Comment expliquer la toxicité des protofibrilles d’α-synucléine? Il semblerait que l’association de ces protofibrilles avec des vésicules de phospholipides mène à la formation de véritables pores membranaires [13]. Favorisée par les mutations Ala30Pro et Ala53Thr, la formation de ces pores conduirait à la libération de molécules de petite taille, telles que la dopamine. Or, la production d’espèces radicalaires délétères après l’auto-oxydation de la dopamine - processus qui intervient lorsque ce neurotransmetteur s’accumule de manière anormale dans le cytoplasme - pourrait jouer un rôle crucial dans la pathogénie de la maladie de Parkinson [4].
Perte de fonction de la parkine et dysfonctionnement de la voie protéolytique ubiquitine-protéasome
Une étape importante a été franchie au Japon, en 1998, avec la découverte de l’implication du gène de la parkine dans un syndrome parkinsonien familial à début précoce, transmis selon le mode autosomique récessif ((→) m/s 1998, n° 12, p. 1451) [3]. Aujourd’hui, le gène de la parkine paraît intervenir dans près de 50 % des cas familiaux transmis selon le mode autosomique récessif, avec un début avant 45 ans, mais également dans plus de 15 % des cas isolés de maladie de Parkinson à début précoce, dans des populations de diverses origines ethniques. De multiples combinaisons de mutations ponctuelles, délétions ou multiplications d’exons dans le gène de la parkine rendent compte d’un tableau clinique variable, parfois identique à celui de la maladie de Parkinson idiopathique.
La parkine est une protéine ubiquitaire de 465 acides aminés, caractérisée par la présence d’un domaine homologue de l’ubiquitine à son extrémité amino-terminale et de deux domaines riches en cystéines de type RING finger dans la région carboxy-terminale. Comme d’autres protéines de type RING finger, la parkine intervient dans l’une des voies majeures de dégradation des protéines cellulaires, la voie ubiquitine-protéasome (Figure 2). Grâce à son activité E3 ubiquitine-ligase, elle reconnaît des protéines substrats spécifiques et induit leur poly-ubiquitinylation, signal de ciblage vers la voie de dégradation par le protéasome [14]. La perte de cette fonction entraînerait une accumulation délétère de substrats non ubiquitinylés qui serait à l’origine de la dégénérescence neuronale chez les patients porteurs de mutations du gène de la parkine. Par ailleurs, l’absence de corps de Lewy chez la plupart de ces patients suggère que la parkine joue un rôle central dans la formation de ces inclusions ubiquitinylées. La présence fréquente de la parkine dans les corps de Lewy de patients atteints de maladie de Parkinson idiopathique, ou due à une mutation du gène de l’α-synucléine, est en faveur de cette hypothèse [15]. L’existence d’une neurodégénérescence en l’absence de corps de Lewy en cas de mutations du gène de la parkine suggère également que la présence de corps de Lewy dans la maladie de Parkinson idiopathique pourrait n’être qu’un simple marqueur phénotypique d’un dysfonctionnement, et non la cause de la mort neuronale.
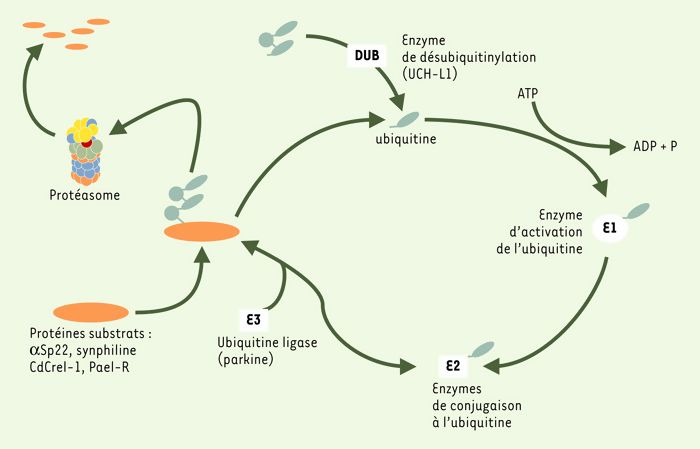
Figure 2
Maladie de Parkinson et voie protéolytique ubiquitine-protéasome.
L’ubiquitinylation est un signal de dégradation permettant de cibler les protéines cellulaires vers leur dégradation par le protéasome. Ce processus dépendant de l’ATP requiert l’action séquentielle de trois enzymes, nommées respectivement E1, E2 et E3, qui conduisent à l’addition covalente de molécules d’ubiquitine sur des protéines spécifiques de substrats. Dans cette voie interviennent également des enzymes de désubiquitinylation (ubiquitine hydrolases) qui permettent de recycler des monomères d’ubiquitine indispensables à l’adressage de protéines cellulaires vers la dégradation par le protéasome. Une altération de la voie ubiquitine-protéasome peut conduire à une dégénérescence de la voie dopaminergique nigro-striatale. Ainsi, la mutation Ile93Met du gène codant pour l’ubiquitine hydrolase UCH-L1 rend compte d’un syndrome parkinsonien transmis selon le mode autosomique dominant dans une famille allemande. De plus, une grande variété de réarrangements d’exons et de mutations ponctuelles du gène codant pour la E3 ubiquitine ligase parkine est associée à une maladie de Parkinson autosomique récessive dans des populations de diverses origines ethniques.
Substrats accumulés lors de la perte de fonction de la parkine
Une isoforme minoritaire O-glycosylée d’α-synucléine (αSp22) a été identifiée, dont le taux est augmenté dans le cerveau de patients porteurs de mutations du gène de la parkine [15]. L’αSp22, normalement associée à la parkine dans le cerveau humain, est ubiquitinylée in vitro par la parkine normale, tandis que des formes mutantes de celle-ci sont incapables de promouvoir cette réaction. Par ailleurs, la synphiline, une protéine partenaire de l’α-synucléine dont on ignore la fonction, est également ubiquitinylée par la parkine [16]. Le rôle délétère d’une éventuelle accumulation de l’αSp22 et de la synphiline reste toutefois à démontrer. Cependant, l’interaction fonctionnelle entre la parkine et l’α-synucléine - directe via l’αSp22 ou indirecte via le partenaire synphiline de l’α-synucléine - est en faveur d’un rôle biologique des deux protéines dans une même voie moléculaire impliquée dans la pathogénie de la maladie de Parkinson (Figure 1).
Comme l’indiquent les interactions de la parkine avec d’autres protéines aux fonctions distinctes [16], des voies pathogènes autres que celles impliquant l’α-synucléine pourraient exister. En réglant le turn-over de CDCrel-1, une GTPase associée aux vésicules synaptiques, la parkine pourrait jouer un rôle dans le transport vésiculaire et la libération de neurotransmetteurs. Son association directe avec la protéine CASK, au sein d’un complexe multimérique post-synaptique impliqué dans la signalisation activée par le NMDA, suggère que la parkine pourrait moduler la transmission synaptique. Enfin, la parkine semble protéger les cellules de la mort induite par l’accumulation de protéines mal repliées dans le réticulum endoplasmique. Le récepteur transmembranaire présomptif Pael-R (parkin associated endothelin receptor-like receptor), une protéine de fonction inconnue, abondamment représentée dans les neurones dopaminergiques de la voie nigro-striatale, est une autre cible de l’activité E3 ubiquitine ligase de la parkine. Lorsqu’elle est surexprimée, la protéine Pael-R tend à s’accumuler dans le réticulum endoplasmique, provoquant une mort cellulaire qui peut être prévenue par la surproduction concomitante de parkine. Par ailleurs, l’accumulation de Pael-R dans le cerveau de patients porteurs de mutations du gène de la parkine est un fort indice en faveur d’un rôle de cette protéine dans la dégénérescence des neurones dopaminergiques de la voie nigro-striatale.
UCH-L1: ubiquitine hydrolase ou ubiquitine ligase?
Un second gène témoigne du rôle clé d’un défaut de la voie d’ubiquitinylation dans la dégénérescence neuronale observée au cours de la maladie de Parkinson. En 1998, une substitution Ile93Met fut identifiée dans le gène codant pour UCHL-1 chez deux membres d’une famille allemande atteints d’un syndrome parkinsonien transmis selon le mode autosomique dominant [3]. UCH-L1, l’une des protéines les plus abondantes dans le cerveau, est une ubiquitine hydrolase qui permet de recycler des monomères d’ubiquitine indispensables à l’adressage de protéines cellulaires vers la voie de dégradation par le protéasome (Figure 2). Le rôle pathogène d’UCHL-1 reste à démontrer, puisqu’à ce jour aucune autre mutation dans son gène n’a été retrouvée dans la maladie de Parkinson. Néanmoins, l’activité hydrolase du variant Ile93Met paraît réduite de 50 % dans un test in vitro, laissant entrevoir la possibilité que cette mutation pourrait compromettre la dégradation de protéines cellulaires par le protéasome en diminuant la quantité de monomères d’ubiquitine disponibles.
À côté de son activité ubiquitine hydrolase, la protéine UCH-L1 possède in vitro une activité ubiquitine ligase non classique qui conduit à la formation de chaînes de poly-ubiquitine non canoniques, résistantes à la dégradation par le protéasome [17]. Le polymorphisme Ser18Tyr du gène UCH-L1 semble conférer une protection vis-à-vis de la maladie de Parkinson: en effet, des études d’association montrent une plus faible incidence de la maladie de Parkinson, parmi les sujets porteurs de ce variant polymorphique, par rapport à la population générale. Or, ce polymorphisme compromet sévèrement l’activité ubiquitine ligase de la protéine: des expériences d’ubiquitinylation in vitro ont en effet montré que le variant Ser18Tyr d’UCH-L1 est cinq fois moins actif que la protéine normale. Ces données suggèrent qu’une augmentation pathologique de l’activité ubiquitine ligase d’UCH-L1 pourrait être fatale aux neurones dopaminergiques de la voie nigro-striatale.
Il est tentant de mettre en relation cet effet délétère potentiel avec l’accumulation d’une forme poly-ubiquitinylée non dégradable d’α-synucléine. En effet, UCH-L1 peut ubiquitinyler l’α-synucléine in vitro. Par ailleurs, la capacité d’anticorps dirigés contre la protéine UCH-L1 d’immunoprécipiter à la fois UCH-L1 et l’α-synucléine à partir d’homogénats de cerveau de rat suggère que l’α-synucléine est un substrat physiologique d’UCH-L1.
DJ-1: une protéine aux multiples fonctions présomptives
Très récemment, une délétion génomique et une mutation ponctuelle (L166P) du gène DJ-1 ont été identifiées comme responsables d’une maladie de Parkinson transmise selon le mode autosomique récessif, dans une famille hollandaise et une famille italienne, respectivement [18]. DJ-1, une protéine ubiquitaire de 189 acides aminées, est un protagoniste de multiples interactions protéine-protéine par lesquelles elle semble intervenir dans de nombreuses voies moléculaires. Néanmoins, seule la détermination précise de sa fonction, notamment à travers l’étude des conséquences de l’inactivation du gène DJ-1 chez l’animal, permettra de relier cette protéine à la pathogénie de la maladie de Parkinson.
Conclusions
D’énormes progrès dans la compréhension de la physiopathologie de la maladie de Parkinson ont été réalisés au cours de ces dernières années, grâce à l’identification et à la caractérisation de gènes responsables de rares formes familiales de cette affection. De nombreux défis doivent encore être relevés, afin de cerner les mécanismes par lesquels facteurs génétiques et environnementaux participent à la pathogénie de cette maladie complexe et d’envisager le développement de stratégies thérapeutiques innovantes.
Appendices
Références
- 1. Forno LS. The Lewy body in Parkinson’s disease. Adv Neurol 1987; 45: 35-43.
- 2. Langston JW, Ballard P, Tetrud JW, Irwin I. Chronic parkinsonism in humans due to a product of meperidine-analog synthesis. Science 1983; 219: 979-80.
- 3. Lansbury PT, Brice A. Genetics of Parkinson’s disease and biochemical studies of implicated gene products. Curr Opin Genet Dev 2002; 12: 299-306.
- 4. Lotharius J, Brundin P. Pathogenesis of Parkinson’s disease: dopamine, vesicles and alpha-synuclein. Nat Rev Neurosci 2002; 3: 932-42.
- 5. Kahle PJ, Haass C, Kretzschmar HA, Neumann M. Structure/function of alpha-synuclein in health and disease: rational development of animal models for Parkinson’s and related diseases. J Neurochem 2002; 82: 449-57.
- 6. Spillantini MG, Schmidt ML, Lee VM, et al. Alpha-synuclein in Lewy bodies. Nature 1997; 388: 839-40.
- 7. Kirik D, Rosenblad C, Burger C, et al. Parkinson-like neurodegeneration induced by targeted overexpression of alpha-synuclein in the nigrostriatal system. J Neurosci 2002; 22: 2780-91.
- 8. Klein RL, King MA, Hamby ME, Meyer EM. Dopaminergic cell loss induced by human A30P alpha-synuclein gene transfer to the rat substantia nigra. Hum Gene Ther 2002; 13: 605-12.
- 9. Lo Bianco C, Ridet JL, Schneider BL, Deglon N, Aebischer P. Alpha-synucleinopathy and selective dopaminergic neuron loss in a rat lentiviral-based model of Parkinson’s disease. Proc Natl Acad Sci USA 2002; 99: 10813-8.
- 10. Xu J, Kao SY, Lee FJ, et al. Dopamine-dependent neurotoxicity of alpha-synuclein: a mechanism for selective neurodegeneration in Parkinson disease. Nat Med 2002; 8: 600-6.
- 11. Conway KA, Rochet JC, Bieganski RM, Lansbury PT Jr. Kinetic stabilization of the alpha-synuclein protofibril by a dopamine-alpha-synuclein adduct. Science 2001; 294: 1346-9.
- 12. Conway KA, Lee SJ, Rochet JC, et al. Acceleration of oligomerization, not fibrillization, is a shared property of both alpha-synuclein mutations linked to early-onset Parkinson’s disease: implications for pathogenesis and therapy. Proc Natl Acad Sci USA 2000; 97: 571-6.
- 13. Lashuel HA, Hartley D, Petre BM, Walz T, Lansbury PT Jr. Neurodegenerative disease: amyloid pores from pathogenic mutations. Nature 2002; 418: 291.
- 14. Shimura H, Hattori N, Kubo S, et al. Familial Parkinson disease gene product, parkin, is a ubiquitin-protein ligase. Nat Genet 2000; 25: 302-5.
- 15. Shimura H, Schlossmacher MG, Hattori N, et al. Ubiquitination of a new form of alpha-synuclein by parkin from human brain: implications for Parkinson’s disease. Science 2001; 293: 263-9.
- 16. Giasson BI, Lee VM. Parkin and the molecular pathways of Parkinson’s disease. Neuron 2001; 31: 885-8.
- 17. Liu Y, Fallon L, Lashuel HA, Liu Z, Lansbury PT. The UCH-L1 gene encodes two opposing enzymatic activities that affect alpha-synuclein degradation and Parkinson’s disease susceptibility. Cell 2002; 111: 209-18.
- 18. Bonifati V, Rizzu P, van Baren MJ, et al. Mutations in the DJ-1 gene associated with autosomal recessive early-onset parkinsonism. Science 2003; 299: 256-9.
List of figures
Figure 1
Voies moléculaires impliquées dans la pathogénie de la maladie de Parkinson.
Dans la maladie de Parkinson due aux mutations Ala30Pro ou Ala53Thr de l’α-synucléine, un gain de fonction toxique, lié vraisemblablement à la stabilisation de protofibrilles délétères d’α-synucléine, pourrait être à l’origine de la dégénérescence des neurones dopaminergiques de la substantia nigra. Comme dans la maladie de Parkinson idiopathique, cette dégénérescence est associée à la présence de corps de Lewy composés principalement de fibrilles insolubles d’α-synucléine. Dans la maladie de Parkinson due à des mutations du gène de la parkine, une perte de fonction de cette protéine conduirait à l’accumulation aberrante d’une forme O-glycosylée d’α-synucléine (αSp22) ainsi que de la synphiline, protéine partenaire de l’α-synucléine. La mort neuronale qui s’ensuit apparaît en l’absence de corps de Lewy. Dans des conditions physiologiques (partie inférieure de la figure), l’αSp22 et la synphiline seraient poly-ubiquitinylées par la parkine et dégradées par le protéasome.
Figure 2
Maladie de Parkinson et voie protéolytique ubiquitine-protéasome.
L’ubiquitinylation est un signal de dégradation permettant de cibler les protéines cellulaires vers leur dégradation par le protéasome. Ce processus dépendant de l’ATP requiert l’action séquentielle de trois enzymes, nommées respectivement E1, E2 et E3, qui conduisent à l’addition covalente de molécules d’ubiquitine sur des protéines spécifiques de substrats. Dans cette voie interviennent également des enzymes de désubiquitinylation (ubiquitine hydrolases) qui permettent de recycler des monomères d’ubiquitine indispensables à l’adressage de protéines cellulaires vers la dégradation par le protéasome. Une altération de la voie ubiquitine-protéasome peut conduire à une dégénérescence de la voie dopaminergique nigro-striatale. Ainsi, la mutation Ile93Met du gène codant pour l’ubiquitine hydrolase UCH-L1 rend compte d’un syndrome parkinsonien transmis selon le mode autosomique dominant dans une famille allemande. De plus, une grande variété de réarrangements d’exons et de mutations ponctuelles du gène codant pour la E3 ubiquitine ligase parkine est associée à une maladie de Parkinson autosomique récessive dans des populations de diverses origines ethniques.
List of tables
Tableau I
Locus impliqués dans les formes familiales monogéniques de maladie de Parkinson.