Abstracts
Résumé
Objectif Le cannabis est la drogue la plus consommée au sein de la population générale, mais sa prévalence d’usage reste plus élevée chez les personnes souffrant de troubles mentaux graves. De plus, les données actuelles démontrent les effets délétères du cannabis sur la symptomatologie de ces maladies. L’étude transversale ci-présente vise donc à évaluer l’impact de la consommation du cannabis sur la symptomatologie psychiatrique des personnes avec un trouble mental grave en contrôlant l’effet des variables confondantes de l’âge, du sexe ainsi que de la consommation concomitante d’alcool ou de stimulants.
Méthode Des analyses secondaires ont été effectuées sur les données de 72 participants provenant d’une étude antérieure. Leurs consommations de cannabis, d’alcool et de stimulants ont respectivement été mesurées à l’aide du Cannabis Use Problems Identification Test (CUPIT), du Alcohol Use Disorders Identification Test (AUDIT) et de la question sur la fréquence de consommation du Structured Clinical Interview for DSM-5 – Clinician Version pour les troubles liés à l’usage des stimulants (SCID-5-CV-TLUS). En lien avec la symptomatologie psychiatrique, celle-ci a été mesurée à l’aide du modèle à 5 sous-échelles du Positive and Negative Syndrome Scale (PANSS).
Résultats Différents modèles linéaires explicatifs des symptômes du PANSS ont été réalisés à l’aide d’une combinaison de variables indépendantes, soit l’âge, le sexe, le CUPIT, l’AUDIT et la question sur la fréquence de consommation du SCID-5-CV-TLUS. Le modèle explicatif des symptômes d’excitation est statistiquement significatif (F = 4,629, p = 0,001) et il permet de prédire 20,4 % de la variance de ces symptômes (R2ajusté = 0,204). Ici, le CUPIT est la variable qui influence le plus le modèle (ß = 0,381 ; p < 0,001). Le modèle explicatif des symptômes positifs est également statistiquement significatif (F = 3,631, p = 0,006) et il permet de prédire 15,6 % de la variance de ces symptômes (R2ajusté = 0,156). Or, le CUPIT n’influencerait pas de manière statistiquement significative ce modèle (ß = 0,125 ; p = 0,272), mais la question sur la fréquence de consommation du SCID-5-CV-TLUS l’influencerait (ß = 0,399 ; p = 0,001). De plus, la question sur la fréquence de consommation du SCID-5-CV-TLUS influence également le modèle explicatif des symptômes d’excitation (ß = 0,273 ; p = 0,022).
Conclusion Bien que d’autres études, idéalement longitudinales, soient nécessaires pour confirmer l’impact péjoratif du cannabis sur les symptômes d’excitation, l’étude ci-présente réitère l’importance de dépister et de prendre en charge les habitudes de consommation de drogues, particulièrement le cannabis, chez les personnes atteintes de troubles mentaux graves.
Mots-clés :
- cannabis,
- troubles mentaux graves,
- schizophrénie,
- trouble bipolaire,
- dépression
Abstract
Objective Cannabis is the most commonly used drug in the general population, but its prevalence of use remains higher among people suffering from severe mental disorders. Nevertheless, current cannabis research showed it to be deleterious on psychiatric symptoms, especially among patients with severe mental disorders. This present cross-sectional study aims to evaluate the impact of cannabis consumption on the psychiatric symptomatology of people with a serious mental disorder by controlling for the confounding variables of age, sex and concomitant alcohol or stimulant consumption.
Method Secondary analyses were performed on data from 72 participants from a previous study. Their use of cannabis, alcohol and stimulants was measured using the Cannabis Use Problems Identification Test (CUPIT), the Alcohol Use Disorders Identification Test (AUDIT) and the frequency of use question from the Structured Clinical Interview for DSM-5–Clinician Version for Stimulant Use Disorders (SCID-5-CV-TLUS), respectively. Their psychiatric symptoms were measured using the five subscale model of the Positive and Negative Syndrome Scale (PANSS).
Results Different linear explanatory models of PANSS symptoms were carried out using a combination of independent variables, i.e. age, sex, CUPIT, AUDIT and the question on consumption frequency of the SCID-5–CV-TLUS. The explanatory model of excitement symptoms is statistically significant (F = 4.629, p = 0.001) and it makes it possible to predict 20.4% of the variance of these symptoms (adjusted R2 = 0.204). In this model, CUPIT is the variable that most influences the model (ß = 0.381; p < 0.001). The explanatory model for positive symptoms is also statistically significant (F = 3.631, p = 0.006) and that makes it possible to predict 15.6% of the variance in these symptoms (adjusted R2 = 0.156). However, the CUPIT would not influence this model in a statistically significant way (ß = 0.125; p = 0.272), but the question on the frequency of consumption of the SCID-5-CV-TLUS would influence it (ß = 0.399; p = 0.001). In addition, the question on the frequency of consumption of the SCID-5-CV-TLUS also influences the explanatory model of excitement symptoms (ß = 0.273; p = 0.022).
Conclusion Although further studies, ideally longitudinal, are needed to confirm the deleterious effect of cannabis on excitement symptoms, the present study reiterates the importance of screening and managing consumption habits of drugs, particularly cannabis, in people with serious mental disorders.
Keywords:
- cannabis,
- severe mental disorders,
- schizophrenia,
- bipolar disorder,
- depression
Article body
Introduction
En 1873, les Soeurs de la Providence fondent l’Hôpital Saint-Jean-de-Dieu, qui sera le premier asile pour les personnes ayant des troubles mentaux (Hôpital Louis-Hippolyte-Lafontaine, 1991). Plus tard, l’Hôpital Saint-Jean-de-Dieu changera de nom pour l’Hôpital Louis-Hippolyte-Lafontaine en 1976, puis pour l’Institut universitaire en santé mentale de Montréal (IUSMM) en 2011 (Centre de recherche de l’Institut universitaire en santé mentale de Montréal, s. d. ; Hôpital Louis-Hippolyte-Lafontaine, 1991). Aujourd’hui, l’IUSMM est chef de file québécois en santé mentale et contribue significativement à l’avancement des connaissances et des pratiques, particulièrement en lien avec le cannabis (Bourque et coll., 2013 ; CIUSSS de l’Est-de-l’Île-de-Montréal, 2024 ; Desfossés et coll., 2012 ; Potvin et coll., 2004, 2013 ; Stip, 2014 ; Tatar et coll., 2023 ; Zhornitsky et coll., 2011, 2012).
D’après l’Organisation mondiale de la Santé, le cannabis est la drogue la plus consommée avec une prévalence d’usage de 4 % de la population mondiale (United Nations Office on Drugs and Crime, 2023). Au Canada, la prévalence de consommation du cannabis est de 26 % dans la population générale, tandis que la prévalence du trouble lié à l’usage du cannabis (TLUC) est de 4,7 % (Rotermann, 2023 ; Santé Canada et Statistique Canada, 2024 ; Tourjman et coll., 2023). Statistique Canada rapporte également une recrudescence de la consommation du cannabis chez les Canadiens âgés de 15 ans et plus passant de 12,3 % en 2015 à 22,4 % en 2021, ce qui pourrait être associé à une acceptabilité sociale croissante du cannabis ainsi qu’à une diminution du risque perçu associé à sa consommation vu sa légalisation en 2018 (Gouron et coll., 2020 ; Santé Canada et Statistique Canada, 2024 ; Statistique Canada, 2023). Cela étant dit, la décriminalisation du cannabis a également permis aux consommateurs d’être davantage disposés à rapporter leurs habitudes de consommation, permettant aux instances gouvernementales de brosser un portrait plus fidèle de la prévalence d’usage du cannabis dans le pays (Rotermann, 2019). Parallèlement, une revue systématique récente associe la légalisation du cannabis à une augmentation de l’utilisation des services de santé, particulièrement du nombre d’admissions à l’hôpital suivant une consommation du cannabis, ainsi que des crimes violents (Athanassiou et coll., 2023). Au Québec, la légalisation du cannabis est liée à une augmentation de 3 % des cas d’un premier épisode psychotique après une consommation du cannabis depuis sa légalisation (L’Heureux et coll., 2024).
Néanmoins, les individus souffrant d’un trouble mental grave (TMG) sont affectés disproportionnellement par le cannabis, comparativement au reste de la population (Green et coll., 2005 ; Hasan et coll., 2020 ; Hasin et Walsh, 2020 ; Hunt et coll., 2020 ; Lev-Ran et coll., 2013b ; Myles et coll., 2016 ; Pinto et coll., 2019 ; Tourjman et coll., 2023). Dans cet article, l’expression « trouble mental grave » réfère au spectre de la schizophrénie, à la maladie bipolaire et à la dépression, telle qu’elle est communément définie dans la littérature (Sandstrom et coll., 2019 ; Satre et coll., 2018 ; Stubbs et coll., 2016). Ainsi, la consommation du cannabis est plus prévalente chez les personnes souffrant d’un TMG (Lev-Ran et coll., 2013b). Chez les personnes souffrant d’un trouble bipolaire, la prévalence d’usage du cannabis s’élève à 30 %, tandis que chez celles atteintes de schizophrénie ou d’autres troubles apparentés, elle varie entre 31 et 39 % aux premiers épisodes psychotiques (Hasan et coll., 2020 ; Myles et coll., 2016 ; Pinto et coll., 2019). La prévalence du TLUC est également revue à la hausse chez les personnes souffrant d’un TMG (Lev-Ran et coll., 2013b ; Rotermann, 2023 ; Tourjman et coll., 2023). En effet, celle-ci varie entre 9,8 à 13,9 % chez les personnes souffrant de dépression, entre 14 à 25 % chez celles souffrant de troubles bipolaires et entre 12,2 à 38,5 % chez celles ayant une schizophrénie (Hasan et coll., 2020 ; Hunt et coll., 2020 ; Pinto et coll., 2019). Il conviendrait donc de se pencher sur l’effet du cannabis en trouble mental grave.
Les données actuelles associent le cannabis à une aggravation de la symptomatologie psychiatrique chez les individus souffrant de TMG, ce qui se répercute sur leur qualité de vie et leur fonctionnement global (Agrawal et coll., 2011 ; Argote et coll., 2022 ; Bahorik et coll., 2013 ; Beaudoin et coll., 2023 ; Botsford et coll., 2020 ; Feingold et coll., 2017 ; Hasan et coll., 2020 ; Hindley et coll., 2020 ; Maggu et coll., 2023 ; Myles et coll., 2016 ; Patel et coll., 2020 ; Pinto et coll., 2019 ; Rault et coll., 2022 ; Schoeler et coll., 2016 ; Sorkhou et coll., 2022 ; Tourjman et coll., 2023). Dans les troubles bipolaires, la consommation du cannabis exacerbe la fréquence et la sévérité des épisodes unipolaires, soit maniaques ou dépressifs, ainsi que des épisodes mixtes (Agrawal et coll., 2011 ; Maggu et coll., 2023 ; Tourjman et coll., 2023). L’usage du cannabis a donc un impact néfaste sur le fonctionnement global des personnes souffrant d’un trouble bipolaire (Bahorik et coll., 2013 ; Tourjman et coll., 2023). De plus, les personnes souffrant d’un trouble bipolaire et d’un TLUC en concomitance sont 2 fois plus à risque d’invalidité que celles sans TLUC et elles ont un plus mauvais pronostic (Agrawal et coll., 2011 ; Maggu et coll., 2023). Dans la dépression, le cannabis aggrave la symptomatologie dépressive, notamment en lien avec l’anhédonie et l’agitation psychomotrice, et augmente, du fait même, la sévérité de la maladie (Bahorik et coll., 2013 ; Botsford et coll., 2020 ; Feingold et coll., 2017 ; Tourjman et coll., 2023). De plus, autant la consommation du cannabis que le TLUC sont associés à une détérioration du fonctionnement global chez les personnes souffrant de troubles dépressifs (Bahorik et coll., 2013 ; Botsford et coll., 2020 ; Tourjman et coll., 2023). Et, dans la schizophrénie et les troubles apparentés, le cannabis aggrave les symptômes positifs et négatifs (Argote et coll., 2022 ; Desfossés et coll., 2010 ; Hasan et coll., 2020 ; Rault et coll., 2022 ; Schoeler et coll., 2016). Ce faisant, le cannabis double leurs risques de rechute et contribue à des taux d’hospitalisation plus élevés chez cette patientèle (Hasan et coll., 2020 ; Schoeler et coll., 2016). Par ailleurs, bien que la littérature sur l’effet distinct des principales composantes psychoactives du cannabis en maladie bipolaire et en dépression soit limitée ou de faible qualité, le tétrahydrocannabinol (THC) est associé à une détérioration des symptômes positifs et négatifs en schizophrénie, tandis que le cannabidiol (CBD) est associé à des scores diminués au Positive and Negative Syndrome Scale (PANSS) (Ahmed et coll., 2021 ; Oberbarnscheidt et Miller, 2020 ; Sideli et coll., 2020).
Cependant, bien que les données actuelles soutiennent que le cannabis a un impact péjoratif sur la symptomatologie psychiatrique des personnes souffrant de TMG, elles ne prennent pas en considération d’autres facteurs indépendants et qui agissent simultanément sur les symptômes. De nombreuses études ne contrôlent pas l’effet des variables confondantes pertinentes comme l’âge, le sexe et la consommation concomitante d’alcool ou de stimulants (Agrawal et coll., 2011 ; Hasin et Walsh, 2020). Or, Sexton et coll. démontrent une corrélation inversement proportionnelle entre l’âge et les effets cognitifs, psychologiques et physiologiques induits par le cannabis (Sexton et coll., 2019). Puis, le sexe féminin est associé à davantage d’effets subjectifs, physiologiques et cognitifs liés à la consommation du cannabis, à la différence du sexe masculin (Aghaei et coll., 2023 ; Arkell et coll., 2022 ; Bassir Nia et coll., 2022 ; Cuttler et coll., 2016 ; Halladay et coll., 2019 ; Matheson et coll., 2020). En effet, une étude canadienne démontre que, chez les consommateurs réguliers ou occasionnels du cannabis, les femmes rapportent des niveaux de détresses psychologiques plus élevés, comparativement aux hommes (Halladay et coll., 2019). En lien avec la consommation d’alcool, Trull et coll. démontrent que le cannabis et l’alcool sont associés indépendamment à une augmentation de l’impulsivité chez les personnes souffrant d’un trouble de personnalité limite ou d’un trouble dépressif (Trull et coll., 2016). Et, en lien avec les stimulants, Kalk et coll. démontrent que les patients ont 3 fois plus de risques d’être violents s’ils ont consommé du cannabis et des stimulants préalablement à leur admission dans les services de psychiatrie (Kalk et coll., 2022). Puisque les variables de l’âge, du sexe et de la consommation concomitante d’alcool ou de stimulants exercent possiblement un effet additif au cannabis sur la symptomatologie des TMG, il devient donc important de les prendre en compte. Puis, de nombreuses études priorisent une approche dichotomique pour répondre à la question en comparant soit les consommateurs du cannabis aux non-consommateurs, soit les personnes ayant un TLUC à ceux sans TLUC (Lev-Ran et coll., 2013a ; Onaemo et coll., 2021 ; Rault et coll., 2022 ; Tourjman et coll., 2023). Bien que cette approche permette de simplifier les analyses statistiques, la dichotomisation de variables contribue à la perte d’informations cruciales à l’interprétation de la relation entre les variables d’intérêts (Altman et Royston, 2006 ; Chen et coll., 2007 ; Kuss, 2013). L’approche dichotomique ne permet donc pas la détection d’une relation dose-effet entre la consommation du cannabis et la symptomatologie psychiatrique des personnes souffrant de TMG (Lev-Ran et coll., 2013a ; Onaemo et coll., 2021 ; Rault et coll., 2022 ; Tourjman et coll., 2023). Enfin, à notre connaissance, il n’existe aucune étude qui évalue l’impact du cannabis sur la symptomatologie d’un groupe d’individus en incluant divers TMG et en contrôlant l’effet des variables confondantes.
Ainsi, en effectuant des analyses secondaires de données préalablement recueillies dans une précédente étude, l’étude transversale ci-présente vise à évaluer l’impact du cannabis sur la symptomatologie psychiatrique des personnes souffrant de TMG en contrôlant l’effet des variables confondantes de l’âge, du sexe ainsi que de la consommation concomitante d’alcool et de stimulants (Beaudoin et coll., 2023). En se basant sur les données actuelles, l’hypothèse proposée est que la consommation du cannabis aggrave la symptomatologie psychiatrique des personnes souffrant de TMG de manière spécifique en contrôlant pour les effets de l’âge, du sexe et de la consommation concomitante d’alcool ou de stimulants.
Méthode
Conception de l’étude
Cette étude est une analyse transversale secondaire d’une étude antérieure réalisée à l’IUSMM et qui avait pour but d’évaluer la relation entre le cannabis et la violence chez les personnes ayant un TMG (Beaudoin et coll., 2023). Divers renseignements et données pertinentes à la consommation du cannabis ont été recueillis auprès de ces participants, incluant les données sociodémographiques des consommateurs (sexe, âge, scolarité, statut de salarié et état civil), les diagnostics psychiatriques ainsi que les habitudes de consommation du cannabis, d’alcool et de stimulants (Beaudoin et coll., 2023). Les dossiers médicaux et criminels des participants ont également été consultés pour compléter certaines informations recueillies (Beaudoin et coll., 2023).
Cette étude a été approuvée par le comité d’éthique du Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal. De plus, tous les participants ont donné leur consentement libre et éclairé par écrit.
Participants
Les données de 72 participants, colligées à la première évaluation, ont été analysées. Plusieurs participants de l’étude originale ont été exclus (n = 26) en raison d’un volume élevé de données manquantes dans les variables d’intérêt pour l’étude actuelle. La majorité des participants étaient hospitalisés (38,9 %), tandis que les autres participants étaient soit dans la communauté (34,7 %), soit à l’urgence psychiatrique (19,4 %). Il convient de préciser que nous n’avons pas réussi à identifier la provenance de 6,9 % des participants.
Les critères d’inclusion à l’étude étaient un âge de 18 ans et plus, un diagnostic de TMG, un usage du cannabis d’au moins une fois dans la vie et l’intégration à un programme de suivi dans la communauté. De plus, un congé médical rapproché était conditionnel aux recrutements des participants « hospitalisés » dans l’étude originale, sachant que les participants étaient rencontrés et suivis en externe. En lien avec les critères d’exclusion, les personnes sans domicile fixe n’étaient pas incluses dans l’étude pour des raisons logistiques liées aux suivis.
Mesures
Les diagnostics des participants ont été validés par des infirmières cliniciennes à l’aide du Structured Clinical Interview for DSM-5 – Clinician Version (SCID-5-CV), adapté du Structured Clinical Interview for DSM-5 (SCID-5) qui est l’instrument de diagnostic le plus utilisé dans la recherche clinique en psychiatrie et en santé mentale (Osório et coll., 2019). En lien avec ses propriétés psychométriques, le SCID-5-CV présente d’excellentes mesures de validité clinique et de fiabilité pour les TMG (Osório et coll., 2019).
Pour ce qui est de l’usage de substances, celui-ci a été mesuré à l’aide d’un questionnaire qui diffère selon la substance et l’accent a été mis sur les répercussions des comportements de consommation pour pallier les variabilités interindividuelles en lien avec la tolérance de ces substances (Zamarripa et coll., 2022). Ainsi, la consommation du cannabis a été évaluée à l’aide du score total du Cannabis Use Problems Identification Test (CUPIT), qui est un bref questionnaire d’autoévaluation des habitudes de consommation (Bashford et coll., 2010). À ce sujet, le CUPIT présente des mesures bonnes à excellentes de fiabilité de test-retest et de cohérence interne (Bashford et coll., 2010). Afin que tous les participants se voient attribuer un score, les non-consommateurs ont été codés comme ayant un score de 0, et le score total (variant de 3 à 82) a été ajusté afin que le score minimal soit de 0 (score ajusté = score original -3). Puis, la consommation de l’alcool a été évaluée à l’aide du score total du Alcohol Use Disorders Identification Test (AUDIT), qui est un questionnaire de 10 items visant à dépister le trouble lié à l’usage d’alcool et qui présente un score allant de 0 à 40 (Bradley et coll., 1998). L’AUDIT a également de bons indices de fiabilité (Allen et coll., 1997). Enfin, la consommation des stimulants a été évaluée à l’aide de la question sur la fréquence de consommation des participants au courant des 12 derniers mois dans le SCID-5-CV. En effet, le SCID-5-CV présente une excellente validité clinique ainsi qu’une fiabilité satisfaisante pour les troubles liés à l’usage de substances (Osório et coll., 2019). De plus, pour éviter toute confusion avec les diagnostics cliniques et par souci de concision, l’expression « SCID-5-CV-TLUS » sera utilisée pour faire référence à la question sur la fréquence de consommation des participants au courant des 12 derniers mois.
Enfin, les symptômes psychiatriques ont été mesurés à l’aide du PANSS, qui est un instrument conçu initialement pour évaluer la sévérité de la schizophrénie, mais couramment utilisé pour d’autres TMG (Anderson et coll., 2017). Ce questionnaire se compose de 30 items dont le pointage varie entre 1 (asymptomatique) et 7 (extrêmement symptomatique) (Anderson et coll., 2017). Dans le cadre de cette étude, le PANSS à 5 sous-échelles, qui se déclinent en symptômes positifs, négatifs, de désorganisation, d’excitation et de dépression, a été priorisé par rapport à la version originale à 3 sous-échelles, qui se décomposent en symptômes positifs, négatifs et généraux, puisque le modèle à 5 sous-échelles présente une meilleure perspective dimensionnelle des symptômes, comparativement au modèle à 3 sous-échelles (Wallwork et coll., 2012).
Analyses
Tout d’abord, la relation entre chacune des 5 sous-échelles du PANSS et l’usage du cannabis, de l’alcool et des stimulants, présentée respectivement sous forme de scores du CUPIT et de l’AUDIT ainsi que sous forme de fréquences de consommation des derniers 12 mois au SCID-5-CV-TLUS, a été évaluée. Les associations entre l’usage de chaque substance et chacune des sous-échelles du PANSS ont été mesurées à l’aide de corrélations de Pearson. Considérant que les données suivent une distribution normale selon l’asymétrie et l’aplatissement de la courbe, il a été déterminé que cette méthode statistique était appropriée. De plus, la relation entre les sous-échelles du PANSS et les variables sociodémographiques du sexe et de l’âge a également été étudiée au moyen de corrélations de Pearson compte tenu de l’influence rapportée de ces dernières sur la symptomatologie psychiatrique (Aghaei et coll., 2023 ; Arkell et coll., 2022 ; Bassir Nia et coll., 2022 ; Cuttler et coll., 2016 ; Halladay et coll., 2019 ; Matheson et coll., 2020 ; Sexton et coll., 2019).
Ensuite, un modèle de régression linéaire multiple a été construit pour chacune des 5 sous-échelles du PANSS pour expliquer leur variance à l’aide d’une combinaison des variables de l’âge, du sexe, des scores de CUPIT et de l’AUDIT ainsi que les fréquences de consommation au SCID-5-CV-TLUS (Yergeau et Poirier, 2021).
Enfin, toutes les analyses ont été effectuées sur SPSS (version 29) (IBM Corp, 2020). À ce sujet, le seuil de significativité pour les corrélations a été fixé à p < 0,05, tandis que celui associé aux régressions linéaires multiples a été ajusté à p < 0,01 suivant la correction de Bonferroni dans le but de minimiser les risques d’erreurs de type 1 (Armstrong, 2014).
Résultats
Description de l’échantillon
Dans le cadre de cette étude, l’échantillon de participants était principalement composé d’hommes caucasiens atteints d’un trouble psychotique, tel que présenté au Tableau 1. L’âge moyen des participants était de 38,3 ans.
Tableau 1
Caractéristiques sociodémographiques des participants (N = 72)
CUPIT : Cannabis Use Problems Identification Test ; AUDIT : Alcohol Use Disorders Identification Test ; SCID-5-CV-TLUS : Structured Clinical Interview for DSM-5 – Clinician Version pour les troubles liés à l’usage des stimulants.
ÉT, écart-type.
Corrélations
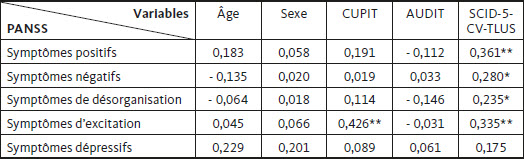
Les résultats des corrélations bivariées de Pearson entre les 5 sous-échelles du PANSS et les variables d’âge, du sexe, ainsi que de la consommation de cannabis, d’alcool et de stimulants, sont présentés au Tableau 2. On y observe une association positive et modérée entre la consommation du cannabis et les symptômes d’excitation (ρ = 0,426 ; p < 0,01) (Akoglu, 2018). La consommation de stimulants présente une association positive, mais plus faible avec les dimensions positives (ρ = 0,361 ; p < 0,01), négatives (ρ = 0,280 ; p < 0,05), de désorganisation (ρ = 0,235 ; p < 0,05) et d’excitation (ρ = 0,335 ; p < 0,01) du PANSS (Akoglu, 2018). Enfin, les résultats illustrent des associations faiblement positives, mais marginalement significatives, entre les symptômes dépressifs et les variables sociodémographiques de l’âge (ρ = 0,229 ; p = 0,053) ou du sexe (ρ = 0,201 ; p = 0,091) (Akoglu, 2018).
Tableau 2
Corrélations entre les cinq sous-échelles du PANSS et les variables d’âge, du sexe, ainsi que de la consommation de cannabis, d’alcool et de stimulants (N = 72)
CUPIT : Cannabis Use Problems Identification Test ; AUDIT : Alcohol Use Disorders Identification Test ; SCID-5-CV-TLUS : Structured Clinical Interview for DSM-5 – Clinician Version pour les troubles liés à l’usage des stimulants. Les coefficients avec le sexe (0 = homme, 1 = femme) représentent le résultat de corrélations point-bisériales.
* p < 0,05.
** p < 0,01.
Régressions linéaires multiples
Différents modèles linéaires explicatifs des symptômes du PANSS ont été réalisés à l’aide d’une combinaison de variables indépendantes, soit l’âge, le sexe, le CUPIT, l’AUDIT et le SCID-5-CV-TLUS.
En lien avec le modèle explicatif des symptômes positifs, celui-ci est statistiquement significatif (F = 3,631, p = 0,006) et montre une association entre l’ensemble des prédicteurs et les symptômes positifs, telle que présentée au Tableau 3. De plus, le modèle linéaire permet de prédire 15,6 % de la variance des symptômes positifs (R2ajusté = 0,156). Il convient également de souligner que le modèle de régression affiche un coefficient bêta standardisé (β) de 0,399 (p = 0,001) pour le SCID-5-CV-TLUS. Ainsi, la consommation des stimulants, représentée par SCID-5-CV-TLUS, est la variable qui influence le plus le modèle, en plus d’être la seule valeur significative à l’intérieur de celui-ci.
Tableau 3
Modèle de régression linéaire multiple des symptômes positifs prédits par l’âge, du sexe, ainsi que de la consommation de cannabis, d’alcool et de stimulants
CUPIT : Cannabis Use Problems Identification Test ; AUDIT : Alcohol Use Disorders Identification Test ; SCID-5-CV-TLUS : Structured Clinical Interview for DSM-5 – Clinician Version pour les troubles liés à l’usage des stimulants.
ß : coefficient bêta standardisé.
* p < 0,01.
En lien avec le modèle explicatif des symptômes d’excitation, ces résultats sont présentés au Tableau 4. Celui-ci est statistiquement significatif (F = 4,629, p = 0,001) et permet de prédire 20,4 % de la variance des symptômes d’excitation (R2ajusté = 0,204). Il convient également de souligner que le modèle de régression affiche des β de 0,381 (p < 0,001) pour le CUPIT et de 0,273 (p = 0,022) pour le SCID-5-CV-TLUS. Ainsi, la consommation du cannabis, représentée par CUPIT, est la variable qui influence le plus le modèle, suivi de la consommation des stimulants, sous SCID-5-CV-TLUS, de façon marginalement significative.
Tableau 4
Modèle de régression linéaire multiple des symptômes d’excitation prédits par l’âge, du sexe, ainsi que de la consommation de cannabis, d’alcool et de stimulants
CUPIT : Cannabis Use Problems Identification Test ; AUDIT : Alcohol Use Disorders Identification Test ; SCID-5-CV-TLUS : Structured Clinical Interview for DSM-5 – Clinician Version pour les troubles liés à l’usage des stimulants.
ß : coefficient bêta standardisé.
* p < 0,01.
Finalement, puisque les modèles explicatifs des symptômes négatifs (F = 1,394 ; p = 0,238), de désorganisation (F = 1,497 ; p = 0,203) et des symptômes dépressifs (F = 1,639 ; p = 0,162) présentent des tailles d’effet statistiquement négligeables (R2ajusté< 0,110), ils ne permettent pas de conclure qu’il existe une association entre ces dimensions symptomatiques et la combinaison de variables indépendantes énoncée plus haut.
Discussion
Le cannabis est la drogue la plus consommée à l’échelle mondiale, mais sa prévalence d’usage est encore plus élevée parmi les personnes souffrant de TMG (Green et coll., 2005 ; Hasan et coll., 2020 ; Hasin et Walsh, 2020 ; Hunt et coll., 2020 ; Lev-Ran et coll., 2013b ; Myles et coll., 2016 ; Pinto et coll., 2019 ; Tourjman et coll., 2023). Cette étude transversale démontre qu’une combinaison de variables indépendantes soit l’âge, le sexe ainsi que la consommation du cannabis, de l’alcool et de stimulants, expliquerait un cinquième de la variance des symptômes d’excitation, mais que la consommation du cannabis serait la variable avec le plus d’influence sur ces symptômes. La combinaison des variables de l’âge, du sexe ainsi que la consommation du cannabis, de l’alcool et de stimulants expliquerait 16 % de la variance des symptômes positifs et la consommation des stimulants serait la variable avec le plus d’influence sur les symptômes. De plus, la consommation des stimulants est également la seconde variable, après le cannabis, avec le plus d’influence sur les symptômes d’excitation.
En lien avec l’impact du cannabis sur la symptomatologie psychiatrique des personnes souffrant de TMG, les résultats suggèrent la présence d’une relation dose-effet entre sa consommation et les symptômes d’excitation, qui englobent l’excitation, l’hostilité, le manque de coopération et le mauvais contrôle pulsionnel (β = 0,381 ; p < 0,001) (voir Tableau 4). Cette trouvaille concorde avec la littérature actuelle, puisqu’une récente méta-analyse démontre de nombreuses associations entre le cannabis et les comportements agressifs ou violents parmi les personnes souffrant de TMG (Sorkhou et coll., 2022). Toutefois, cette étude ne démontre pas d’associations entre la consommation du cannabis et les autres dimensions symptomatiques, qui sont les symptômes positifs, négatifs, de désorganisation et de dépression (voir Tableau 2). Les données actuelles associent le cannabis à une détérioration des symptômes positifs et négatifs dans la schizophrénie et les troubles apparentés (Argote et coll., 2022 ; Hasan et coll., 2020 ; Rault et coll., 2022 ; Schoeler et coll., 2016). Or, ces études ne contrôlent pas pour d’autres variables pertinentes, comme les stimulants associés à une aggravation des symptômes positifs et qui pourraient entraîner une détérioration des symptômes négatifs chez les individus souffrant de TMG (Kirschner et coll., 2017 ; McKetin et coll., 2019). De plus, les résultats de cette étude sont spécifiques à une population de patients souffrant de TMG dont plus de la moitié a été rencontrée après un épisode de soins psychiatriques, impliquant que leurs symptômes positifs, négatifs et de désorganisation aient possiblement déjà fait l’objet d’un traitement médical. Enfin, en lien avec les symptômes de dépression, une étude canadienne démontre de plus fortes associations entre le TLUC et les symptômes dépressifs chez les femmes à partir de l’âge de 25 ans (Leadbeater et coll., 2019). Ainsi, la faible proportion de femmes dans l’échantillon pourrait expliquer l’absence d’associations entre la consommation du cannabis et ces symptômes.
En lien avec l’influence des variables confondantes sur la symptomatologie psychiatrique des personnes souffrant de TMG et qui consomment du cannabis, les résultats suggèrent un effet additif des stimulants sur les symptômes positifs (β = 0,399 ; p = 0,001) et, marginalement, sur les symptômes d’excitation (β = 0,273 ; p = 0,022) chez les personnes souffrant de TMG et qui consomment du cannabis (voir Tableaux 3 et 4). Ces résultats concordent avec la littérature actuelle sachant qu’une récente revue systématique et méta-analyse démontre que les stimulants triplent les risques de symptômes psychotiques et doublent les risques de comportements agressifs ou violents (McKetin et coll., 2019). Ces résultats pourraient également justifier la discordance des résultats concernant le cannabis sachant que de nombreuses études ne contrôlent pas l’effet des variables confondantes (Lev-Ran et coll., 2013a ; Onaemo et coll., 2021 ; Rault et coll., 2022 ; Tourjman et coll., 2023). Puis, bien que les résultats démontrent une association entre les symptômes négatifs et de désorganisation et la consommation des stimulants, les modèles linéaires explicatifs de ces symptômes ne sont pas statistiquement significatifs, ce qui ne permet pas de mettre en évidence le rôle des stimulants dans la variance de ces symptômes (voir Tableau 2). En effet, quelques études mentionnent une possible augmentation ou une stabilisation des symptômes négatifs, qui soient liées à la consommation des stimulants (Voce et coll., 2019). Une méta-analyse associe également le trouble lié à l’usage des stimulants (TLUS) à une détérioration de différents domaines cognitifs, dont l’attention et les fonctions exécutives, qui concordent avec la dimension de désorganisation du PANSS à 5 sous-échelles (Potvin et coll., 2018 ; Vandergaag et coll., 2006). Ainsi, cette discordance des modèles linéaires avec la littérature pourrait être attribuée à la modeste taille de l’échantillon de l’étude (voir Tableaux 1 et 2). En lien avec les symptômes dépressifs, cette étude ne permet pas de confirmer ou d’infirmer une association entre la consommation des stimulants et ces symptômes (voir Tableau 2). Or, une méta-analyse démontre que les stimulants augmentent de 1,6 fois le risque de dépression (McKetin et coll., 2019). Puisque les résultats rapportés par la méta-analyse ne sont pas ajustés pour les facteurs confondants, dont l’alcool fortement associé aux symptômes dépressifs, il faut considérer une potentielle surestimation de l’effet des stimulants sur les symptômes dépressifs, d’autant plus que les participants de cette étude présentaient des scores faibles à l’AUDIT (voir Tableau 1) (Bao et coll., 2013 ; Li et coll., 2020). Enfin, cette étude n’a pas observé d’associations significatives entre les variables sociodémographiques contrôlées, soit l’âge et le sexe, et les symptômes dépressifs chez les personnes souffrant de TMG et consommant du cannabis. Puisque les corrélations effectuées soutiennent marginalement une association entre l’âge et les symptômes dépressifs (ρ = 0,229 ; p = 0,053) ainsi qu’entre le sexe et les symptômes dépressifs (ρ = 0,201 ; p = 0,091), les résultats discordants des régressions pourraient être expliqués, encore une fois, par la modeste taille d’échantillon de l’étude ainsi que sa faible proportion de femmes (voir Tableaux 1 et 2) (Aghaei et coll., 2023 ; Bassir Nia et coll., 2022 ; Cuttler et coll., 2016 ; Halladay et coll., 2019 ; Leadbeater et coll., 2019 ; Matheson et coll., 2020 ; Sexton et coll., 2019).
En lien avec les limites de l’étude, il s’agit premièrement d’une analyse secondaire de données recueillies dans le cadre d’une étude antérieure ; les calculs de puissance et de taille d’échantillon ont donc été effectués en fonction de l’hypothèse originale (Beaudoin et coll., 2023). Par conséquent, plusieurs résultats se situaient à l’intérieur d’une zone marginale autour du seuil de significativité. Pour optimiser la puissance statistique de cette étude, des instruments de mesure sensibles, tels le CUPIT, l’AUDIT et le SCID-5-CV, ont été privilégiés et la sélection des variables indépendantes pertinentes à inclure dans les modèles, ici l’âge, le sexe, le CUPIT, l’AUDIT et le SCID-5-CV-TLUS, s’est faite avec parcimonie. Il convient tout de même de souligner que la composition faible en femmes de l’échantillon pourrait avoir influencé la significativité statistique des résultats portant sur l’influence du sexe sur la symptomatologie. Deuxièmement, cette étude utilise 3 instruments différents, soit le CUPIT, l’AUDIT et le SCID-5-CV pour mesurer la consommation respective du cannabis, de l’alcool et des stimulants, mais ils n’évaluent pas les comportements de consommation exactement de la même manière. Certes, le CUPIT, l’AUDIT et le SCID-5-CV sont des outils d’évaluation valides et possèdent de bonnes caractéristiques psychométriques pour l’évaluation de la consommation de leur substance respective (Bashford et coll., 2010 ; Bradley et coll., 1998 ; Osório et coll., 2019). Et, pour favoriser l’accord interjuge dans les différentes mesures, les infirmières responsables de la passation de ces questionnaires ont reçu chacune une formation spécifique. Troisièmement, les données recueillies dans l’étude originale n’incluent pas l’information sur la teneur du cannabis en THC et CBD, sur ses voies d’administration ou encore sur l’observance des participants à la médication, la prise d’antipsychotique ou de stabilisateurs de l’humeur, la durée de la maladie ainsi que la fréquence d’hospitalisations antérieures (Beaudoin et coll., 2023). Au Canada, 20 % des consommateurs du cannabis l’utilisent uniquement à des fins médicales et 51 % de ces individus consomment des produits à prédominance du CBD (Santé Canada et Statistique Canada, 2024). Or, le THC et le CBD ont été associés à des effets opposés, respectivement péjoratifs ou positifs sur le score au PANSS des personnes souffrant de TMG (Ahmed et coll., 2021 ; Oberbarnscheidt et Miller, 2020 ; Satre et coll., 2018). Puis, pour une même concentration en THC et CBD, les fumeurs du cannabis absorbent une plus grande quantité de composants actifs, comparativement aux consommateurs de produits oraux ou encore de timbres transdermiques, ce qui pourrait se répercuter de manière distincte sur l’effet de la substance (Zamarripa et coll., 2022). Enfin, les antécédents de tentative de suicide et d’hospitalisation en psychiatrie sont des marqueurs bien établis de la sévérité de la maladie en santé mentale, tandis que la durée de la maladie ainsi que la non-adhésion thérapeutique aux médicaments psychotropes ont respectivement été associées à une sévérité augmentée de la maladie et à une rechute des symptômes psychiatriques (Altamura et coll., 2015 ; Semahegn et coll., 2020 ; Zimmerman et coll., 2018). Par conséquent, il aurait été pertinent de mesurer ces variables sachant qu’elles ont un impact direct sur les scores au PANSS. Finalement, le devis de cette étude est transversal et ne permet pas de prouver, ou encore d’exclure, une relation causale entre la consommation du cannabis, les valeurs confondantes contrôlées et la symptomatologie psychiatrique.
Les prochains pas devraient donc être la réalisation d’un devis longitudinal sur l’impact du cannabis en TMG avec un plus grand nombre de participants ainsi qu’un équilibre des sexes dans l’échantillon. De plus, il faudrait assurer un contrôle plus rigoureux des variables confondantes mentionnées plus haut pour mettre en évidence l’effet spécifique du cannabis sur les scores au PANSS des personnes souffrant de TMG.
Conclusion
En résumé, cette étude visait à évaluer l’impact du cannabis sur la symptomatologie des personnes souffrant de TMG en contrôlant l’effet des variables confondantes pertinentes, soient l’âge, le sexe, la consommation concomitante d’alcool et des stimulants. Ainsi, les principaux résultats de l’étude suggèrent une relation entre la sévérité des comportements de consommation du cannabis et les symptômes d’excitation, mais ils ne parviennent pas à démontrer l’association entre le cannabis et les symptômes positifs, négatifs, de désorganisation ou de dépression. En lien avec les résultats secondaires, ils suggèrent plutôt un effet additif des stimulants sur la majorité des dimensions symptomatiques des TMG, particulièrement les symptômes positifs et, marginalement, d’excitation.
L’étude réitère donc l’importance d’évaluer soigneusement les comportements de consommation des personnes souffrant de TMG et de gérer en priorité la consommation de substances illicites chez cette patientèle. D’autres études utilisant un devis longitudinal ainsi qu’un plus grand échantillon de participants seront nécessaires pour évaluer la relation causale entre le cannabis et la symptomatologie psychiatrique en incluant des variables de contrôles pertinentes comme le sexe, l’âge, la consommation concomitante d’autres substances, l’observance à la psychopharmacothérapie ainsi que la sévérité de la maladie.
Appendices
Bibliographie
- Aghaei, A. M., Spillane, L. U., Pittman, B., Flynn, L. T., De Aquino, J. P., Nia, A. B. et Ranganathan, M. (2023). Sex Differences in the Acute Effects of Oral THC : A Randomized, Placebo-Controlled, Crossover Human Laboratory Study. medRxiv : the preprint server for health sciences. https://doi.org/10.1101/2023.11.29.23299193
- Agrawal, A., Nurnberger, J. I. et Lynskey, M. T. (2011). Cannabis involvement in individuals with bipolar disorder. Psychiatry Research, 185(3), 459-461. https://doi.org/10.1016/j.psychres.2010.07.007
- Ahmed, S., Roth, R. M., Stanciu, C. N. et Brunette, M. F. (2021). The Impact of THC and CBD in Schizophrenia : A Systematic Review. Frontiers in Psychiatry, 12. https://doi.org/10.3389/fpsyt.2021.694394
- Akoglu, H. (2018). User’s guide to correlation coefficients. Turkish Journal of Emergency Medicine, 18(3), 91-93. https://doi.org/10.1016/j.tjem.2018.08.001
- Allen, J. P., Litten, R. Z., Fertig, J. B. et Babor, T. (1997). A Review of Research on the Alcohol Use Disorders Identification Test (AUDIT). Alcoholism : Clinical and Experimental Research, 21(4), 613-619. https://doi.org/10.1111/j.1530-0277.1997.tb03811.x
- Altamura, A. C., Serati, M. et Buoli, M. (2015). Is duration of illness really influencing outcome in major psychoses ? Nordic Journal of Psychiatry, 69(6), 1685-1699. https://doi.org/10.3109/08039488.2014.990919
- Altman, D. G. et Royston, P. (2006). The cost of dichotomising continuous variables. BMJ, 332(7549), 1080.1. https://doi.org/10.1136/bmj.332.7549.1080
- Anderson, A. E., Mansolf, M., Reise, S. P., Savitz, A., Salvadore, G., Li, Q. et Bilder, R. M. (2017). Measuring pathology using the PANSS across diagnoses : Inconsistency of the positive symptom domain across schizophrenia, schizoaffective, and bipolar disorder. Psychiatry Research, 258, 207-216. https://doi.org/10.1016/j.psychres.2017.08.009
- Argote, M., Sescousse, G., Brunelin, J., Fakra, E., Nourredine, M. et Rolland, B. (2022). Association between formal thought disorder and cannabis use : a systematic review and meta-analysis. Schizophrenia, 8(1), 78. https://doi.org/10.1038/s41537-022-00286-0
- Arkell, T. R., Kevin, R. C., Vinckenbosch, F., Lintzeris, N., Theunissen, E., Ramaekers, J. G. et McGregor, I. S. (2022). Sex differences in acute cannabis effects revisited : Results from two randomized, controlled trials. Addiction Biology, 27(2). https://doi.org/10.1111/adb.13125
- Armstrong, R. A. (2014). When to use the Bonferroni correction. Ophthalmic and Physiological Optics, 34(5), 502-508. https://doi.org/10.1111/opo.12131
- Athanassiou, M., Dumais, A., Zouaoui, I. et Potvin, S. (2023). The clouded debate : A systematic review of comparative longitudinal studies examining the impact of recreational cannabis legalization on key public health outcomes. Frontiers in Psychiatry, 13. https://doi.org/10.3389/fpsyt.2022.1060656
- Bahorik, A. L., Newhill, C. E. et Eack, S. M. (2013). Characterizing the longitudinal patterns of substance use among individuals diagnosed with serious mental illness after psychiatric hospitalization. Addiction, 108(7), 1259-1269. https://doi.org/10.1111/add.12153
- Bao, Y., Qiu, Y., Yan, S., Jia, Z., Li, S., Lian, Z., Mu, Y. et Liu, Z. (2013). Pattern of Drug Use and Depressive Symptoms among Amphetamine Type Stimulants Users in Beijing and Guangdong Province, China. PLoS ONE, 8(4), e60544. https://doi.org/10.1371/journal.pone.0060544
- Bashford, J., Flett, R. et Copeland, J. (2010). The Cannabis Use Problems Identification Test (CUPIT) : development, reliability, concurrent and predictive validity among adolescents and adults. Addiction, 105(4), 615-625. https://doi.org/10.1111/j.1360-0443.2009.02859.x
- Bassir Nia, A., Orejarena, M. J., Flynn, L., Luddy, C., D’Souza, D. C., Skosnik, P. D., Pittman, B. et Ranganathan, M. (2022). Sex differences in the acute effects of intravenous (IV) delta-9 tetrahydrocannabinol (THC). Psychopharmacology, 239(5), 1621-1628. https://doi.org/10.1007/s00213-022-06135-3
- Beaudoin, M., Dellazizzo, L., Giguère, S., Guay, J.-P., Giguère, C.-E., Potvin, S. et Dumais, A. (2023). Is There a Dose–Response Relationship Between Cannabis Use and Violence ? A Longitudinal Study in Individuals with Severe Mental Disorders. Cannabis and Cannabinoid Research. https://doi.org/10.1089/can.2022.0038
- Botsford, S. L., Yang, S. et George, T. P. (2020). Cannabis and Cannabinoids in Mood and Anxiety Disorders : Impact on Illness Onset and Course, and Assessment of Therapeutic Potential. The American Journal on Addictions, 29(1), 9-26. https://doi.org/10.1111/ajad.12963
- Bourque, J., Mendrek, A., Durand, M., Lakis, N., Lipp, O., Stip, E., Lalonde, P., Grignon, S. et Potvin, S. (2013). Cannabis abuse is associated with better emotional memory in schizophrenia : A functional magnetic resonance imaging study. Psychiatry Research : Neuroimaging, 214(1), 24-32. https://doi.org/10.1016/j.pscychresns.2013.05.012
- Bradley, K. A., McDonell, M. B., Bush, K., Kivlahan, D. R., Diehr, P. et Fihn, S. D. (1998). The AUDIT Alcohol Consumption Questions : Reliability, Validity, and Responsiveness to Change in Older Male Primary Care Patients. Alcoholism : Clinical and Experimental Research, 22(8), 1842-1849. https://doi.org/10.1111/j.1530-0277.1998.tb03991.x
- Centre de recherche de l’Institut universitaire en santé mentale de Montréal. (s. d.). Historique. Institut universitaire en santé mentale de Montréal. Consulté 28 mars 2024, à l’adresse https://web.archive.org/web/20181209082041/ http://www.iusmm.ca:80/recherche/portrait/historique1.html
- Chen, H., Cohen, P. et Chen, S. (2007). Biased odds ratios from dichotomization of age. Statistics in Medicine, 26(18), 3487-3497. https://doi.org/10.1002/sim.2737
- CIUSSS de l’Est-de-l’Île-de-Montréal. (2024, janvier 3). IUSMM. Gouvernement du Québec.
- Cuttler, C., Mischley, L. K. et Sexton, M. (2016). Sex Differences in Cannabis Use and Effects : A Cross-Sectional Survey of Cannabis Users. Cannabis and Cannabinoid Research, 1(1), 166-175. https://doi.org/10.1089/can.2016.0010
- Desfossés, J., Stip, E., Bentaleb, L. A., Lipp, O., Chiasson, J.-P., Furtos, A., Venne, K., Kouassi, E. et Potvin, S. (2012). Plasma Endocannabinoid Alterations in Individuals with Substance Use Disorder are Dependent on the “Mirror Effect” of Schizophrenia. Frontiers in Psychiatry, 3. https://doi.org/10.3389/fpsyt.2012.00085
- Desfossés, J., Stip, E., Bentaleb, L. A. et Potvin, S. (2010). Endocannabinoids and Schizophrenia. Pharmaceuticals, 3(10), 3101-3126. https://doi.org/10.3390/ph3103101
- Feingold, D., Rehm, J. et Lev-Ran, S. (2017). Cannabis use and the course and outcome of major depressive disorder : A population based longitudinal study. Psychiatry Research, 251, 225-234. https://doi.org/10.1016/j.psychres.2017.02.027
- Gouron, D., Vignault, C., Quintin, J., Semaan, W. et Djahanbakhsh Asli, K. (2020). Impacts de la légalisation du cannabis récréatif sur la santé mentale : une recension des écrits. Santé mentale au Québec, 45(1), 201-220. https://doi.org/10.7202/1070247ar
- Green, B., Young, R. et Kavanagh, D. (2005). Cannabis use and misuse prevalence among people with psychosis. British Journal of Psychiatry, 187(4), 306-313. https://doi.org/10.1192/bjp.187.4.306
- Halladay, J. E., Boyle, M. H., Munn, C., Jack, S. M. et Georgiades, K. (2019). Sex Differences in the Association Between Cannabis Use and Suicidal Ideation and Attempts, Depression, and Psychological Distress Among Canadians. The Canadian Journal of Psychiatry, 64(5), 345-350. https://doi.org/10.1177/0706743718804542
- Hasan, A., von Keller, R., Friemel, C. M., Hall, W., Schneider, M., Koethe, D., Leweke, F. M., Strube, W. et Hoch, E. (2020). Cannabis use and psychosis : a review of reviews. European Archives of Psychiatry and Clinical Neuroscience, 270(4), 403-412. https://doi.org/10.1007/s00406-019-01068-z
- Hasin, D. et Walsh, C. (2020). Cannabis Use, Cannabis Use Disorder, and Comorbid Psychiatric Illness : A Narrative Review. Journal of Clinical Medicine, 10(1), 15. https://doi.org/10.3390/jcm10010015
- Hindley, G., Beck, K., Borgan, F., Ginestet, C. E., McCutcheon, R., Kleinloog, D., Ganesh, S., Radhakrishnan, R., D’Souza, D. C. et Howes, O. D. (2020). Psychiatric symptoms caused by cannabis constituents : a systematic review and meta-analysis. The Lancet Psychiatry, 7(4), 344-353. https://doi.org/10.1016/S2215-0366(20)30074-2
- Hôpital Louis-Hippolyte-Lafontaine. (1991). Bref historique de l’Hôpital Saint-Jean-de-Dieu. Bibliothèque du personnel. https://ciusss-estmtl.gouv.qc.ca/sites/ciusssemtl/files/media/document/historique%201976.pdf
- Hunt, G. E., Malhi, G. S., Lai, H. M. X. et Cleary, M. (2020). Prevalence of comorbid substance use in major depressive disorder in community and clinical settings, 1990-2019 : Systematic review and meta-analysis. Journal of Affective Disorders, 266, 288-304. https://doi.org/10.1016/j.jad.2020.01.141
- IBM Corp. (2020). IBM SPSS Statistics for Mac (Version 29.0). IBM Corp.
- Kalk, N. J., Robins, J. E., Ross, K. R., Pritchard, M., Lynskey, M. T., Curtis, V. A. et Morley, K. I. (2022). Substance use in psychiatric crisis : relationship to violence. Psychological Medicine, 52(9), 1691-1697. https://doi.org/10.1017/S0033291720003451
- Kirschner, M., Aleman, A. et Kaiser, S. (2017). Secondary negative symptoms–A review of mechanisms, assessment and treatment. Schizophrenia Research, 186, 29-38. https://doi.org/10.1016/j.schres.2016.05.003
- Kuss, O. (2013). The danger of dichotomizing continuous variables : A visualization. Teaching Statistics, 35(2), 78-79. https://doi.org/10.1111/test.12006
- Leadbeater, B. J., Ames, M. E. et Linden-Carmichael, A. N. (2019). Age-varying effects of cannabis use frequency and disorder on symptoms of psychosis, depression and anxiety in adolescents and adults. Addiction, 114(2), 278-293. https://doi.org/10.1111/add.14459
- Lev-Ran, S., Le Foll, B., McKenzie, K., George, T. P. et Rehm, J. (2013a). Bipolar disorder and co-occurring cannabis use disorders : Characteristics, co-morbidities and clinical correlates. Psychiatry Research, 209(3), 459-465. https://doi.org/10.1016/j.psychres.2012.12.014
- Lev-Ran, S., Le Foll, B., McKenzie, K., George, T. P. et Rehm, J. (2013b). Cannabis use and cannabis use disorders among individuals with mental illness. Comprehensive Psychiatry, 54(6), 589-598. https://doi.org/10.1016/j.comppsych.2012.12.021
- L’Heureux, S., Huot-Lavoie, M., Bergeron, A., Bergeron, C., Blouin, B.-P. et Roy, M.-A. (2024). Effect of Cannabis Legalization in Canada on the Incidence of Psychosis Consultations in Quebec City’s Psychiatric Emergency Services. The Canadian Journal of Psychiatry. https://doi.org/10.1177/07067437241232901
- Li, J., Wang, H., Li, M., Shen, Q., Li, X., Zhang, Y., Peng, J., Rong, X. et Peng, Y. (2020). Effect of alcohol use disorders and alcohol intake on the risk of subsequent depressive symptoms : a systematic review and meta-analysis of cohort studies. Addiction, 115(7), 1224-1243. https://doi.org/10.1111/add.14935
- Maggu, G., Choudhary, S., Jaishy, R., Chaudhury, S., Saldanha, D. et Borasi, M. (2023). Cannabis use and its relationship with bipolar disorder : A systematic review and meta-analysis. Industrial psychiatry journal, 32(2), 202-214. https://doi.org/10.4103/ipj.ipj_43_23
- Matheson, J., Sproule, B., Di Ciano, P., Fares, A., Le Foll, B., Mann, R. E. et Brands, B. (2020). Sex differences in the acute effects of smoked cannabis : evidence from a human laboratory study of young adults. Psychopharmacology, 237(2), 305-316. https://doi.org/10.1007/s00213-019-05369-y
- McKetin, R., Leung, J., Stockings, E., Huo, Y., Foulds, J., Lappin, J. M., Cumming, C., Arunogiri, S., Young, J. T., Sara, G., Farrell, M. et Degenhardt, L. (2019). Mental health outcomes associated with the use of amphetamines : A systematic review and meta-analysis. EClinicalMedicine, 16, 81-97. https://doi.org/10.1016/j.eclinm.2019.09.014
- Myles, H., Myles, N. et Large, M. (2016). Cannabis use in first episode psychosis : Meta-analysis of prevalence, and the time course of initiation and continued use. Australian & New Zealand Journal of Psychiatry, 50(3), 208-219. https://doi.org/10.1177/0004867415599846
- Oberbarnscheidt, T. et Miller, N. S. (2020). The Impact of Cannabidiol on Psychiatric and Medical Conditions. Journal of Clinical Medicine Research, 12(7), 393-403. https://doi.org/10.14740/jocmr4159
- Onaemo, V. N., Fawehinmi, T. O. et D’Arcy, C. (2021). Comorbid Cannabis Use Disorder with Major Depression and Generalized Anxiety Disorder : A Systematic Review with Meta-analysis of Nationally Representative Epidemiological Surveys. Journal of Affective Disorders, 281, 467-475. https://doi.org/10.1016/j.jad.2020.12.043
- Osório, F. L., Loureiro, S. R., Hallak, J. E. C., Machado-de-Sousa, J. P., Ushirohira, J. M., Baes, C. V. W., Apolinario, T. D., Donadon, M. F., Bolsoni, L. M., Guimarães, T., Fracon, V. S., Silva-Rodrigues, A. P. C., Pizeta, F. A., Souza, R. M., Sanches, R. F., dos Santos, R. G., Martin-Santos, R. et Crippa, J. A. S. (2019). Clinical validity and intrarater and test–retest reliability of the Structured Clinical Interview for DSM-5 – Clinician Version (SCID-5-CV). Psychiatry and Clinical Neurosciences, 73(12), 754-760. https://doi.org/10.1111/pcn.12931
- Patel, S. J., Khan, S., M, S. et Hamid, P. (2020). The Association Between Cannabis Use and Schizophrenia : Causative or Curative ? A Systematic Review. Cureus. https://doi.org/10.7759/cureus.9309
- Pinto, J. V., Medeiros, L. S., Santana da Rosa, G., Santana de Oliveira, C. E., Crippa, J. A. de S., Passos, I. C. et Kauer-Sant’Anna, M. (2019). The prevalence and clinical correlates of cannabis use and cannabis use disorder among patients with bipolar disorder : A systematic review with meta-analysis and meta-regression. Neuroscience & Biobehavioral Reviews, 101, 78-84. https://doi.org/10.1016/j.neubiorev.2019.04.004
- Potvin, S., Bourque, J., Durand, M., Lipp, O., Lalonde, P., Stip, E., Grignon, S. et Mendrek, A. (2013). The Neural Correlates of Mental Rotation Abilities in Cannabis-Abusing Patients with Schizophrenia : An fMRI Study. Schizophrenia Research and Treatment, 2013, 1-10. https://doi.org/10.1155/2013/543842
- Potvin, S., Pelletier, J., Grot, S., Hébert, C., Barr, A. M. et Lecomte, T. (2018). Cognitive deficits in individuals with methamphetamine use disorder : A meta-analysis. Addictive Behaviors, 80, 154-160. https://doi.org/10.1016/j.addbeh.2018.01.021
- Potvin, S., Stip, E. et Roy, J.-Y. (2004). Schizophrénie et cannabinoïdes. Drogues, santé et société, 2(2). https://doi.org/10.7202/008536ar
- Rault, O., Romeo, B., Butlen-Ducuing, F., Rari, E., Benyamina, A. et Martelli, C. (2022). Impact of cannabis use and its cessation on the dosage and the efficacy of antipsychotic drugs in in- and outpatients with schizophrenia taking medication : A systematic review and meta-analysis. Journal of Psychiatric Research, 156, 713-721. https://doi.org/10.1016/j.jpsychires.2022.11.012
- Rotermann, M. (2023). Using the Severity of Dependence Scale to examine cannabis consumers with impaired control in Canada. Health Reports, 34(6).
- Sandstrom, A., Sahiti, Q., Pavlova, B. et Uher, R. (2019). Offspring of parents with schizophrenia, bipolar disorder, and depression. Psychiatric Genetics, 29(5), 160-169. https://doi.org/10.1097/YPG.0000000000000240
- Santé Canada et Statistique Canada. (2024). Enquête canadienne sur le cannabis de 2023 : Sommaire. https://www.canada.ca/fr/sante-canada/services/drogues-medicaments/cannabis/recherches-donnees/enquete-canadienne-cannabis-2023-sommaire.html
- Satre, D. D., Bahorik, A., Zaman, T. et Ramo, D. (2018). Psychiatric Disorders and Comorbid Cannabis Use. The Journal of Clinical Psychiatry, 79(5). https://doi.org/10.4088/JCP.18ac12267
- Schoeler, T., Monk, A., Sami, M. B., Klamerus, E., Foglia, E., Brown, R., Camuri, G., Altamura, A. C., Murray, R. et Bhattacharyya, S. (2016). Continued versus discontinued cannabis use in patients with psychosis : a systematic review and meta-analysis. The Lancet Psychiatry, 3(3), 215-225. https://doi.org/10.1016/S2215-0366(15)00363-6
- Semahegn, A., Torpey, K., Manu, A., Assefa, N., Tesfaye, G. et Ankomah, A. (2020). Psychotropic medication non-adherence and its associated factors among patients with major psychiatric disorders : a systematic review and meta-analysis. Systematic Reviews, 9(1), 17. https://doi.org/10.1186/s13643-020-1274-3
- Sexton, M., Cuttler, C. et Mischley, L. K. (2019). A Survey of Cannabis Acute Effects and Withdrawal Symptoms : Differential Responses Across User Types and Age. The Journal of Alternative and Complementary Medicine, 25(3), 326-335. https://doi.org/10.1089/acm.2018.0319
- Sideli, L., Quigley, H., La Cascia, C. et Murray, R. M. (2020). Cannabis Use and the Risk for Psychosis and Affective Disorders. Journal of Dual Diagnosis, 16(1), 22-42. https://doi.org/10.1080/15504263.2019.1674991
- Sorkhou, M., Johnstone, S., Kivlichan, A. E., Castle, D. J. et George, T. P. (2022). Does cannabis use predict aggressive or violent behavior in psychiatric populations ? A systematic review. The American Journal of Drug and Alcohol Abuse, 48(6), 631-643. https://doi.org/10.1080/00952990.2022.2118060
- Statistique Canada. (2023). Research to Insights : Cannabis in Canada. https://www150.statcan.gc.ca/n1/en/pub/11-631-x/11-631-x2023006-eng.pdf?st=uK6wCbSi
- Stip, E. (2014). Interface santé mentale, société et toxicomanie – une thématique et deux illustrations : l’usage médical du cannabis et le hikikomori. Santé mentale au Québec, 39(2), 7. https://doi.org/10.7202/1027828ar
- Stubbs, B., Vancampfort, D., Veronese, N., Solmi, M., Gaughran, F., Manu, P., Rosenbaum, S., De Hert, M. et Fornaro, M. (2016). The prevalence and predictors of obstructive sleep apnea in major depressive disorder, bipolar disorder and schizophrenia : A systematic review and meta-analysis. Journal of Affective Disorders, 197, 259-267. https://doi.org/10.1016/j.jad.2016.02.060
- Tatar, O., Abdel-Baki, A., Dyachenko, A., Bakouni, H., Bahremand, A., Tibbo, P. G., Crockford, D., Roy, M.-A., Copeland, J., Fischer, B., Lecomte, T., Côté, J., Ouellet-Plamondon, C., L’Heureux, S., Villeneuve, M. et Jutras-Aswad, D. (2023). Evaluating preferences for online psychological interventions to decrease cannabis use in young adults with psychosis : An observational study. Psychiatry Research, 326, 115276. https://doi.org/10.1016/j.psychres.2023.115276
- Tourjman, S. V., Buck, G., Jutras-Aswad, D., Khullar, A., McInerney, S., Saraf, G., Pinto, J. V., Potvin, S., Poulin, M.-J., Frey, B. N., Kennedy, S. H., Lam, R. W., MacQueen, G., Milev, R., Parikh, S. V., Ravindran, A., McIntyre, R. S., Schaffer, A., Taylor, V. H., … Beaulieu, S. (2023). Canadian Network for Mood and Anxiety Treatments (CANMAT) Task Force Report : A Systematic Review and Recommendations of Cannabis use in Bipolar Disorder and Major Depressive Disorder. The Canadian Journal of Psychiatry, 68(5), 299-311. https://doi.org/10.1177/07067437221099769
- Trull, T. J., Wycoff, A. M., Lane, S. P., Carpenter, R. W. et Brown, W. C. (2016). Cannabis and alcohol use, affect and impulsivity in psychiatric out-patients’ daily lives. Addiction, 111(11), 2052-2059. https://doi.org/10.1111/add.13471
- United Nations Office on Drugs and Crime. (2023). World Drug Report 2023. https://www.unodc.org/unodc/en/data-and-analysis/world-drug-report-2023.html
- Vandergaag, M., Hoffman, T., Remijsen, M., Hijman, R., Dehaan, L., Vanmeiljel, B., Vanharten, P., Valmaggia, L., Dehert, M. et Cuijpers, A. (2006). The five-factor model of the Positive and Negative Syndrome Scale II : A ten-fold cross-validation of a revised model. Schizophrenia Research, 85(1-3), 280-287. https://doi.org/10.1016/j.schres.2006.03.021
- Voce, A., Calabria, B., Burns, R., Castle, D. et McKetin, R. (2019). A Systematic Review of the Symptom Profile and Course of Methamphetamine-Associated Psychosis. Substance Use & Misuse, 54(4), 549-559. https://doi.org/10.1080/10826084.2018.1521430
- Wallwork, R. S., Fortgang, R., Hashimoto, R., Weinberger, D. R. et Dickinson, D. (2012). Searching for a consensus five-factor model of the Positive and Negative Syndrome Scale for schizophrenia. Schizophrenia Research, 137(1-3), 246-250. https://doi.org/10.1016/j.schres.2012.01.031
- Yergeau, E. et Poirier, M. (2021). SPSS à l’UdeS. https://spss.espaceweb.usherbrooke.ca/
- Zamarripa, C. A., Vandrey, R. et Spindle, T. R. (2022). Factors that Impact the Pharmacokinetic and Pharmacodynamic Effects of Cannabis : a Review of Human Laboratory Studies. Current Addiction Reports, 9(4), 608-621. https://doi.org/10.1007/s40429-022-00429-4
- Zhornitsky, S., Rizkallah, É., Pampoulova, T., Chiasson, J.-P., Lipp, O., Stip, E. et Potvin, S. (2012). Sensation-seeking, social anhedonia, and impulsivity in substance use disorder patients with and without schizophrenia and in non-abusing schizophrenia patients. Psychiatry Research, 200(2-3), 237-241. https://doi.org/10.1016/j.psychres.2012.07.046
- Zhornitsky, S., Stip, E., Desfossés, J., Pampoulova, T., Rizkallah, É., Rompré, P.-P., Bentaleb, L. A., Lipp, O., Chiasson, J.-P., Gendron, A. et Potvin, S. (2011). Evolution of Substance use, Neurological and Psychiatric Symptoms in Schizophrenia and Substance use Disorder Patients : A 12-Week, Pilot, Case–Control Trial with Quetiapine. Frontiers in Psychiatry, 2. https://doi.org/10.3389/fpsyt.2011.00022
- Zimmerman, M., Morgan, T. A. et Stanton, K. (2018). The severity of psychiatric disorders. World Psychiatry, 17(3), 258-275. https://doi.org/10.1002/wps.20569
List of tables
Tableau 1
Caractéristiques sociodémographiques des participants (N = 72)
Tableau 2
Corrélations entre les cinq sous-échelles du PANSS et les variables d’âge, du sexe, ainsi que de la consommation de cannabis, d’alcool et de stimulants (N = 72)
CUPIT : Cannabis Use Problems Identification Test ; AUDIT : Alcohol Use Disorders Identification Test ; SCID-5-CV-TLUS : Structured Clinical Interview for DSM-5 – Clinician Version pour les troubles liés à l’usage des stimulants. Les coefficients avec le sexe (0 = homme, 1 = femme) représentent le résultat de corrélations point-bisériales.
* p < 0,05.
** p < 0,01.
Tableau 3
Modèle de régression linéaire multiple des symptômes positifs prédits par l’âge, du sexe, ainsi que de la consommation de cannabis, d’alcool et de stimulants
Tableau 4
Modèle de régression linéaire multiple des symptômes d’excitation prédits par l’âge, du sexe, ainsi que de la consommation de cannabis, d’alcool et de stimulants





 10.7202/1070247ar
10.7202/1070247ar