Abstracts
Résumé
L’adoption à grande échelle des cultures transgéniques depuis dix ans a soulevé de nombreuses questions quant aux impacts possibles de ces nouvelles lignées végétales sur les écosystèmes agricoles et naturels. Des questions ont été soulevées, en particulier, sur le devenir des transgènes dans le milieu et sur une possible « pollution » du patrimoine génétique des organismes vivants à l’échelle des écosystèmes. Après une énumération des impacts environnementaux associés aux végétaux transgéniques, cet article de synthèse dresse un aperçu des connaissances actuelles sur le devenir – ou la migration – des transgènes dans le milieu. Les phénomènes d’hybridation et d’introgression génique en direction d’espèces ou de lignées apparentées sont d’abord abordés, après quoi sont considérés les phénomènes de transfert horizontal des transgènes en direction d’organismes non apparentés. Un article complémentaire publié dans ce même numéro traite de l’impact environnemental des protéines recombinantes encodées par les transgènes (Michaud 2005).
Mots clés:
- Cultures transgéniques,
- hybridation interspécifique,
- hybridation intraspécifique,
- impact environnemental,
- introgression génique,
- transfert génique horizontal
Abstract
The large-scale adoption of transgenic crops over the last ten years has led several groups to question the possible impacts of these new plant lines on agricultural and natural ecosystems. In particular, questions have been raised about the impact of the transgenes on the environment, and about an eventual "pollution" of the overall genetic pool of living organisms at the ecosystem level. After an introduction on the possible environmental impacts of transgenic plants, this review summarizes the current knowledge on the fate – or migration – of transgenes in the environment. Hybridization and introgression processes involving transgenic crops and their close relatives are first considered. Transgene integration in non-related organisms by horizontal gene transfer is then considered. A companion review in this same issue addresses the environmental impacts of recombinant proteins encoded by the transgenes (Michaud 2005).
Keywords:
- Environmental impact,
- transgene introgression,
- horizontal gene transfer,
- interspecific hybridization,
- intraspecific hybridization,
- transgenic crops
Article body
Introduction
L’adoption soutenue des biotechnologies dans le domaine agroalimentaire a engendré depuis une vingtaine d’années une prise de conscience sans précédent dans la société sur l’impact tangible des pratiques agricoles sur notre environnement. Le déploiement récent des cultures transgéniques sur des millions d’hectares à travers le monde (James 2005) a soulevé, en particulier, de nombreuses questions sur les effets possibles de ces nouvelles lignées végétales sur les écosystèmes agricoles et naturels. L’impact des caractères nouvellement exprimés dans la plante a été questionné à plusieurs reprises, tout comme le devenir des transgènes introduits dans l’environnement qui seraient, selon certains, à l’origine d’une « pollution génétique » irréversible à l’échelle des écosystèmes (Greenpeace Canada 2004). Ces nouvelles lignées favorisent-elles une utilisation plus rationnelle des pesticides chimiques ou à l’inverse une utilisation accrue de ces composés de synthèse? Montrent-elles des effets tangibles sur les différents organismes du milieu? Ont-elles un impact sur la biodiversité au champ? Risquent-elles de compromettre l’efficacité des outils phytosanitaires implantés dans les systèmes de production biologique? La coexistence des systèmes de production transgéniques, conventionnels et biologiques est-elle une utopie? Si les impacts négatifs majeurs pressentis au départ n’ont pas été confirmés malgré la somme d’études consacrées au sujet et les superficies en cultures transgéniques toujours croissantes à l’échelle mondiale (James 2005), le débat actuel sur le déploiement des cultures transgéniques dans l’environnement aura eu le mérite, en revanche, de générer une accélération marquée des avancées scientifiques sur la compréhension des impacts agroenvironnementaux liés aux nouvelles pratiques agricoles, la définition d’approches analytiques adaptées aux questions complexes soulevées par l’adoption de ces nouvelles technologies et la mise au point de stratégies de déploiement éludant les impacts négatifs des cultures transgéniques sur l’environnement.
Plusieurs articles de synthèse ont été publiés ces dernières années sur l’impact environnemental des plantes transgéniques (Brunelle et al. 2004; Carter 2004; Conner et al. 2003; Dale et al. 2002; Dunfield et Germida 2004; Glaser et Matten 2003; Groot et Dicke 2002; O’Callaghan et al. 2005; Stewart et al. 2003; Wolfenbarger et Phifer 2000). La présente synthèse fait le point sur l’impact agroenvironnemental de ces cultures modifiées, abordant en particulier les éléments clés à considérer pour une analyse exhaustive des impacts associés aux transgènes et à leurs produits recombinants sur les pratiques agricoles et le milieu environnant. Le présent article aborde le devenir (ou la « migration ») des transgènes dans l’environnement, en lien avec la pérennité des pratiques agricoles actuelles, la qualité des semences et l’intégrité des génomes. L’impact des caractères recombinants nouvellement exprimés est considéré dans un article complémentaire (Michaud 2005).
Impact des cultures transgéniques sur l’environnement
Le processus de transgénèse implique l’ajout d’information au bagage génétique de l’organisme hôte et la traduction de cette information en produit recombinant souvent étranger, en général une protéine montrant une activité biologique spécifique. En théorie, l’ADN introduit et la protéine encodée par la nouvelle séquence nucléique peuvent ensuite « circuler » dans l’environnement et agir sur le milieu pour en influencer les composantes. Alors que le produit encodé par un transgène est généralement destiné à agir sur une cible précise, des effets parallèles ne peuvent être exclus, y compris chez la plante elle-même. La migration de transgènes en direction de génomes apparentés ou une interférence métabolique sur un organisme auxiliaire en milieu agricole sont des phénomènes possibles, tout comme une altération des caractéristiques intrinsèques de la plante modifiée pouvant montrer des effets éventuels aux niveaux trophiques supérieurs de l’écosystème.
Techniquement, l’impact d’une plante transgénique sur son milieu résultera de l’intégration stable du transgène au sein de son génome, de l’activité biologique de la protéine recombinante encodée par ce transgène, ou d’une combinaison des deux facteurs (Fig. 1).
Figure 1
Un aperçu des différents impacts environnementaux attribués aux cultures transgéniques.
Le transgène pourra montrer des effets (i) par sa présence nouvelle et soudaine dans le milieu (gain génétique) alors qu’il pourra être éventuellement intégré au génome d’autres organismes; et (ii) par son lieu d’insertion dans le génome de la plante hôte, qui pourra en altérer les caractères par un effet activateur ou répresseur sur l’expression de gènes situés à proximité ou physiquement disloqués par l’insertion de la nouvelle séquence (mutagénèse insertionnelle). La protéine recombinante pourra influencer le milieu (i) par son action (activité biologique) sur des organismes non ciblés a priori; ou (ii) par une modification des caractéristiques de la plante hôte causée par un effet d’interférence de la protéine recombinante sur ses fonctions métaboliques (effets pléiotropiques ou d’interférence). Les sections qui suivent discutent des données et concepts définis à propos du devenir des transgènes dans le milieu, considérant en particulier leur intégration possible au bagage génétique d’espèces apparentées ou plus éloignées par des phénomènes d’hybridation et de transfert génique horizontal.
Hybridations interculturales et contamination des semences
Peu importe l’information portée par le transgène, le processus de transformation génétique implique l’intégration stable de nouvelles séquences nucléiques au bagage génétique de l’organisme hôte. Présent dans toutes les cellules de l’organisme transgénique, le transgène est sujet, comme l’ensemble des séquences codantes endogènes, aux échanges génétiques impliquant la plante hôte et son milieu (Ellstrand 2003), qu’ils résultent de contaminations lors de la récolte et de la manutention des semences, d’échanges sexués en direction d’individus de même espèce ou d’espèces apparentées, ou de transferts géniques directs vers des organismes non apparentés par intégration physique des informations génétiques recombinantes.
Des phénomènes courants en milieu agricole sont la contamination postrécolte des semences et le transfert de matériel génétique par hybridation d’une culture agricole à l’autre (Beckie et al. 2003; Dorey 2000; Friesen et al. 2003). Ces échanges de matériel génétique, qui surviennent spontanément sur des sites agricoles adjacents ou même plus éloignés (Brunelle et al. 2004), ont soulevé des questions particulières dans le cas des cultures transgéniques. Des questions d’ordre agroéconomique ont été soulevées, en particulier, sur la coexistence des différents modes de production agricole et le maintien souhaité d’un haut degré de pureté des semences (Schiemann 2003). D’abord un problème de nature socioéconomique, la coexistence des systèmes de production biologique et des systèmes de production misant sur des variétés transgéniques n’en représente pas moins un exemple probant de la complexité des questions touchant l’effet des cultures transgéniques sur le milieu environnant. Alors que toute unité de production détenant une certification biologique doit assurer formellement l’absence de « composantes OGM » dans ses champs et les produits qu’elle distribue (CAAQ 2005; EU 1999), l’idée d’un taux de pureté génétique des semences atteignant 100 % (sans OGM) apparaît irréaliste dans les conditions actuelles de production et de manutention des denrées agricoles à travers le monde.
La coexistence des modes de production agricole
Que des semences dérivent des biotechnologies moléculaires ou d’approches plus conventionnelles, le maintien de leur qualité représente une assise importante de l’agriculture moderne. Le commerce international des semences, l’un des plus réglementés dans le domaine agroalimentaire, implique le respect de normes strictes quant à la pureté génétique, aux caractéristiques phénotypiques et à la qualité phytosanitaire des produits (Condon 2001). Malgré la sévérité des standards établis, les organismes chargés de contrôler la qualité des semences, se basant notamment sur les règles du Système de certification des semences de l’OCDE (OECD 2001), tolèrent un niveau de contamination de 1 à 2 % (Leask 2000), inhérent aux processus mêmes d’hybridation naturelle par le pollen, de dissémination des graines dans le milieu et de manutention des semences à petite, moyenne et grande échelles. Dès lors qu’une plante produit des structures reproductrices, le phénomène d’hybridation devient possible et un taux de pureté absolu ne peut être atteint en pratique (ECSCP 2001; Jollivet et Mounolou 2005) sans un confinement strict des cultures commandant l’interdiction des « lignées contaminantes » dans la région concernée.
L’idée de bannir la culture des variétés transgéniques dans certaines régions agricoles pour assurer la pureté des cultures biologiques ou conventionnelles apparaît toutefois peu envisageable, considérant l’importance des superficies consacrées à ces variétés et les contraintes qu’une telle mesure imposerait aux producteurs les utilisant ou désirant les adopter. L’Union Européenne (UE), malgré une réglementation sévère sur le déploiement des cultures transgéniques en milieu agricole (EU 2001), endossait le principe selon lequel aucune forme d’agriculture, qu’elle soit conventionnelle, organique ou basée sur les cultures génétiquement modifiées, ne devrait être exclue dans l’UE, statuant en outre que l’UE « n’a pas les moyens […] de limiter le choix d’un agriculteur sur son territoire » (Inf’OGM 2003). Un comité scientifique sur les végétaux mis sur pied par la Commission Européenne concluait pour sa part, quelque temps auparavant, que « considérant la recherche antérieure sur les mélanges de semences et les flux géniques, et la longue expérience acquise sur la production de semences commerciales, il est clair qu’un niveau zéro de semence transgénique non autorisée ne peut être obtenu en pratique. Les plantes cultivées au champ sont toujours soumises à du pollen et des semences de sources variées. » (ECSCP 2001). Dans ce contexte, l’adoption d’un cadre réglementaire assoupli pour l’agriculture biologique pourrait s’avérer nécessaire pour une coexistence possible des systèmes de production en présence. En pratique, l’adoption de normes plus flexibles pour la certification des systèmes et produits biologiques pourrait de surcroît diminuer de manière significative les pressions économiques et légales exercées sur les producteurs et distributeurs de produits certifiés biologiques (Eastham et Sweet 2002; Moeller 2001; Moyes et Dale 1999).
En Europe, l’adoption de mesures spécifiques pour la ségrégation des produits transgéniques, conventionnels et biologiques a été considérée comme un moyen de faciliter la coexistence des différents modes de production agricole (Schiemann 2003; Van de Wiel et al. 2003). La ségrégation des cultures et des produits agricoles pour le respect de standards de pureté n’est pas une pratique nouvelle en agriculture. Le développement et le maintien du degré d’authenticité des semences variétales certifiées pour la grande majorité des espèces agricoles, par exemple, reposent sur la mise en place d’un niveau d’isolement adéquat entre les lignées d’origine et les sites agricoles environnants, essentiel pour prévenir les influx de gènes à partir des productions commerciales de même espèce (Condon 2001). Sur le plan commercial, la ségrégation de produits agricoles destinés à des industries distinctes est également pratique courante. Le maïs-grain destiné à l’alimentation animale, par exemple, est souvent cultivé à proximité de lignées de maïs sucré destinées à la consommation humaine ou de variétés riches en amidon produites à des fins industrielles. De même, des variétés de canola destinées à l’alimentation humaine ou animale sont cultivées couramment dans des régions où sont également produites des variétés industrielles riches en acide érucique, impropres à la consommation.
Pour ces différentes productions, des mesures de ségrégation ont été mises en place pour la culture, la manutention, la transformation et la livraison parallèles des produits récoltés. Éprouvées à grande échelle sur une base routinière, ces mesures pourraient s’avérer fonctionnelles pour la ségrégation des produits transgéniques et non transgéniques, dans la mesure où pourront être établis des taux de contamination seuils répondant aux contraintes agroenvironnementales et économiques des intervenants impliqués. L’utilité potentielle des mesures de ségrégation déjà en place pour les produits du maïs a par exemple été documentée en Espagne, où des superficies de 25 000 ha sont consacrées annuellement aux variétés transgéniques. Bien que des taux de pureté absolus (sans OGM) n’aient pu être garantis, les mesures adoptées permettaient une ségrégation effective des produits, propre à permettre la coexistence éventuelle des modes de production en présence (Schiemann 2003).
Le confinement physique des transgènes
À l’échelle de la ferme, des mesures de confinement physique ont été envisagées pour réduire l’incidence des flux géniques. Considérant une compatibilité sexuelle et un synchronisme du processus de floraison chez les plantes en présence, la distance parcourue par le pollen à partir de la lignée source (transgénique) est un facteur clé à la base des stratégies de confinement proposées (Brunelle et al. 2004; Dale et al. 2002; Messeguer 2003; Pleasants et al. 2001). Plusieurs études ont été publiées sur le mouvement du pollen à partir de plants sources pour différentes espèces agricoles (Lutman 1999; Messeguer 2003; Rieger et al. 2002). Souvent basées sur des simulations mathématiques, ces études suggèrent dans l’ensemble que le taux de pollinisation en conditions naturelles diminue rapidement avec la distance parcourue par le pollen entre sa source et le site d’hybridation présumé.
En pratique, plusieurs mesures ont été proposées pour réduire l’incidence des flux polliniques dans l’environnement, incluant la culture en alternance de zones cultivées et non cultivées, la culture de lignées non modifiées à proximité des lignées modifiées, le maintien d’une distance suffisante entre les cultures modifiées et les espèces apparentées, le respect d’une distance minimale entre les rangs au moment de l’ensemencement, la pose de filets dans les champs pour capturer le pollen, la mise en place de haies brise-vent et l’aménagement de fossés autour des champs cultivés (Brunelle et al. 2004; Cuthbert et McVetty 2001). Selon plusieurs, la culture de lignées conventionnelles formant une « zone tampon » à proximité des lignées transgéniques s’avère particulièrement efficace pour réduire les risques de migration des transgènes en permettant l’interception d’une partie importante du pollen incident (Morris et al. 1994; Reboud 2003; Staniland et al. 2000).
Ces différentes approches physiques ne permettent toutefois pas un confinement strict des flux polliniques. Staniland et al. (2000) rapportaient par exemple qu’une zone tampon de 10 m en canola non transgénique implantée en bordure d’une plantation transgénique permettait de contenir environ 80 % du pollen dérivé. Une fraction non négligeable du pollen était retracée au-delà de cette zone, permettant en théorie des croisements à 30 m et plus des parcelles d’origine. D’une manière plus générale, des études ont fait état de la difficulté d’établir avec précision les distances seuils à partir desquelles les risques de pollinisation peuvent être considérés négligeables. La distance que pourra parcourir le pollen d’une plante sous une forme viable et féconde, parfois importante (Lu 2003; Rieger et al. 2002), sera déterminée par une multitude de facteurs liés à l’espèce, comme la longévité du pollen et son mode de dispersion, ou à des facteurs ambiants, comme les conditions microclimatiques et la prépondérance des insectes pollinisateurs (Luna et al. 2001; Squire et al. 1999).
L’efficacité mitigée des stratégies de confinement physique, associée aux coûts de mise en oeuvre des mesures de ségrégation définies pour chaque culture, représente toutefois un frein majeur à leur implantation. Si des seuils de contamination de 0,3 % pour la semence certifiée de canola ou de 1 % pour le maïs-grain apparaissent par exemple possibles en regard des procédures de ségrégation actuellement disponibles (Bock et al. 2002), l’adoption de telles mesures entraînera inévitablement une mise à niveau des pratiques agricoles et industrielles considérées et l’implantation d’un système de traçabilité adapté au suivi des transgènes (Van de Wiel et al. 2003). Au Canada, des mesures de confinement physique sont actuellement requises pour la culture des lignées transgéniques expérimentales non approuvées pour usage commercial (CFIA 2000a, b) et pour la production de semences certifiées nécessitant un haut degré de pureté (Government of Canada 2004). L’imposition de mesures de confinement pour la culture de plantes destinées à la production de médicaments (Daniell et al. 2001) apparaît également envisageable considérant la nature et la valeur commerciale des composés produits (Conner et al. 2003; Hoag 2003). En revanche, la prescription généralisée de mesures de ségrégation pour la production commerciale de cultures de base comme le maïs, le canola ou le soja pourrait s’avérer moins pertinente, considérant la faible valeur unitaire de ces produits et les données disponibles suggérant un taux d’incidence très limité des flux géniques par le pollen en conditions de champ (Rieger et al. 2002).
Le confinement moléculaire des transgènes
Dans ce contexte, un « confinement moléculaire » des transgènes au sein des lignées transgéniques pourrait représenter une approche utile pour prévenir à la source leur migration en direction des lignées conventionnelles (Daniell et al. 2001; Stewart et al. 2003). Différentes approches moléculaires sont actuellement considérées pour le confinement des transgènes, incluant la transformation chloroplastique, la stérilité du pollen et des graines, la cléistogamie, l’apomixie et l’excision dirigée des transgènes (Tableau 1).
Tableau 1
Quelques stratégies en développement pour le confinement moléculaire des transgènes intégrés aux cultures végétales transgéniques.
La transformation du génome chloroplastique représente, par exemple, une alternative aux procédés de transformation nucléaire pour assurer l’absence de transgènes dans le pollen des espèces végétales montrant une hérédité chloroplastique maternelle stricte (Daniell 2002). Des lignées transgéniques à stérilité mâle cultivées à proximité de lignées conventionnelles fertiles assurant une disponibilité en pollen sexuellement fonctionnel pourraient aussi se montrer utiles chez plusieurs espèces (Feil et al. 2003; Schernthaner et al. 2003). De même, des stratégies de confinement reposant sur la stérilité ou un développement compromis des semences pourraient susciter de l’intérêt sur le plan environnemental (Koivu et al. 2001; Odell et al. 1994; Tomes 1997), malgré les controverses entourant au départ ce type de technologie (Visser et al. 2001). L’emploi de promoteurs inductibles dirigeant l’expression de systèmes enzymatiques causant une désintégration du transgène dans les organes reproducteurs pourrait représenter, enfin, une voie future pour le développement de lignées transgéniques inaptes à engendrer la migration de transgènes par voie sexuée (Keenan et Stemmer 2002). En développement pour la plupart, ces différentes approches, avec chacune leurs avantages et leurs limitations (Daniell 2002; Haygood et al. 2004), représentent des pistes de solution au problème agroéconomique complexe des contaminations intraspécifiques par les lignées transgéniques.
Hybridations interspécifiques et fuite des transgènes
Ces approches pourraient aussi contribuer à prévenir la migration des transgènes en direction d’espèces ou de sous-espèces sauvages apparentées. Comme leurs contreparties conventionnelles, les variétés transgéniques ont le potentiel de s’hybrider avec des individus de même espèce ou d’espèces apparentées sexuellement compatibles, dans la mesure où de telles populations sont présentes dans le milieu environnant. Un cas célèbre à cet égard est celui de lignées de maïs transgénique qui, selon une étude publiée dans le périodique Nature, auraient engendré l’introgression de transgènes au patrimoine génétique de variétés locales cultivées au Mexique (Quist et Chapela 2001). Cette étude, vivement critiquée puis retirée de la circulation pour des questions d’ordre méthodologique (Anonyme 2002; Christou 2002; Kaplinski et al. 2002; Metz et Fütterer 2002), contribuait néanmoins à soulever l’importante question des flux (trans)géniques en milieu naturel et celle des impacts de tels mouvements sur les écosystèmes naturels et agricoles (Ortiz-Garcia et al. 2005).
Les flux géniques interspécifiques chez les végétaux représentent un phénomène naturel courant à la base des processus évolutifs assurant la diversité génétique, l’adaptation au milieu, la colonisation de nouveaux habitats, la dispersion des populations et la spéciation (Abbott 1992; Abbott et al. 2003; Ellstrand et Schierenbeck 2000). De manière plus spécifique, la majorité des espèces agricoles majeures ont le potentiel de s’hybrider avec des espèces ou sous-espèces sauvages apparentées dans l’une ou l’autre des régions où elles sont cultivées (Ellstrand et al. 1999). Sur le plan évolutif, cette observation est explicable par le fait que la majorité des plantes agricoles n’ont dérivé de leurs progéniteurs qu’il y a quelques milliers d’années, un horizon temporel trop court pour permettre un isolement reproductif étanche (Ellstrand et al. 1999). D’un point de vue agronomique, ces échanges courants entre espèces et sous-espèces apparentées soulignent par ailleurs l’importance de considérer la migration et l’introgression des transgènes dans les écosystèmes agricoles et naturels.
La compatibilité sexuelle interspécifique
Techniquement, l’intégration de transgènes par hybridation au génome d’une plante réceptrice dépend de nombreux facteurs liés, en premier lieu, à la compatibilité sexuelle entre la plante modifiée et les populations végétales avoisinantes. Le potentiel d’hybridation entre espèces apparentées, mis à profit depuis plusieurs décennies en laboratoire par l’emploi de techniques comme la culture d’embryons ou d’ovules pour introduire une gamme de caractères d’intérêt au génome des plantes cultivées (Harlan 1976), n’implique toutefois pas de facto un état de compatibilité sexuelle dans l’environnement. De tels échanges de matériel génétique entre espèces apparentées impliquent une multitude de facteurs liés aussi bien aux processus de reproduction et de développement embryonnaire qu’à un ensemble de conditions préalables comme la proximité dans l’espace des populations en cause, le synchronisme de leur processus de floraison, le mode de dispersion du pollen chez la plante source (modifiée), la présence de vecteurs de pollinisation et les conditions ambiantes sur le site considéré (Dale et al. 2002).
En dépit de ces contraintes, des hybridations interspécifiques surviennent à des taux mesurables chez certaines plantes cultivées à proximité d’espèces sauvages très apparentées. Le canola transgénique tolérant aux herbicides représente, à cet égard, un cas bien documenté. Proche parente d’espèces sauvages colonisant les zones cultivées (Chèvre et al. 2000), cette plante produit une quantité abondante de pollen capable de se déplacer sur des distances importantes par l’action du vent et des insectes pollinisateurs (Lavigne et al. 1998; Rieger et al. 2002; Squire et al. 2000). Ce mouvement du pollen, couplé à une dispersion des graines dans les champs au moment de la récolte et des premières étapes de manutention des graines (Gulden et al. 2003), crée un contexte favorable aux phénomènes d’hybridation dans les champs d’origine, les champs voisins et les zones proximales non cultivées (Chèvre et al. 1997; Lefol et al. 1996).
Plusieurs études ont rapporté, par exemple, la présence d’un transgène de tolérance aux herbicides dans le génome d’espèces proches du canola (Chèvre et al. 2000; Jorgensen et Andersen 1994; Mikkelsen et al. 1996; Pinder et al. 1999; Simpson et al. 1999; Squire et al. 2000; Warwick et al. 2003). En bref, ces travaux démontraient que des hybridations interspécifiques surviennent à des taux mesurables en milieu agricole entre le canola et des espèces proches comme la moutarde des oiseaux (Brassica rapa L.) ou la moutarde indienne (B. juncea L. (Czern.)). Des croisements avec des espèces plus éloignées comme le radis sauvage (Raphanus raphanistrum L.) ou la moutarde des champs (Sinapis arvensis L.) étaient aussi observés, mais à des taux beaucoup plus faibles.
La migration de transgènes en direction de lignées ou d’espèces sauvages apparentées, si elle s’avère courante en milieu agricole, n’implique cependant pas l’introgression de ces nouvelles séquences chez les hybrides dérivés, ni leur maintien à long terme dans le milieu. La dispersion des transgènes dans l’environnement est souvent perçue comme un processus en une étape par lequel le pollen d’une culture transgénique « contamine » les populations végétales avoisinantes pour provoquer l’intégration de nouveaux caractères montrant une incidence éventuellement négative à l’échelle de l’écosystème. Comme le processus d’hybridation, l’établissement et la propagation d’individus hybrides dans l’environnement sont toutefois soumis à des contraintes variées incluant le mode de propagation de l’hybride considéré, la fertilité du pollen et des ovules qu’il produit, son efficacité à produire des descendants, la viabilité et le nombre de ses graines ainsi que son efficacité à se propager en présence d’organismes compétiteurs, prédateurs ou pathogènes (Conner et al. 2003). En somme, l’introgression d’un nouveau caractère (recombinant) au sein d’une population végétale en milieu naturel ou agricole sera tributaire du potentiel d’implantation des hybrides dans le milieu et du taux de fixation du transgène au fil des générations, lui-même lié à l’espèce considérée et à l’utilité réelle du produit recombinant encodé par le transgène.
L’introgression des caractères recombinants
Selon les données actuelles, les risques d’introgression seraient au départ très faibles pour des espèces comme le soja, l’orge, le millet, le haricot, l’arachide ou la pomme de terre (Tableau 2), pour lesquelles aucune évidence d’introgression génique en direction de populations sauvages apparentées n’a été rapportée jusqu’ici malgré des évènements d’introgression parfois observés en direction opposée, de la plante sauvage vers l’espèce domestique (Concibido et al. 2003; Garcia et al. 1995; Stewart et al. 2003).
Tableau 2
Taux d’introgression génique en direction d’espèces sauvages apparentées pour quelques espèces agricoles cultivées à grande échelle (adapté de Stewart et al. 2003).
Des espèces comme le maïs, le riz et le coton, pour lesquels des évènements d’introgression génique ont été rapportés à faible fréquence (Ellstrand et al. 1999; Song et al. 2002, 2003), présenteraient également un risque limité pour la stabilité génétique du milieu, du moins dans les régions situées hors de leur aire d’origine (Doebley 1990; Stewart et al. 2003). À l’opposé, des évènements d’introgression vers des espèces apparentées ou des populations sauvages de même espèce surviennent plus fréquemment chez la luzerne, le canola, le blé, la canne à sucre, le tournesol et le sorgho (Arnaud et al. 2003; Bartsch et al. 1999; Halfhill et al. 2001, 2003; Hansen et al. 2001; Jenczewski et al. 1999; Linder et al. 1998; Morrison et al. 2002; Rieseberg et al. 1999a; Warwick et al. 2003; Whitton et al. 1997). Ces phénomènes, dont la fréquence demeurerait somme toute très faible en conditions naturelles (Scott et Wilkinson 1998), suggèrent néanmoins le potentiel des lignées transgéniques dérivées de ces espèces à engendrer une migration effective de transgènes dans l’environnement. Pour ces cultures, tout avantage sélectif conféré par le nouveau caractère recombinant pourrait à terme altérer la stabilité génétique du milieu ou l’efficacité des pratiques agricoles courantes, notamment dans les cas où les populations exprimant désormais le nouveau gène montreraient un potentiel de nuisance accru.
Une inquiétude récurrente formulée au sujet de la migration des transgènes dans l’environnement réfère au problème d’introgression de facteurs recombinants conférant un avantage sélectif à des populations déjà bien établies dans le milieu. L’introgression de transgènes conférant une résistance aux insectes ou une tolérance aux herbicides à large spectre pourrait, par exemple, conduire à un accroissement des populations d’espèces considérées nuisibles en favorisant leur taux de croissance, leur potentiel de multiplication ou leur propagation dans l’environnement (Ellstrand 2001). En milieu agricole, l’introgression d’un transgène de tolérance à un herbicide pourra par exemple s’avérer problématique en rendant plus difficile la lutte aux mauvaises herbes, alors que pourront apparaître au champ des hybrides tolérants à l’un ou plusieurs des herbicides contrés par l’expression des transgènes introduits (Beckie et al. 2003; Hall et al. 2000). Peu persistants en habitats naturels (Crawley et al. 1993, 2001) et sensibles aux herbicides couramment utilisés pour la répression des volontaires (Beckie et al. 2004), ces hybrides tolérants pourraient néanmoins montrer un impact négatif sur le plan agronomique en affectant par exemple le choix des herbicides ou des rotations de culture dans les années subséquentes, ou en compromettant l’adoption d’une pratique agricole en émergence comme le semis direct (Légère 2005; Warwick et al. 1999).
Considérant les diverses contraintes biologiques et environnementales associées à l’introgression génique (Conner et al. 2003), l’expérience acquise en amélioration génétique pour l’introgression souvent laborieuse de caractères agronomiques au génome des espèces cultivées (Stewart et al. 2003) et les taux d’hybridation et d’introgression très faibles en milieux naturels pour des espèces proches comme le canola et la moutarde des oiseaux (Scott et Wilkinson 1998), il est généralement admis que les hybridations impliquant des plantes cultivées et leurs cousines sauvages mèneront très rarement à une introgression durable des transgènes en milieu naturel. Par exemple, un consensus est établi à l’effet qu’un transgène de tolérance aux herbicides ne présente qu’un risque limité hors des systèmes agricoles parce que l’avantage sélectif conféré par le nouveau caractère est tributaire de l’application d’herbicides dans le milieu. De même, l’intégration d’un transgène pour la d-endotoxine du Bacillus thuringiensis (Bt), observée chez des hybrides dérivés d’un croisement entre le canola et la moutarde des oiseaux (Halfhill et al. 2002), mènera difficilement à l’introgression de ce transgène en milieu naturel, considérant la grande spécificité des toxines du Bt envers les insectes nuisibles ciblés au champ (Ferré et Van Rie 2002) et l’inutilité conséquente de ce biopesticide contre les ennemis herbivores du milieu environnant.
En revanche, de nouvelles lignées transgéniques exprimant des caractères de tolérance à des stress abiotiques comme la sécheresse, le froid ou la salinité (Wang et al. 2003) pourraient conférer aux plantes réceptrices un avantage tangible en conditions adverses, propice à une fixation effective du nouveau matériel génétique dans les populations dérivées. Dans cette perspective, les différentes technologies destinées au confinement moléculaire des transgènes (v. Tableau 1) pourraient contribuer à une diminution des risques d’introgression interspécifique pour les caractères recombinants en développement montrant un potentiel sélectif accru. Tel que proposé par Stewart et al. (2003), l’insertion dirigée des transgènes dans des régions du génome hôte peu sujettes à la recombinaison (Jiang et al. 2000; Nordborg et al. 2002; Remington et al. 2001; Rieseberg et al. 1999b) ou absentes du génome des espèces apparentées (Halfhill et al. 2002; Metz et al. 1997) pourrait aussi représenter une voie d’évitement du processus d’introgression, dans la mesure où des méthodes fiables pour l’insertion dirigée des transgènes chez la plante modifiée seront disponibles. Enfin, l’acquisition de données empiriques additionnelles sur l’incidence et les conséquences des phénomènes d’introgression dans l’environnement sera utile dans les années à venir pour obtenir une description fidèle des risques associés aux flux géniques interspécifiques dans l’environnement, tenant compte de l’espèce, du caractère recombinant et du milieu considérés.
Transferts géniques horizontaux
Une prise en compte au cas par cas sera aussi souhaitable pour l’étude des phénomènes de transfert génique horizontal qui pourraient survenir dans l’environnement à partir des cultures transgéniques. Le transfert génique horizontal est défini comme le transfert de matériel génétique d’un organisme donneur vers un organisme récepteur par voie non sexuée (Koonin et al. 2001). Considéré comme un moteur de l’évolution des organismes procaryotiques (Doolittle 1999; Ochman et al. 2000), ce type de transfert génétique aurait aussi contribué à modeler l’évolution des eucaryotes (De la Cruz et Davies 2000). Les données de séquençage génomique à grande échelle pour un nombre grandissant d’organismes révèlent peu à peu l’étendue des transferts horizontaux interspécifiques, intergénériques et interrègnes survenus au cours du temps, y compris chez les végétaux (Bevan et al. 2001). Un exemple classique de transfert génique horizontal est celui de l’interaction établie entre de nombreuses espèces végétales et la bactérie Agrobacterium tumefaciens, à la base même du développement de plusieurs cultures transgéniques (Gelvin 2003).
Comme l’hybridation sexuée, le transfert génique horizontal entre différents organismes du milieu a soulevé des questions particulières dans le cas des plantes transgéniques. Une idée répandue sur le sujet réfère aux impacts négatifs des transgènes sur l’environnement et la santé humaine suite à leur intégration éventuelle au bagage génétique d’espèces éloignées comme les bactéries du sol, de l’eau, de la flore intestinale humaine ou du rumen chez le bétail (Dröge et al. 1998; Goldstein et al. 2005; Nielsen et al. 2001). Les transgènes de tolérance aux antibiotiques insérés au génome des plantes modifiées pour la sélection des clones transgéniques en laboratoire rendront-ils inopérants les antibiotiques utilisés en médecine humaine ou vétérinaire après leur intégration au génome des micro-organismes normalement visés par ces composés? Les mêmes transgènes ou un transgène encodant un biopesticide comme une toxine du Bt donneront-ils à des bactéries du sol un avantage sélectif suffisant pour déstabiliser la microflore édaphique ou engendrer l’apparition de nouveaux agents pathogènes? Des échanges de transgènes entre individus non apparentés affecteront-ils négativement les rendements agronomiques ou la diversité biologique dans le milieu considéré?
La persistance des transgènes dans l’environnement
Si tous les transferts horizontaux sont possibles en théorie, leur taux d’incidence dans l’environnement serait toutefois négligeable au terme des différentes étapes préalables à l’expression éventuelle du transgène chez l’organisme récepteur (Dunfield et Germida 2004; Jonas et al. 2001; WHO 2000). Pour être intégré au génome d’une bactérie, un transgène doit d’abord être libéré de la plante transgénique et demeurer stable sous forme libre dans le sol, dans l’eau ou dans le système digestif de l’hôte. Les bactéries réceptrices doivent ensuite montrer un état de compétence essentiel à l’incorporation du transgène, puis intégrer la nouvelle séquence à l’ensemble de leur génome (Dunfield et Germida 2004; Lorenz et Wackernagel 1994; Nielsen et al. 1998). Enfin, l’expression du nouveau gène surviendra si le produit recombinant encodé n’est pas létal et si les séquences régulatrices incluses aux constructions génétiques pour l’étape de transgénèse sont compatibles avec la machinerie génétique de la bactérie. L’expression effective du transgène chez la bactérie hôte et ses descendants sera tributaire de facteurs variés comme la nature des séquences promotrices et amplificatrices intégrées aux constructions, l’identité des codons composant la séquence exprimée, la présence ou non d’introns dans le gène introduit et l’homologie de séquence qu’il partage avec l’ADN de l’hôte bactérien (de Vries et Wackernagel 1998; de Vries et al. 2001; Mercer et al. 2001; Tepfer et al. 2003).
Selon les données disponibles, la persistance des molécules d’ADN relâchées de tissus végétaux en décomposition est très variable d’un milieu à l’autre. Chez les animaux, les nucléases retrouvées en abondance dans le système digestif (McAllan 1980, 1982) causeraient une dégradation rapide des acides nucléiques ingérés, peu compatible avec leur intégration ultérieure au génome de micro-organismes compétents (Duggan et al. 2000; Einspanier et al. 2001). L’absence de transgènes détectables dans le tractus digestif (Chambers et al. 2001), les fèces (Harrison et al. 1996; Netherwood et al. 2004) ou les tissus (Chowdhury et al. 2003a, b; Jennings et al. 2003) d’animaux ou de sujets humains nourris de végétaux transgéniques suggère d’ailleurs une hydrolyse rapide de ces molécules, bien qu’incomplète sous certaines conditions (Chowdhury et al. 2003a, b; Martin-Orue et al. 2002; Mercer et al. 1999), au cours du processus de digestion alimentaire. En revanche, les molécules d’ADN pourraient montrer une certaine stabilité dans l’eau (Paul et al. 1989) et une fraction non négligeable des molécules d’ADN relâchées des tissus végétaux dans le sol ne serait pas hydrolysée rapidement par les nucléases microbiennes et persisterait, adsorbée aux particules argileuses, sur des périodes suffisamment longues pour permettre l’intégration de ces molécules au génome d’éventuelles bactéries compétentes (Gebhard et Smalla 1999; Lorenz et Wackernagel 1992; Widmer et al. 1996, 1997).
L’incidence des transferts (trans)géniques horizontaux
Plusieurs études ont été menées pour évaluer l’incidence des transferts horizontaux impliquant des molécules d’ADN recombinant dans le milieu édaphique (Bertolla et Simonet 1999; Gebhard et Smalla 1998, 1999; Nielsen et al. 1998; Paget et al. 1998; Schütler et al. 1995; Widmer et al. 1997). En bref, aucune de ces études n’a permis de démontrer l’incidence d’évènements de transformation génétique au sein des populations bactériennes isolées du sol, malgré la présence d’ADN libre à proximité. Une étude récente rapportait, par exemple, l’incidence nulle (non détectable) du transfert horizontal d’un transgène de résistance à l’ampicilline au génome des bactéries isolées d’un sol consacré à la culture commerciale de maïs transgénique portant ce transgène (Badosa et al. 2004). De même, aucun transfert horizontal en direction de génomes bactériens ciblés n’était détecté pour des échantillons de sols fertilisés pendant plusieurs années avec des résidus de matériel végétal transgénique (Andersen et al. 2001). Cette incidence très limitée du phénomène de transfert génique horizontal dans l’environnement serait expliquée en bonne partie par la rareté des bactéries compétentes aptes à intégrer efficacement l’ADN disponible (Dunfield et Germida 2004). L’incorporation de fragments d’ADN recombinant par des bactéries placées dans des conditions de laboratoire favorisant un état de compétence accru appuyait d’ailleurs l’idée d’une migration horizontale négligeable des transgènes en milieux naturels et agricoles (de Vries et Wackernagel 1998; Gebhard et Smalla 1999; Kay et al. 2002; Nielsen et van Elsas 2001; Nielsen et al. 2000; Tepfer et al. 2003), tout en soulevant des questions sur l’incidence possible du phénomène sous certaines conditions environnementales ou culturales.
Sur la base des données disponibles, il est généralement admis que le processus de transfert génique horizontal impliquant des végétaux, s’il s’avère significatif sur une échelle de temps très longue situant ces organismes dans une perspective évolutive (Bergthorsson et al. 2003), représente un phénomène marginal dans les contextes agroenvironnemental et alimentaire actuels (Goldstein et al. 2005; Thomson 2001). L’arrivée possible, dans les années à venir, de nouvelles générations de cultures transgéniques potentiellement favorisées en milieux naturels pourrait néanmoins justifier des efforts de recherche additionnels sur les impacts de ce phénomène dans les écosystèmes. Qu’il s’agisse de gènes de tolérance aux herbicides utiles aux plantes dans un contexte agricole, de gènes encodant des toxines du Bt actives contre des insectes nuisibles spécifiques en milieu agricole et retrouvés en abondance dans le milieu environnant, ou de gènes de résistance aux antibiotiques ne donnant qu’un avantage relatif négligeable à d’éventuelles bactéries réceptrices (Goldstein et al. 2005; Salyers 1996), il apparaît que les transgènes actuellement commercialisés à grande échelle dans le monde donneront un avantage limité, voire négligeable aux organismes du milieu qui pourraient les acquérir par transfert génique horizontal. À l’opposé, des transgènes conférant un avantage sélectif sous des conditions adverses comme la sécheresse, la salinité ou le froid (Wang et al. 2003) pourraient être « fixés » à plus long terme dans le milieu parce qu’ils montreraient une influence tangible sur l’implantation de populations microbiennes dérivées d’individus récepteurs qui, bien que peu nombreux au départ, seraient nettement favorisés par l’intégration et l’expression du nouveau gène (Nielsen et al. 1998). Dans ce contexte, l’emploi de transgènes non homologues aux séquences nucléiques procaryotiques (Kay et al. 2002) ou l’inclusion d’introns dans les séquences codantes (Libiakova et al. 2001; Tepfer et al. 2003) pourraient s’avérer utiles pour compromettre l’expression et minimiser la fixation des caractères recombinants intégrés à d’éventuelles bactéries réceptrices.
En conclusion
En somme, les données scientifiques actuelles font état de l’importance des processus de migration génique dans l’environnement. Si l’idée d’une « pollution génétique » à grande échelle causant l’apparition et la dissémination de « super mauvaises herbes » ou de « super microbes » dans l’environnement demeure tout à fait hypothétique après plusieurs années de travaux sur la question, la diversité des systèmes en cause et l’importance d’une prise en compte au cas par cas des interactions possibles entre les cultures transgéniques et le milieu sont clairement illustrées par les données scientifiques disponibles. La complexité des processus étudiés met par ailleurs en lumière l’état relativement fragmentaire des connaissances actuelles sur certains aspects des phénomènes observés. Les nombreuses études conduites jusqu’ici sur les flux polliniques et géniques dans l’environnement appuient fortement l’idée d’un impact limité des cultures transgéniques commerciales sur l’intégrité des génomes en milieux naturels et agricoles, mais une prise en compte plus globale des interactions possibles dans le contexte agricole actuel demeure souhaitable.
Dans le cas des cultures tolérantes aux herbicides, par exemple, les phénomènes d’hybridation intraspécifique observés à l’intérieur d’un champ ou dans un champ avoisinant présentent un risque limité pour les écosystèmes naturels, mais soulèvent des questions pertinentes d’ordres agronomique et social qui méritent une analyse plus fine et le développement de stratégies efficaces pour le confinement des transgènes. Des données empiriques plus étoffées sur l’incidence des taux d’introgression génique chez les populations végétales sauvages sont également requises avec la venue possible, dans les années à venir, de lignées à caractères nouveaux montrant des interactions plus complexes avec le milieu. De nouvelles données empiriques seront utiles, notamment, au sujet des facteurs environnants montrant une influence sur l’incidence des flux géniques pour les différentes cultures agricoles, de même que sur l’impact réel des nouveaux caractères recombinants sur la survie et le développement des organismes récepteurs éventuels dans les milieux considérés.
Dans une perspective plus large, l’acquisition de données nouvelles sur ces différentes questions permettra une description plus fidèle des impacts environnementaux associés à l’amélioration des végétaux en agriculture. Les semences variétales développées au cours du temps par le biais des programmes d’amélioration génétique portent une gamme de gènes d’intérêt agronomique qui, comme pour les cultures transgéniques, peuvent migrer en direction des populations végétales avoisinantes. Une étude décrivait, par exemple, le cas d’une lignée conventionnelle de canola tolérante aux herbicides qui, cultivée sur de grandes superficies dans plusieurs pays, propageait son gène de tolérance à des populations de même espèce dans un rayon de 3 km (Rieger et al. 2002). Des études approfondies sur les flux polliniques, le transfert génique horizontal et l’introgression des transgènes dans l’environnement, couplées à l’étude des effets associés aux produits recombinants (v. Michaud 2005), contribueront sans aucun doute, dans les années à venir, à une meilleure compréhension des processus de migration génique dans l’environnement et au développement de stratégies de déploiement des cultures transgéniques prenant en compte de façon plus tangible les différents éléments du milieu.
Appendices
Remerciements
L’auteur remercie le Dr François Belzile pour des discussions fructueuses sur les thèmes abordés. Cette étude a été financée par le ministère du Développement durable, de l’Environnement et des Parcs du Québec (Projet PARDE 02 –1).
Références
- Abbott, R.J. 1992. Plant invasions, interspecific hybridization and the evolution of plant taxa. Trends Ecol. Evol. 7 : 401-405.
- Abbott, R.J., J.K. James, R.I. Milne et A.C.M. Gilles. 2003. Plant introductions, hybridization and gene flow. Philos. Transac. R. Soc. Lond. B 358 : 1123-1132.
- Andersen, J.T., T. Schafer, P.L. Jorgensen et S. Moller. 2001. Using inactivated microbial biomass as fertilizer: the fate of antibiotic resistance genes in the environment. Res. Microbiol. 152 : 823-833.
- Anonyme. 2002. Editorial note. Nature 6881 : 600.
- Arnaud, J.-F., F. Viard, M. Delescluse et J. Cuguen. 2003. Evidence for gene flow via seed dispersal from crop to wild relatives in Beta vulgaris (Chenopodiaceae): consequences for the release of genetically modified crop species with weedy lineages. Proc. R. Soc. Lond. B 270 : 1565-1571.
- Badosa, E., C. Moreno et E. Montesinos. 2004. Lack of detection of ampicillin resistance gene transfer from Bt176 transgenic corn to culturable bacteria under field conditions. FEMS Microbiol. Ecol. 48 : 169-178.
- Bartsch, D., M. Lehnen, J. Clegg, M. Pohl-Orf, I.I. Schuphan et N.C. Ellstrand. 1999. Impact of gene flow from cultivated beet on genetic diversity of wild sea beet populations. Mol. Ecol. 8 : 1733-1741.
- Beckie, H.J., S.I. Warwick, H. Nair et G. Séguin-Swartz. 2003. Gene flow in commercial fields of herbicide- resistant canola (Brassica napus). Ecol. Appl. 13 : 1276-1294.
- Beckie, H.J., G. Séguin-Swartz, H. Nair, S.I. Warwick et E. Johnson. 2004. Multiple herbicide-resistant canola can be controlled by alternative herbicides. Weed Sci. 52 : 152-157.
- Bergthorsson, U., K.L. Adams, B. Thomason et J.D. Palmer. 2003. Widespread horizontal transfer of mitochondrial genes in flowering plants. Nature 424 : 197-201.
- Bertolla, F. et P. Simonet. 1999. Horizontal gene transfers in the environment: natural transformation as a putative process for gene transfers between transgenic plants and micro-organisms. Res. Microbiol. 150 : 375-384.
- Bevan, M., K. Mayer, O. White, J.A. Eisen, D. Preuss, T. Bureau, S.L. Salzberg et H.W. Mewes. 2001. Sequence and analysis of the Arabidopsis genome. Curr. Opin. Plant Biol. 4 : 105-110.
- Bock, A.-K., K. Lheureux, M. Libeau-Dulos, H. Nilsagard et E. Rodriguez-Cereso. 2002. Scenarios for co-existence of genetically modified, conventional and organic crops in European agriculture. Institute for Prospective Technological Studies and Joint Research Centre of the European Commission IPTS-JRC, Sevilla.
- [ftp://ftp.jrc.es/pub/EURdoc/eur20394en.pdf]
- Brunelle, F., D. Carter, A. Charland et G. Goyette. 2004. Revue sur le flux de gènes. Vecteur Environ. 37 (3) : 43-53.
- CAAQ [Conseil des Appellations Agroalimentaires du Québec]. 2005. Normes biologiques de référence du Québec, version 2.1. [http://www.caaq.org/appellation-biologique/normes-biologiques.asp]
- Carter, D. 2004. Impacts environnementaux associés aux OGM. Vecteur Environ. 37 (6) : 47-59.
- CFIA [Canadian Food Inspection Agency]. 2000a. Directive DIR2000-07: Conducting confined research field trials of plants with novel traits in Canada. [http://www.inspection. gc.ca/ english/plaveg/bio/dir/dir0007e.shtml]
- CFIA [Canadian Food Inspection Agency]. 2000b. Interim amendment to DIR2000-07 for confined research field trials of PNTs for plant molecular farming. [http://www.inspection.gc.ca/english/plaveg/bio/dir/ dir0007ie.shtml]
- Chambers, P.A., P.S. Duggan, J. Heritage et J.M. Forbes. 2001. The fate of antibiotic resistance marker genes in transgenic plant feed material fed to chickens. J. Antimicrob. Chemother. 47 : 241-243.
- Chèvre, A.M., F. Eber, A. Baranger et M. Renard. 1997. Gene flow from transgenic crops. Nature 389 : 924.
- Chèvre, A.M., F. Eber, H. Darmency, A. Fleury, H. Picault, J.C. Letanneur et M. Renard. 2000. Assessment of interspecific hybridization between transgenic oilseed rape and wild radish under normal agronomic conditions. Theor. Appl. Genet. 100 : 1233-1239.
- Chowdhury, E.H., O. Mikami, Y. Nakajima, H. Kuribara, A. Hino, K. Suga, X. Hanazumi et C. Yomemochi. 2003a. Detection of genetically modified maize DNA fragments in the intestinal contents of pigs fed Starlink™ CBH 351. Vet. Hum. Toxicol. 45 : 95-96.
- Chowdhury, E.H., H. Kuribara, A. Hino, P. Sultana, O. Mikami, N. Shimada, K.S. Guruge, M. Saito et Y. Nakajima. 2003b. Detection of corn intrinsic and recombinant DNA fragments and Cry1Ab protein in the gastrointestinal contents of pigs fed genetically modified corn Bt11. J. Anim. Sci. 81 : 2546-2551.
- Christou, P. 2002. No credible scientific evidence is presented to support claims that transgenic DNA was introgressed into traditional maize landraces in Oaxaca, Mexico. Transgenic Res. 11 : iii-v.
- Concibido, V.C., B. La Vallee, P. McLaird, N. Pineda, J. Meyer, L. Hummel, J. Yang, K. Wu et X. Delannay. 2003. Introgression of a quantitative trait locus for yield from Glycine soja into commercial soybean cultivars. Theor. Appl. Genet. 106 : 575-182.
- Condon, M.S. 2001. Seed genetic purity in the pre and post biotechnology eras. [http://pewagbiotech.org/events/ 0911/speakersCondon.pdf]
- Conner, A.J., T.R. Glare et J.-P. Nap. 2003. The release of genetically modified crops into the environment. Part II. Overview of ecological risk assessment. Plant J. 33 : 19-46.
- Crawley, M.J., R.S. Hails, M. Rees, D. Kohn et J. Buxton. 1993. Ecology of transgenic oilseed rape in natural habitats. Nature 363 : 620-623.
- Crawley, M.J., S.L. Brown, R.S. Hails, D.D. Kohn et M. Rees. 2001. Transgenic crops in natural habitats. Nature 409 : 682-683.
- Cuthbert, J.L. et P.B.E. McVetty. 2001. Plot-to-plot, row-to-row and plant-to-plant outcrossing studies in oilseed rape. Can. J. Plant Sci. 81 : 657-664.
- Dale, P.J., B. Clarke et E.M.G. Fontes. 2002. Potential for the environmental impact of transgenic crops. Nat. Biotechnol. 20 : 567-574.
- Daniell, H. 2002. Molecular strategies for gene containment in transgenic crops. Nat. Biotechnol. 20 : 581-586.
- Daniell, H., S.J. Streatfield et K. Wycoff. 2001. Medical molecular farming: production of antibodies, biopharmaceuticals and edibble vaccines in plants. Trends Plant Sci. 6 : 219-226.
- De la Cruz, F. et J. Davies. 2000. Horizontal gene transfer and the origin of species: lessons from bacteria. Trends Microbiol. 8 : 128-133.
- De Vries, J. et W. Wackernagel. 1998. Detection of npt II (kanamycin resistance) gene in genomes of transgenic plants by marker-rescue transformation. Mol. Gen. Genet. 257 : 606-613.
- De Vries, J., P. Meier et W. Wackernagel. 2001. The natural transformation of the soil bacteria Pseudomonas stutzeri and Acinetobacter sp. by transgenic plant DNA strictly depends on homologous sequences in the recipient cells. FEMS Microbiol. Lett. 195 : 211-215.
- Doebley, J. 1990. Molecular evidence for gene flow among Zea species. Bioscience 40 : 443-448.
- Doolittle, F.W. 1999. Lateral genomics. Trends Genet. 15 : M5-M8.
- Dorey, E. 2000. Taco dispute underscores need for standardized tests. Nat. Biotechnol. 18 : 1136-1137.
- Dröge, M., A. Puhler et W. Selbitschka. 1998. Horizontal gene transfer as a biosafety issue: a natural phenomenon of public concern. J. Biotechnol. 64 : 75-90.
- Duggan, P.S., P.A. Chambers, J. Heritage et J.M. Forbes. 2000. Survival of free DNA encoding antibiotic resistance from transgenic maize and the transformation activity of DNA in ovine saliva, ovine rumen fluid and silage effluent. FEMS Microbiol. Lett. 191 : 71-77.
- Dunfield, K.E. et J.J. Germida. 2004. Impact of genetically modified crops on soil- and plant-associated microbial communities. J. Environ. Qual. 33 : 806-815.
- Eastham, K. et J. Sweet. 2002. Genetically modified organisms (GMOs): the significance of gene flow through pollen transfer. Expert’s Corner Series, European Environment Agency, Copenhagen, Denmark.
- ECSCP [European Commission Scientific Committee on Plants]. 2001. Opinion of the Scientific Committee on Plants concerning the adventitious presence of GM seeds in conventional seeds. SCP/GMO-Seed-Cont/002-Final. European Commission, Bruxelles (Belgique).
- [http://europa.eu.int/comm/food/fs/sc/scp/out93_gmo_en. pdf]
- Einspanier, R., A. Klotz, J. Kraft, K. Aulrich, R. Poser, F. Schwägele, G. Jahreis et G. Flachowsky. 2001. The fate of forage plant DNA in farm animals: a collaborative case study investigating cattle and chicken fed recombinant plant material. Eur. Food Res. Technol. 212 : 129-134.
- Ellstrand, N.C. 2001. When transgenes wander, should we sorry? Plant Physiol. 125 : 1543-1545.
- Ellstrand, N.C. 2003. Current knowledge of gene flow in plants: implications for transgene flow. Philos. Trans. R. Soc. Series B 358 : 1163-1170.
- Ellstrand, N.C. et K. Schierenbeck. 2000. Hybridization as a stimulus for the evolution of invasiveness in plants? Proc. Natl. Acad. Sci. USA 97 : 7043-7050.
- Ellstrand, N.C., H.C. Prentice et J.F. Hancock. 1999. Gene flow and introgression from domesticated plants into their wild relatives. Annu. Rev. Ecol. Syst. 30 : 539-563.
- EU [European Union]. 1999. Council regulation (EC) No. 1804/1999 of 19 July 1999 supplementing Regulation (EEC) No. 2092/91 on organic production of agricultural products and indications referring thereto on agricultural products and foodstuffs to include livestock production. Official Journal of the European Communities, L. 222/1, 24.8.2001.
- EU [European Union]. 2001. Directive 2001/18/EC of the European Parliament and of the Council of 12 March 2001 on the deliberate release into the environment of genetically modified organisms and repealing Council Directive 90/220/EEC. Official Journal of the European Communities, L106/1, 17.4.2001.
- Feil, B., U. Weingartner et P. Stamp. 2003. Controlling the release of pollen from genetically modified maize and increasing its grain yield by growing mixtures of male-sterile and male-fertile plants. Euphytica 130 : 163-165.
- Ferré, J. et J. Van Rie. 2002. Biochemistry and genetics of insect resistance to Bacillus thuringiensis. Annu. Rev. Entomol. 47 : 501-533.
- Friesen, L.F., A.G. Nelson et R.C. van Acker. 2003. Evidence of contamination of pedigreed canola (Brassica napus) seedlots in Western Canada with genetically engineered herbicide resistance traits. Agron. J. 95 : 1342-1347.
- Garcia, G.M., H.T. Stalker et G. Kochert. 1995. Introgression analysis of an interspecific hybrid population in peanuts (Arachis hypogaea L.) using RFLP and RAPD markers. Genome 38 : 166-176.
- Gebhard, F. et K. Smalla. 1998. Transformation of Acinetobacter sp. strain BD413 by transgenic sugarbeet DNA. Appl. Environ. Microbiol. 64 : 1550-1554.
- Gebhard, F. et K. Smalla. 1999. Monitoring field releases of genetically modified sugar beets for persistence of transgenic plant DNA and horizontal gene transfer. FEMS Microbiol. Ecol. 28 : 261-272.
- Gelvin, S.B. 2003. Agrobacterium-mediated plant transformation: the biology behind the “gene-jockeying” tool. Microbiol. Mol. Biol. Rev. 67 : 16-37.
- Glaser, J.A. et S.R. Matten. 2003. Sustainability of insect resistance management strategies for transgenic Bt corn. Biotechnol. Adv. 22 : 45-69.
- Goldstein, D.A., B. Tinland, L.A. Gilbertson, J.M. Staub, G.A. Bannon, R.E. Goodman, R.L. McCoy et A. Silvanovich. 2005. Human safety and genetically modified plants: a review of antibiotic resistance markers and future transformation selection technologies. J. Appl. Microbiol. 99 : 7-23.
- Government of Canada. 2004. Seeds Act (S-8 – CRC, ch. 1400). [http://laws.justice.gc.ca/en/S-8]
- Greenpeace Canada. 2004. Genetic engineering briefing pack. GE contamination, the ticking time-bomb. [http://www.greenpeace.ca/e/campaign/gmo/depth/ pollution/ContaminationBriefing.pdf]
- Groot, A.T. et M. Dicke. 2002. Insect-resistant transgenic plants in a multi-trophic context. Plant J. 31 : 387-406.
- Gulden, R.H., S.J. Shirtliffe et A.G. Thomas. 2003. Harvest losses of canola (Brassica napus) cause large seedbank inputs. Weed Sci. 51 : 83-86.
- Halfhill, M.D., H.A. Richards, S.A. Mabon et C.N. Stewart. 2001. Expression of GFP and Bt transgenes in Brassica napus and hybridization with Brassica rapa. Theor. Appl. Genet. 103 : 659-667.
- Halfhill, M.D., R.J. Millwood, P.L. Raymer et C.N. Stewart. 2002. Bt-transgenic oilseed rape hybridization with its weedy relative, Brassica rapa. Environ. Biosafety Res. 1 : 19-28.
- Halfhill, M.D., R.J. Millwood, A.K. Weissinger, S.I. Warwick et C.N. Stewart. 2003. Additive transgene expression and genetic introgression in multiple GFP transgenic crop x weed hybrid generations. Theor. Appl. Genet. 107 : 1533-1540.
- Hall, L., J. Topinka, J. Huffman, L. Davis et A. Good. 2000. Pollen flow between herbicide-resistant Brassica napus is the cause of multiple-resistant B. napus volunteers. Weed Sci. 48 : 688-694.
- Hansen, L.B., H.R. Siegismund et R.B. Jorgensen. 2001. Introgression between oilseed rape (Brassica napus L.) and its weedy relative B. rapa L. in a natural population. Genet. Resour. Crop Evol. 48 : 621-627.
- Harlan, J.R. 1976. Genetic resources in wild relatives of crops. Crop Sci. 16 : 329-333.
- Harrison, L.A., M.R. Bailey, M.W. Naylor, J.E. Ream, B.G. Hammond, D.L. Nida, B.L. Burnette, T.E. Nickson, T.A. Mitsky, M.L. Taylor, R.L. Fuchs et S.R. Padgette. 1996. The expressed protein in glyphosate-tolerant soybeans, 5-enolpyruvyl-shikimate-3-phosphate synthase from Agrobacterium sp. is rapidly digested in vitro and is not toxic in acutely gavaged mice. J. Nutr. 126 : 728-740.
- Haygood, R., A.R. Ives et D.A. Andow. 2004. Population genetics of transgene containment. Ecol. Lett. 7 : 213-220.
- Hoag, H. 2003. Tougher rules aim to prevent gene flow into crops. Nature 422 : 103.
- Inf’OGM. 2003. Bruxelles réaffirme son refus de « zones sans OGM » dans l’UE. Inf’OGM, 23 juillet 2003. [http://www.infogm.org/breve.php3?id_breve=149]
- James, C.A. 2005. Global review of commercialized transgenic crops, 2005. ISAAA Briefs No. 32. International Service for the Acquisition of Agri-Biotech Applications, Ithaca, NY.
- Jenczewski, E., J.M. Prosperi et J. Ronfort. 1999. Evidence for gene flow between wild and cultivated Medicago sativa (Leguminosae) based on allozyme markers and quantitative traits. Am. J. Bot. 86 : 677-687.
- Jennings, J.C., D.C. Kolwyck, S.B. Kays, A.J. Whetsell, J.B. Surber, G.L. Cromwell, R.P. Lirette et K.C. Glenn. 2003. Determining whether transgenic and endogenous plant DNA and transgenic protein are detectable in muscle from swine fed Roundup Ready soybean meal. J. Anim. Sci. 81 : 1447-1455.
- Jiang, C.X., P.W. Chee, X. Draye, P.L. Morrell, C.W. Smith et A.H. Paterson. 2000. Multilocus interactions restrict gene introgression in interspecific populations of polyploid Gossypium (cotton). Evolution 54 : 798-814.
- Jollivet M. et J.-C. Mounolou. 2005. Le débat sur les OGM : apports et limites de l’approche biologique. Nat. Sci. Soc. 13 : 45-53.
- Jonas, D.A., I. Elmadfa, K.H. Engle, K.J. Heller, G. Kozianowski, A. König, D. Müller, J.F. Narbonne, W. Wackernagel et J. Kleiner. 2001. Safety considerations of DNA in food. Ann. Nutr. Metab. 45 : 235-254.
- Jorgensen, R.B. et B. Andersen. 1994. Spontaneous hybridication between oilseed rape (Brassica napus) and weedy B. campestris (Brassicaceae): a risk of growing genetically modified oilseed rape. Am. J. Bot. 81 : 1620-1626.
- Kaplinsky, N., D. Braun, D. Lisch, A. Hay, S. Hake et M. Freeling. 2002. Maize transgene results in Mexico are artefacts. Nature 416 : 601.
- Kay, E., T.M. Vogel, F. Bertolla, R. Nalin et P. Simonet. 2002. In situ transfer of antibiotic resistance genes from transgenic (transplastomic) tobacco plants to bacteria. Appl. Environ. Microbiol. 68 : 3345-3351.
- Keenan, R.J. et W.P. Stemmer. 2002. Nontransgenic crops from transgenic plants. Nat. Biotechnol. 20 : 215-216.
- Koivu, K., A. Kanerva et E. Pehu. 2001. Molecular control of transgene escape from genetically modified plants. Plant Sci. 160 : 517-522.
- Koonin, E.V., K.S. Makarova et L. Aravind. 2001. Horizontal gene transfer in prokaryotes. Quantification and classification. Annu. Rev. Microbiol. 55 : 709-742.
- Lavigne, C., E.K. Klein, P. Vallée, J. Pierre, B. Godelle et M. Renard. 1998. A pollen-dispersal experiment with transgenic oilseed rape. Estimation of the average pollen dispersal of an individual plant within a field. Theor. Appl. Genet. 96 : 886-896.
- Leask, B. 2000. Troubles with thresholds. Canadian Seed Trade Association. [http://cdnseed.org/press/Troubles %20With%20-Thresholds.pdf]
- Lefol, E., A. Fleury et H. Darmency. 1996. Gene dispersal from transgenic crops. II. Hybridization between oilseed rape and the wild hoary mustard. Sex. Plant Reprod. 9 : 189-196.
- Légère, A. 2005. Risks and consequences of gene flow from herbicide-resistant crops: canola (Brassica napus L) as a case study. Pest Manag. Sci. 61 : 292-300.
- Libiakova, G., B. Jorgenson, G. Palmgren, P. Ulvskov et E. Johansen. 2001. Efficacy of an intron-containing kanamycin resistance gene as a selectable marker in plant transformations. Plant Cell Rep. 20 : 610-615.
- Linder, C., I. Taha, G. Seiler, A. Snow et L. Rieseberg. 1998. Long-term introgression of crop genes into wild sunflower populations. Theor. Appl. Genet. 96 : 339-347.
- Lorenz, M.G. et W. Wackernagel. 1992. DNA binding to various clay minerals and retarded enzymatic degradation of DNA in a sand/clay microcosm. Pages 103-113 in M.J. Gauthier (éd.), Gene Transfers and Environment. Springer-Verlag KG, Berlin, Allemagne.
- Lorenz, M.G. et W. Wackernagel. 1994. Bacterial gene-transfer by natural genetic transformation in the environment. Microbiol. Res. 58 : 563-602.
- Lu, B.R. 2003. Transgene containment by molecular means–is it possible and cost effective? Environ. Biosafety Res. 2 : 3-8.
- Luna, S.V., J.M. Figueroa, B.M. Baltazar, R.L. Gomez, R. Townsend et J.B. Schoper. 2001. Maize pollen longevity and distance isolation requirements for effective pollen control. Crop Sci. 41 : 1551-1557.
- Lutman, P.J.W. 1999. Gene flow and agriculture: relevance for transgenic crops. BCPC Symposium Proceedings No. 72, Keele Proceedings. British Crop Protection Council, Londres, G.-B.
- Martin-Orue, S.M., A.G. O’Donnel, J. Arino, T. Netherwood, H.J. Gilbert et J.C. Mathers. 2002. Degradation of transgenic DNA from genetically modified soya and maize in human intestinal simulations. Br. J. Nutr. 87 : 533-542.
- McAllan A.B. 1980. The degradation of nucleic acids in, and removal of breakdown products from, the small intestine of steers. Br. J. Nutr. 44 : 99-113.
- McAllan, A.B. 1982. The fate of nucleic acids in ruminants. Proc. Nutr. Soc. 41 : 309-317,
- Mercer, D.K., K.P. Scott, W.A. Bruce-Johnson, L.A. Glover et H.J. Flint. 1999. Fate of free DNA and transformation of the oral bacterium Streptococcus gordonii DL1 by plasmid DNA in human saliva. Appl. Environ. Microbiol. 65 : 6-10.
- Mercer, D.K., K. Scott, C.M. Melville, L.A. Glover et H.J. Flint. 2001. Transformation of an oral bacterium via chromosomal integration of free DNA in the presence of human saliva. FEMS Microbiol. Lett. 200 : 163-167.
- Messeguer, J. 2003. Gene flow assessment in transgenic plants. Plant Cell Tissue Organ Cult. 73 : 201-212.
- Metz, M. et J. Fütterer. 2002. Suspect evidence of transgenic contamination. Nature 416 : 600-601.
- Metz, P.L.J., E. Jacobsen, J.-P. Nap, A. Pereira et W.J. Stiekema. 1997. The impact on biosafety of the phosphinotricin-tolerance transgene in inter-specific B. rapa x B.napus hybrids and their successive backcrosses. Theor. Appl. Genet. 95 : 442-450.
- Michaud, D. 2005. Impact environnemental des cultures transgéniques. II. L’impact des caractères recombinants. Phytoprotection 86 : 107-124.
- Mikkelsen, T.R., J. Jensen et R.B. Jorgensen. 1996. Inheritance of oilseed rape (Brassica napus) RAPD markers in a backcross progeny with Brassica campestris. Theor. Appl. Genet. 92 : 492-497.
- Moeller, D.R. 2001. GMO liability threats for farmers. Legal issues surrounding the planting of genetically modified crops. Institute for Agriculture and Trade Policy, Minneapolis MN, p. 8. [http://www.gefoodalert.org/ library/admin/uploadedfiles/GMO_Liability_Threats_for_Farmers_PDF_Ver.pdf]
- Morris, W.F., M. Kareiva et P.L. Raymer. 1994. Do barren zones and pollen traps reduce gene escape from transgenic crops? Ecol. Appl. 4 : 157-165.
- Morrison, L.A., L.C. Crémieux, et C.A. Mallory-Smith. 2002. Infestations of jointed goatgrass (Aegilops cylindrica) and its hybrids with wheat in Oregon wheat fields. Weed Sci. 50 : 737-747.
- Moyes, C.L. et P.J. Dale. 1999. Organic farming and gene transfer from genetically modified crops. John Innes Centre, Norwich, UK. [http://www.gmissues.org/ orgreport.htm]
- Netherwood, T., S.M. Martin-Orue, A.G. O’Donnell, S. Gockling, J. Graham, J.C. Mathers et H.J. Gilbert. 2004. Assessing the survival of transgenic plant DNA in the human gastrointestinal tract. Nat. Biotechnol. 22 : 204-209.
- Nielsen, K.M. et J.D. van Elsas. 2001. Stimulatory effects of compounds present in the rhizosphere on natural transformation of Acinetobacter sp. Strain BD413 in soil. Soil Biol. Biochem. 33 : 345-357.
- Nielsen, K.M., A.M. Bones, K. Smalla et J.D. van Elsas. 1998. Horizontal gene transfer from transgenic plants to terrestrial bacteria – a rare event? FEMS Microbiol. Rev. 22 : 79-103.
- Nielsen, K.M., J.D. van Elsas et K. Smalla. 2000. Transformation of Acinetobacter sp. Strain BD413 (pFG4nptII) with transgenic plant DNA in soil microcosms and effects of kanamycin on selection of transformants. Appl. Environ. Microbiol. 66 : 1237-1242.
- Nielsen, K.M., J.D. van Elsas et K. Smalla. 2001. Dynamics, horizontal transfer and selection of novel DNA in bacterial populations in the phytosphere of transgenic plants. Ann. Microbiol. 51 : 79-94.
- Nordborg, M., J.O. Borevitz, J. Bergelson, C.C. Berry, J. Chory, J. Hagenblad, M. Kreitman, J.N. Maloof, T. Noyes, P.J. Oefner, E.A. Stahl et D. Weigel. 2002. The extent of linkage desequilibrium in Arabidopsis thaliana. Nat. Genet. 30 : 190-193.
- O’Callaghan, M., T.R. Glare, E.P.J. Burgess et L.A. Malone. 2005. Effects of plants genetically modified for insect resistance on nontarget organisms. Annu. Rev. Entomol. 50 : 271-292.
- Ochman, H., J.G. Lawrence et E.A. Groisman. 2000. Lateral gene transfer and the nature of bacterial innovation. Nature 405 : 299-304.
- Odell, J.T., J.L. Hoopes et W. Vermerris. 1994. Seed-specific gene activation mediated by the Cre/lox site-specific recombination system. Plant Physiol. 106 : 447-458.
- OECD [Organization for Economic and Cooperative Development]. 2001. OECD schemes for the varietal certification of seed moving in international trade. Guidelines for control plot tests and field inspection of seed crops. OECD, Paris, France.
- [http://www.oecd.org/pdf/M00024000/M00024449.pdf]
- Ortiz-Garcia, S., E. Ezcurra, B. Schoel, F. Acevedo, J. Soberon et A.A. Snow. 2005. Absence of detectable transgenes in local landraces of maize in Oaxaca, Mexico (2003-2004). Proc. Natl. Acad. Sci. USA 102 : 12338-12343.
- Paget, E., M. Lebrun, G. Freyssinet et P. Simonet. 1998. The fate of recombinant plant DNA in soil. Eur. J. Soil Biol. 34 : 81-88.
- Paul, W.J., W.H. Jeffrey, A.W. David, M.F. De Flaun et L.H. Cazares. 1989. Turnover of extracellular DNA in eutrophic and oligotrophic freshwater environments of Southwest Florida. Appl. Environ. Microbiol. 55 : 1823-1828.
- Pinder, R., N. Al-Kaff, M. Kreike et P. Dale. 1999. Evaluating the risk of transgene spread from Brassica napus to related species. Pages 275-280 in P.W. Lutman (éd.), Gene flow and agriculture: Relevance for transgenic crops. British Crop Protection Council, Londres.
- Pleasants, J.M., R.L. Hellmich, G.P. Dively, M.K. Sears, D.E. Stanley-Horn, H.R. Mattila, J.E. Foster, P. Clark et G.D. Jones. 2001. Corn pollen deposition on milkweeds in and near cornfields. Proc. Natl. Acad. Sci. USA 98 : 11919-11924.
- Quist, D. et I. Chapela. 2001. Transgenic DNA introgressed into traditional maize landraces in Oaxaca, Mexico. Nature 414 : 541-543.
- Reboud, X. 2003. Effect of a gap on gene flow between otherwise adjacent transgenic Brassica napus crop. Theor. Appl. Genet. 106 : 1048-1058.
- Remington, D.L., J.M. Thornsberry, Y. Matsuoka, L.M. Wilson, S.R. Whitt, J. Doebley, S. Kresovich, M.M. Goodman et E.S. Buckler. 2001. Structure of linkage desequilibrium and phenotypic associations in the maize genome. Proc. Natl. Acad. Sci. USA 98 : 11479-11484.
- Rieger, M.A., M. Lamond, C. Preston, S.B. Powles et R.T. Roush. 2002. Pollen-mediated movement of herbicide resistance between commercial canola fields. Science 296 : 2386-2388.
- Rieseberg, L.H., M.J. Kim et G.J. Seiler. 1999a. Introgression between the cultivated sunflower and a sympatric wild relative, Helianthus petiolaris (Asteraceae). Int. J. Plant Sci. 160 : 102-108.
- Rieseberg, L.H., J. Whitton et K. Gardner. 1999b. Hybrid zones and the genetic architecture of a barrier to gene flow between two wild sunflower species. Genetics 152 : 713-727.
- Salyers, A. 1996. The real threat from antibiotics. Nature 384 : 304.
- Schernthaner, J.P., S.F. Fabijanski, P.G. Arnison, M. Racicot et L.S. Robert. 2003. Control of seed germination in transgenic plants based on the segregation of a two-component genetic system. Proc. Natl. Acad. Sci. USA 100 : 6855-6859.
- Schiemann, J. 2003. Co-existence of genetically modified crops with conventional and organic farming. Environ. Biosafety Res. 2 : 213-217.
- Schlüter, K., J. Fütterer et I. Potrykus. 1995. Horizontal gene transfer from a transgenic potato line to a bacterial pathogen (Erwinia chrysanthemi) occurs, if at all, at an extremely low frequency. Bio/Technology 13 : 1094-1098.
- Scott, S.E. et M.J. Wilkinson. 1998. Transgene risk is low. Nature 393 : 320.
- Simpson, E.C., C.E. Norris, J.R. Law, J.E. Thomas et J.B. Sweet. 1999. Gene flow in genetically modified herbicide tolerant oilseed rape (Brassica napus) in the UK. Pages 75-81 in P.W. Lutman (éd.), Gene flow and agriculture: Relevance for transgenic crops. British Crop Protection Council, Londres.
- Song, Z.P., L. Baorong, Y.G. Zhu et J.K. Chen. 2002. Pollen competition between cultivated and wild rice species Oryza sativa and O. rufipogon. New Phytol. 153 : 283-296.
- Song, Z.P., B. Lu, Y.G. Zhu et J.K. Chen. 2003. Gene flow from cultivated rice to the wild species Oryza rufipogon under experimental field conditions. New Phytol. 157 : 657-665.
- Squire, G.R., J.W. Crawford, G. Ramsay, C. Thompson et J. Brown. 1999. Gene flow at the landscape level. Pages 57-64 in P.W. Lutman (éd.), Gene Flow and Agriculture: Relevance for Trangenic Crops. British Crop Protection Council, Londres.
- Squire, G.R., N. Augustin, J. Brown, J.W. Crawford, G. Dunlop, J. Graham, J.R. Hillman, B. Marshall, D. Marshall, G. Ramsay, D.J. Robinson, J. Russell, C. Thompson et G. Wright. 2000. Gene flow in the environment – genetic pollution? Pages 45-54 in C. Thompson et G. Wright (éds.), Annual Report of the Scottish Crop Research Institute, Dundee, Scotland.
- Staniland, B.K., P.B.E. McVetty, L.F. Friesen, S. Yarrow, G. Freyssinet et M. Freyssinet. 2000. Effectiveness of border areas in confining the spread of transgenic Brassica napus pollen. Can. J. Plant Sci. 80 : 521-526.
- Stewart, C.N., M.D. Halfhill et S.I. Warwick. 2003. Transgene introgression from genetically modified crops to their wild relatives. Nat. Rev. Genet. 4 : 806-817.
- Tepfer, D., R. Garcia-Gonzales, J. Mansouri, M. Seruga, B. Message, F. Leach et M.C. Perica. 2003. Homology-dependent DNA transfer from plants to soil bacterium under laboratory conditions: implications in evolution and horizontal gene transfer. Transgenic Res. 12 : 425-437.
- Thomson, J.A. 2001. Horizontal transfer of DNA from GM crops to bacteria and to mammalian cells. J. Food Sci. 66 : 188-193.
- Tomes, D.T. 1997. Genetic constructs and methods for producing fruits with very little or diminished seed. WO 97/40179.
- Van de Wiel, C., M. Groot et H. den Nijs. 2003. Gene flow from crops to wild plants and its population – ecological consequences in the context of GM-crop biosafety, including some recent experiences from lettuce. Pages 97-110 in Proceedings of the Frontis Workshop – Environmental costs and benefits of transgenic crops in Europe, Wageningen (Pays-Bas), juin 2003.
- Visser, B., I. van der Meer, N. Louwaars, J. Beekwilder et D. Eaton. 2001. The impact of terminator technology. Biotechnol. Dev. Monit. 48 : 9-12.
- Wang, W., B. Vinocur et A. Altman. 2003. Plant responses to drought, salinity and extreme temperatures: towards genetic engineering for stress tolerance. Planta 218 : 1-14.
- Warwick, S.I., H. Beckie et E. Small. 1999. Transgenic crops: new weed problems for Canada? Phytoprotection 80 : 71-84.
- Warwick, S.I., M.J. Simard, A. Légère, H.J. Beckie, L. Braun, B. Zhu, P. Mason, G. Séguin-Swartz et C.N. Stewart. 2003. Hybridization between transgenic Brassica napus L. and its wild relatives: Brassica rapa L., Raphanus raphanistrum L., Sinapis arvensis L., and Erucastrum gallicum (Willd.) O.E. Schultz. Theor. Appl. Genet. 107 : 528-539.
- Whitton, J., D.E. Wolf, D.M. Arias, A.A. Snow et L.H. Rieseberg. 1997. The persistence of cultivar alleles in wild populations of sunflowers five generations after hybridization. Theor. Appl. Genet. 95 : 33-40.
- WHO [World Health Organization]. 2000. Safety aspects of genetically modified foods of plant origin. Report of a joint FAO/WHO expert consultation on foods derived from biotechnology. Genève : WHO.
- Widmer, F., R.J. Seidler et L.S. Watrud. 1996. Sensitive detection of transgenic plant marker gene persistence in soil microcosms. Mol. Ecol. 5 : 603-613.
- Widmer, F., R.J. Seidler, K.K. Donegan et G.L. Reed. 1997. Quantification of transgenic plant marker gene persistence in the field. Mol. Ecol. 6 : 1-7.
- Wolfenbarger, L.L. et P.R. Phifer. 2000. The ecological risks and benefits of genetically engineered plants. Science 290 : 2088-2093.
List of figures
Figure 1
Un aperçu des différents impacts environnementaux attribués aux cultures transgéniques.
List of tables
Tableau 1
Quelques stratégies en développement pour le confinement moléculaire des transgènes intégrés aux cultures végétales transgéniques.
Tableau 2
Taux d’introgression génique en direction d’espèces sauvages apparentées pour quelques espèces agricoles cultivées à grande échelle (adapté de Stewart et al. 2003).


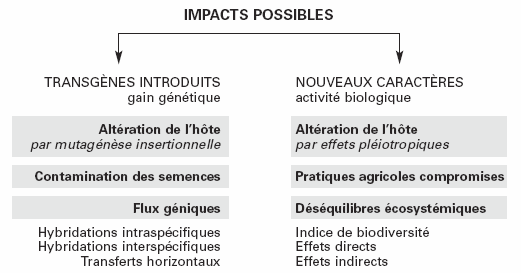


 10.7202/012511ar
10.7202/012511ar