Abstracts
Résumé
Des couples vierges de Sitophilus zeamais ont été placés dans des boîtes de Pétri contenant 8, 16 ou 32 grains de maïs. Après 10 jours d’infestation, nous avons dénombré les oeufs pondus, le nombre de grains infestés et la fréquence de distribution des oeufs par grain. Les grains ont ensuite été laissés en incubation pendant 7 semaines avant d’observer l’émergence des adultes et déterminer leur poids moyen et le sexe-ratio. Les résultats de la distribution des oeufs sur les grains de maïs indiquent que la ponte se fait de manière agrégative. Il n’existe pas de différence au niveau du nombre moyen d’oeufs pondus dans chaque traitement (avec une moyenne de 43, 39 et 36 oeufs pour les densités de 32, 16 et 8 grains/Pétri respectivement). Par contre, en ce qui concerne l’émergence des adultes, le plus grand nombre d’individus provient des lots contenant le plus grand nombre de grains. Il existe également des différences significatives au niveau du poids moyen des adultes issus des lots exposés à 32 grains (3,6 mg) qui sont plus lourds que ceux issus des lots contenant 8 grains de maïs (3,4 mg). Par contre, le sexe-ratio des charançons émergés ne diffère pas d’un lot de grains à un autre, et ce, pour les trois traitements. L’importance quantitative des ressources alimentaires sur le comportement de ponte et la biologie des insectes à cycle de développement endogé et la possibilité de l’existence d’une stratégie reproductive sont discutées.
Abstract
Virgin male/female pairs of Sitophilus zeamais were placed in Petri dishes containing 8, 16 or 32 maize grains for 10 days. After this period, the adults were removed and records were made as follow: number of eggs laid, number of grains infested and frequency distribution of egg number per grain. The grains were kept for 7 weeks after which the emerged adults were sieved off and counted. The sex ratio and weight were determined. Results indicated that S. zeamais tends to cluster eggs on the grains. There was no significant difference between the number of eggs recorded in each treatment (with an average of 43, 39 and 36 eggs for the quantities of 32, 16 and 8 grains per dish respectively). However, more adults emerged from the high density treatment. Average weight of adults emerged from batches exposed to 32 grains (3.6 mg) was also significantly higher than that resulting from batches containing 8 grains (3.4 mg). Sex ratios of emerged adults did not differ among treatments. The impact of grain quantity on biology and oviposition, in internally feeding granivore insects and the possibility that there is an adaptive reproductive strategy are discussed.
Article body
Introduction
Sur le continent africain, le maïs (Zea mays L.) représente une des denrées principales pour la plupart des pays au sud du Sahara. Il est sujet à des déprédations constantes par les insectes aussi bien au champ que durant le stockage. L’un des plus dommageables est le charançon du maïs, Sitophilus zeamais Motschulsky [Coleoptera : Curculionidae] (Markham et al. 1994; Throne 1994). Les femelles creusent un trou dans le grain et y déposent un oeuf. Elles rebouchent ensuite cette cavité à l’aide d’une substance mucilagineuse (McLagan et Dunn 1935). Le développement de la larve se fait de façon endogée (à l’intérieur du grain) jusqu’à l’émergence des adultes. Compte tenu du fait que les larves ne peuvent pas se déplacer entre les grains, la compétition peut réduire les perspectives de survie et de reproduction. En effet, le nombre d’oeufs pondus dans un site nourricier va conditionner, en fonction de la quantité de ressources disponibles, l’intensité d’une compétition larvaire (Tilman 1980). Cette compétition larvaire affecte le taux d’émergence des adultes mais aussi la capacité reproductive (Hawley 1985; Klomp 1964; Mangel et al. 1994) et la vigueur biologique (i.e. un taux d’accroissement et/ou une probabilité de persistance) des femelles issues de la progéniture (Honek 1993; Prout et McChesney 1985; Stejskal et Kucerova 1996). Les femelles vont donc influencer la vigueur biologique de leur progéniture selon qu’elles espacent la ponte sur plusieurs grains, réduisant ainsi la compétition entre les larves, ou qu’elles distribuent leurs oeufs au hasard (ou en agrégat) d’où perte en quantité et qualité de la progéniture (Giga et Smith 1981, 1985). Dès lors, la stratégie adoptée par la femelle pour avoir un succès reproducteur maximal (c’est-à-dire, le nombre de jeunes qu’en moyenne un individu produira à la suite de chaque saison de reproduction et qui, par la suite, se reproduiront à leur tour) est importante. Pour comprendre cette stratégie, il est fondamental d’avoir une bonne connaissance de la biologie du charançon du maïs. Afin de comprendre la biologie de S. zeamais, il est essentiel de savoir comment l’insecte réagit face aux variations de certains facteurs environnementaux.
Des études sur la dynamique des populations ont été conduites en faisant varier le nombre de grains de maïs (Schoonhoven et al. 1976; Widstrom et al. 1978) ou le nombre de charançons ou les deux facteurs à la fois (Dobie 1974; Widstrom et al. 1978). Toutefois, peu de données récentes dans la littérature décrivent l’impact des variations quantitatives de ressources alimentaires sur des caractères biodémographiques (la taille à la naissance, la taille et l’âge à la maturité, la survie larvaire, la fécondité, le nombre, la taille et le sexe-ratio des descendants, la durée de développement, la durée de vie, etc.) de S. zeamais. Pour rappel, la biodémographie désigne la distribution des événements majeurs qui jalonnent la vie d’un individu (Daan et Tinbergen 1997; Stearns 1992). Les caractères biodémographiques influencent directement la reproduction et la survie et par conséquent affectent la vigueur biologique (Daan et Tinbergen 1997; Stearns 1992).
Notre travail s’inscrit dans le cadre d’une approche globale pour l’étude de l’effet de la variation de l’environnement (représentée par différentes quantités de grains de maïs) sur l’évolution de certains caractères biodémographiques de S. zeamais, en relation avec la stratégie de ponte et les compromis évolutifs.
Matériel et méthodes
Conditions expérimentales
Insectes et substrat
La souche de S. zeamais utilisée est originaire du Togo et a été mise en élevage depuis 1994, à l’Unité de Zoologie générale et appliquée. Plusieurs générations ont été obtenues à partir des techniques d’élevage de masse. Les élevages de masse ont été réalisés dans des bocaux en verre remplis de grains de maïs (en moyenne 1600 grains/bocal) dans lesquels étaient ajoutés 200 adultes de S. zeamais, d’âge et de sexe indéterminés. Après une ou deux semaines d’infestation, les adultes sont retirés des grains par tamisage. Les grains infestés sont laissés en incubation dans la chambre conditionnée jusqu’à l’apparition des nouveaux adultes.
Les adultes utilisés ont été obtenus à partir de ces élevages de masse. Le matériel végétal utilisé, comme sub-strat au cours des expérimentations, était constitué de grains de maïs de la variété «Plata». Des mesures réalisées sur les grains (stockés dans des tonneaux en plastique de 60 litres) au moyen d’un thermohygromètre indiquaient une humidité moyenne de 13 % et une température moyenne de 22°C. Avant d’être utilisés lors des bio-essais, les grains ont été laissés pendant au moins 48 h à 28°C et 65 % d’humidité relative (HR). Toutes les expérimentations ont été réalisées dans une chambre conditionnée maintenue à 28 ± 2°C et 65 ± 5 % HR.
Dénombrement des oeufs
Les oeufs déposés par les femelles de S. zeamais ont été mis en évidence par une immersion des grains dans une solution d’acide fuschinique à 0,5 g L-1 (Frankenfeld 1948; Sharifi 1972). La méthode utilisée a été adaptée de celle décrite par Holloway (1985). Les grains ont été d’abord humidifiés par trempage dans un bain d’eau tiède agité (25-30°C). Ensuite, ceux-ci ont été immergés pendant 30-60 s dans la solution de fuchsine qui colore les bouchons mucilagineux en rouge cerise. Après rinçage des grains à l’eau pour éliminer l’excès de colorant, le dénombrement des oeufs déposés sur chaque grain a été effectué par observation directe au microscope stéréoscopique. Des observations préliminaires ont montré que chaque bouchon couvrait un seul oeuf.
Dispositif expérimental
Trois densités de grains de maïs (8, 16 et 32 grains) ont été placées dans des boîtes de Pétri en plastique de 55 mm de diam. Ces trois densités ont été retenues en tenant compte des conditions d’élevage de masse. Sur la base d’un couple pour 16 grains, en supposant que le sexe-ratio est de 1:1 (Richards 1947), le nombre de grains a été divisé ou multiplié par deux pour obtenir les ratios d’un couple pour 8 ou 32 grains. Pour tous les traitements, les grains ont été disposés de façon aléatoire dans les boîtes de Pétri.
Un couple d’adultes vierges de S. zeamais a été placé dans chaque boîte. Les adultes vierges (âgés de 0 à 1 j) ont été obtenus, dès leur émergence du grain, la veille ou le jour de l’expérience. Trente répétitions ont été réalisées pour chaque densité de grains de maïs utilisée et les boîtes ont été placées dans la chambre conditionnée. Après 10 j d’infestation, les adultes ont été retirés et nous avons dénombré les oeufs présents et le nombre de grains infestés, après coloration à l’acide fuschinique. Au niveau des densités de 8 et 32 grains de maïs, un adulte a été trouvé mort parmi les 30 répétitions. Par conséquent, les boîtes de Pétri concernées ont été éliminées de l’expérience. Les grains ont ensuite été laissés en incubation pendant 7 semaines jusqu’à l’émergence des adultes qui ont été dénombrés. Dans chaque boîte de Pétri, cinq adultes ont été prélevés au hasard pour la détermination du sexe. La séparation des sexes a été faite à partir des caractéristiques du rostre décrites par Halstead (1963). Le sexe-ratio a été exprimé par le nombre de mâles pour 100 femelles (Richards 1947). Chaque individu a été pesé à l’aide d’une micro-balance Sartorius (S.A. Sartorius instruments) de grande précision (charge maximale = 4 g, d = 0,0001 mg).
Analyses statistiques
Distribution des oeufs par grain
La répartition des oeufs en fonction de la densité des grains peut répondre à une des trois distributions suivantes : aléatoire (distribution de Poisson), contagieuse (distribution binomiale) et uniforme. Pour connaître le type de distribution des oeufs, nous avons utilisé comme indice de dispersion le rapport de la variance sur la moyenne (noté : V/M) du nombre d’oeufs pondus par grain. Selon Myers (1978), ce rapport a une valeur significative car c’est un bon indicateur de dispersion et il a l’avantage d’être facile à calculer et à comprendre. Un rapport V/M inférieur à 1 indique une distribution uniforme, un rapport de 1 indique une distribution de Poisson tandis que les valeurs qui sont significativement supérieures à 1 indiquent une ponte agrégative (Johannesen et Loeschcke 1996; Legg et al. 1987; Movery et al. 1980; Renshaw et al. 1995; White et Bennetts 1996; Zahner et Baum-gartner 1984; Zhang et al. 1993). Les distributions agrégatives sont décrites par la distribution binomiale négative, qui est caractérisée par deux paramètres : la moyenne et le paramètre k. Ce dernier est souvent utilisé comme indice d’agrégation. Plus ses valeurs sont faibles, plus l’agrégation est importante. Quand la distribution devient moins agrégée, la valeur de k devient plus grande. Ainsi, l’évaluation des valeurs de k indique si une distribution est aléatoire ou montre le degré d’agrégation. Une des méthodes les plus simples pour calculer k est d’utiliser une analyse de régression (Holloway 1984).
Nombre d’oeufs, émergence, poids des adultes et sexe-ratio
Les données (nombres d’oeufs pondus, nombre d’adultes émergés, poids des individus et sexe-ratio) ont été traitées statistiquement par une analyse de variance (ANOVA ou MLG lorsqu’il y avait des différences dans le nombre de répétitions), au moyen du logiciel Minitab Version 13 pour Windows. La transformation racine carrée a été utilisée afin d’homogénéiser les variances et de normaliser les données (Dagnelie 1975). Nous avons ensuite procédé à une comparaison des moyennes à l’aide du test de Tukey. Les résultats des tests statistiques sont considérés comme significatifs lorsque la probabilité de l’hypothèse nulle est inférieure ou égale à 5 %.
Résultats
Nombre d’oeufs pondus
Le nombre moyen d’oeufs pondus par femelle dans chaque traitement est présenté au tableau 1 en même temps que le nombre de grains infestés. Au regard des résultats, le nombre d’oeufs dénombrés peut sembler important lorsque le nombre de grains disponibles est élevé; en effet, les femelles ont pondu en moyenne 43, 39 et 36 oeufs respectivement pour les traitements contenant 32, 16 et 8 grains. L’analyse statistique (ANOVA à un critère de classification) indique cependant qu’il n’existe pas de différence significative (P = 0,070 ; F = 2,74; d.l. = 2, 85) entre les différents traitements.
Tableau 1
Effet de la densité de grains sur le nombre d’oeufs pondus par femelle et sur le nombre de grains infestés par des couples de S. zeamais élevés pendant 10 jours en présence de 8, 16 et 32 grains de maïs
a Dans une même colonne, les moyennes portant des lettres identiques ne sont pas significativement différentes suivant le test de Tukey (P < 0,05).
Proportion de grains infestés
Contrairement aux résultats obtenus avec le nombre d’oeufs pondus, l’analyse de variance indique qu’il existe une différence hautement significative entre les traitements (P = 0,0001 < 0,001; F = 50,12; d.l. = 2, 85). La proportion de grains infestés est inversement proportionnelle à la densité de grains de maïs. Dans le traitement contenant 8 grains de maïs, les femelles ont pondu dans plus de 95 % de ces grains comparativement à 86 et 69 % respectivement pour les traitements ayant 16 et 32 grains de maïs (Tableau 1).
Distribution des oeufs par grain
Les résultats des observations de la ponte sur chacun des grains mis à la disposition des femelles de chaque traitement indiquent que la distribution des oeufs par grain ne suit pas la loi de distribution normale (Tableau 2). En effet, les valeurs des chi-carré (x2) observés (respectivement 26,5; 24,0 et 23,7 pour les 8, 16 et 32 grains) sont supérieurs au chi-carré théorique (11,1 pour 5 d.l. et une valeur a de 0,05). La comparaison entre les x2 observés et le x2 théorique indique que la loi de Poisson ne s’ajuste pas à cette distribution. Les différents rapports de V/M (1,3; 1,1 et 1,1) étant supérieurs à 1, on considère qu’il y a agrégation de la ponte pour chaque quantité de grains mis à la disposition des femelles. Cette conclusion est confirmée par les différentes valeurs relativement faibles (respectivement 8,0; 11,3 et 8,4) de k. Néanmoins on constate que l’agrégation est plus importante lorsque le nombre de grains mis à la disposition de la femelle est faible.
Tableau 2
Fréquences de distribution des oeufs pondus par grains (a) par des couples élevés pendant 10 jours sur différentes densités de grains de maïs comparées avec les valeurs attendues (b) d’une distribution aléatoire (loi de Poisson)
a (a) fréquence observée; (b) fréquence attendue; (c) valeur du chi-carré pour un niveau de probabilité P = 0,05.
b V/M = rapport de la variance sur la moyenne.
Emergence des adultes
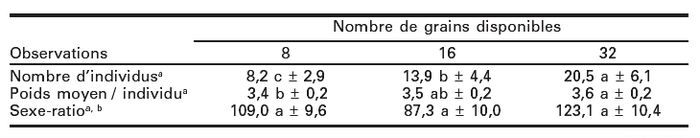
L’influence du nombre de grains disponibles sur l’émergence des adultes est résumée au tableau 3. Les résultats indiquent que le nombre d’individus émergés augmente avec la quantité de grains disponibles. Ces observations sont confirmées par l’analyse statistique (ANOVA) qui indique qu’il existe une différence hautement significative au niveau des traitements (P = 0,0001 < 0,001; F = 49,25; d.l. = 2, 85). Le plus grand nombre d’individus émergés (20) provient du lot de maïs contenant le plus grand nombre de grains (32). Le plus faible nombre d’individus obtenus (8) provient du lot de maïs contenant la plus faible quantité de grains de maïs (8).
Poids moyen des adultes
L’analyse de variance non orthogonale indique que le poids moyen des adultes est significativement différent (P = 0,014; F = 4,46; d.l. = 2, 158) entre les traitements. En effet, les individus provenant des lots contenant un nombre important de grains de maïs sont plus lourds (3,6 mg pour 32 grains) que ceux provenant de lots ayant un nombre plus faible de grains de maïs (3,5 mg pour 16 grains et 3,4 mg pour 8 grains) (Tableau 3).
Tableau 3
Nombre moyen (moyenne ± écart-type) d’adultes, poids moyen (mg) et sexe-ratio des individus produits par des couples vierges de S. zeamais élevés pendant 10 jours en présence de 8, 16 et 32 grains de maïs
a Pour chaque ligne, les moyennes portant des lettres identiques ne sont pas significativement différentes suivant le test de Tukey (P < 0,05).
b Nombre de mâles pour 100 femelles.
Sexe-ratio des adultes
Le sexe-ratio exprimé par le nombre de mâles pour 100 femelles, varie dans les différents traitements (Tableau 3). Cependant, l’analyse de variance indique qu’il n’existe pas de différence significative aussi bien entre les traitements (P = 0,968 > 0,05; F = 0,03; d.l. = 2, 170) que les sexes (P = 0,440 > 0,05; F = 0,60; d.l. = 1, 170). Il n’existe pas non plus d’interaction significative entre le nombre de grains disponibles et les sexes (P = 0,114 > 0,05; F = 2,20; d.l. = 2, 170).
Discussion
Nos résultats indiquent que lorsque le nombre d’oeufs pondus dans un milieu est déterminé par une femelle, S. zeamais tend à regrouper ses pontes sur les même grains. Les rapports V/M et l’indice d’agrégation k montrent que l’agrégation de la ponte est plus forte lorsque le nombre de grains disponibles est faible. Dans une première étude sur l’impact du nombre de grains sur la biologie de S. zeamais, Danho et al. (2002) ont montré que la distribution des oeufs par plusieurs femelles, sur différentes quantités de grains de maïs, se faisait de façon agrégative. Déjà, en 1987, Legg et al. avaient également démontré que le charançon du maïs avait tendance à regrouper ses oeufs sur les grains de maïs. Ils ont cependant indiqué que l’agrégation augmentait avec le nombre d’insectes et la durée de la période d’oviposition et/ou de nutrition bien que la réponse spécifique dépende de la densité des grains. Ceci est en accord avec nos résultats qui montrent que le nombre de grains ne semble pas avoir une influence sur le nombre total d’oeufs pondus par une seule femelle mais influence par contre la répartition des oeufs et le nombre de grains infestés. Les femelles utilisent le nombre de grains disponibles dans les différents traitements pour équilibrer le nombre d’oeufs pondus, ce qui fait que le nombre de grains infestés augmente avec la disponibilité des grains sans changer la fécondité totale des femelles. À l’inverse, Danho et al. (2002) ont observé que lorsque le nombre d’oeufs est pondu par plusieurs femelles, la ponte augmentait de façon proportionnelle à la quantité de grains disponibles. Ces deux résultats permettent donc de mettre en évidence une différence de comportement de ponte chez la femelle de S. zeamais, selon qu’elle est seule à infester un site de ponte ou qu’elle partage ce site avec d’autres femelles.
L’étude du comportement de ponte en relation avec les densités de grains utilisées a permis de comparer certains caractères biodémographiques des adultes. Les résultats obtenus varient en fonction de caractères étudiés. En ce qui concerne le sexe-ratio, il est resté globalement équilibré dans chaque traitement malgré les variations en faveur de l’un ou l’autre sexe. Le ratio, généralement proche de l’unité chez S. zeamais (Richards 1947), a été respecté. Le sexe-ratio n’est pas influencé par la quantité de grains disponibles lors de la ponte. Une variation de ce ratio en faveur de l’un ou l’autre sexe aurait eu pour conséquence une plus grande variation du succès reproducteur chez les uns que chez les autres.
Quant à l’émergence et au poids moyen des adultes, les résultats indiquent que l’agrégation de la ponte chez S. zeamais n’entraîne pas de bénéfices au niveau du nombre d’adultes émergés et réduit le poids de ces derniers (Tableau 3). En effet, la progéniture issue de femelles ayant accès à un grand nombre de grains est plus importante que celle de femelles étant en contact avec moins de grains. De plus, nous constatons une augmentation du poids des adultes proportionnellement à la densité des grains. La quantité de grains disponibles influence donc le poids des individus.
À première vue, le fait de pondre plusieurs oeufs sur un grain semble désavantageux, puisqu’il existe une corrélation négative avec le nombre d’individus émergés et le poids de ces derniers. Salt (1961) et van Alphen et Visser (1990) ont montré, chez des parasitoïdes, qu’un seul imago émerge du développement de plusieurs larves dans un même hôte; les autres larves ayant été tuées ou astreintes à de telles conditions qu’elles en sont mortes. Bellows Jr (1981) a également montré que chez les vers de farine (Tribolium castaneum (Hbst.) et T. confusum Duv.), la densité des oeufs était négativement corrélée au taux de survie larvaire. Par ailleurs, plusieurs études ont montré que le poids est positivement corrélé à la fécondité chez de nombreux insectes (Honek 1993; Klingenberg et Spence 1997; Maynard-Smith 1978; Richards 1947). Une densité excessive peut alors influencer le poids des descendants et donc la fécondité des femelles.
Comme la tendance à l’agrégation des oeufs sur les grains ne semble pas être liée aux conditions environnementales et comme aucune phéromone de ponte (ou anti-oviposition) n’a été mise en évidence chez les Sitophilus spp. (Giga et Smith 1985), une hypothèse adaptative liée à cette stratégie d’acquisition des ressources chez S. zeamais pourrait être émise. La compétition larvaire au niveau des grains peut être avantageuse pour la ou les larves survivantes; elles bénéficieraient ainsi d’un apport énergétique et génétique qui augmente le taux d’accroissement des adultes issus de la compétition (Smith et Lessells 1985; Stevens 1989; Via 1999). Ho et Dawson (1966) ont montré que chez les Tribolium spp. la compétition larvaire favorise une augmentation de la fécondité des adultes et est contrôlée génétiquement (Stevens 1989). Bien qu’il n’existe pas d’étude directe mettant en évidence cette situation chez S. zeamais, il est probable que les femelles se comportent comme les Tribolium spp.
Alors que les pontes multiples ont longtemps été considérées comme un comportement inadapté (Holloway 1984; Povey et Sibly 1992; Smith et Lessells 1985), ce n’est que récemment que la valeur adaptative de ce comportement a été reconnue (Parker et Courtney 1984; van Alphen et Visser 1990). Selon ces auteurs, les pontes multiples sont favorisées lorsque les bénéfices en terme de «fitness» liés à l’addition d’un oeuf sont profitables uniquement à ce dernier oeuf. Ils ajoutent que les bénéfices doivent être supérieurs aux coûts dus à la compétition que l’ajout d’oeuf peut engendrer. Pour vérifier cette hypothèse, nous sélectionnons actuellement, sur plusieurs générations, différentes lignées issues de grains portant un oeuf ou plusieurs oeufs. L’objectif de cette étude est de suivre l’évolution du comportement agrégatif de ponte, d’une part, et les principaux traits biodémographiques (taille de ponte, survie larvaire, durée de développement, fécondité potentielle des femelles, vigueur biologique, etc.), d’autre part, liés à ce comportement afin de comprendre l’avantage procuré par le choix de cette stratégie adaptative chez le charançon du maïs. Ces résultats devraient permettre de mieux comprendre les mécanismes évolutifs qui ont conduit les femelles, au cours des générations, à pondre les oeufs de manière agrégative plutôt que de les disperser.
Appendices
Remerciements
Les auteurs remercient monsieur Yves Brostaux, assistant à l’Unité de statistique et informatique, pour son conseil sur le choix des tests statistiques ainsi que les réviseurs anonymes pour leurs commentaires lors de la préparation de ce manuscrit. Monsieur M. Danho est boursier ivoirien de la Coopération technique belge (CTB).
Références
- Bellows Jr, T.S. 1981. The descriptive properties of some models for density dependence. J. Anim. Ecol. 50 : 139-156.
- Daan, S. et J.M Tinbergen. 1997. Adaptation of life histories. Pages 311-333 in J.R. Krebs et N.B. Davies (éds.), Behavioural ecology. An evolutionary approach. 4e Ed. Blackwell Science, Oxford.
- Dagnelie, P. 1975. Théorie et méthodes statistiques. Volume II : Les méthodes de l’inférence statistique. Presses Agronomiques de Gembloux, Belgique. 463 pp.
- Danho, M., C. Gaspar et E. Haubruge. 2002. The impact of grain quantity on the biology of Sitophilus zeamais Motschulski (Coleoptera : Curculionidae): oviposition, distribution of eggs, adult emergence, body weight and sex ratio. J. Stored Prod. Res. 38 : 259-266.
- Dobie, P. 1974. The laboratory assessment of the inherent susceptibility of maize varieties to post-harvest infestation by Sitophilus zeamais Motsch. (Coleoptera, Curculionidae). J. Stored Prod. Res. 10 : 183-187.
- Frankenfeld, J.C. 1948. Staining methods for detecting weevil infestation in grain. USDA Bull. Entomol. R Q. E-T. Series 256 : 1-4.
- Giga, D.P. et R.H. Smith. 1981. Varietal resistance and intraspecific competition in the cowpea weevils Callosobruchus maculatus and C. chinensis (Coleoptera : Bruchidae). J. Appl. Ecol. 18 : 755-761.
- Giga, D.P. et R.H. Smith. 1985. Oviposition markers in Callosobruchus maculatus (F.) and C. rhodesianus (Pic) (Coleoptera, Bruchidae): asymmetry of interspecific responses. Agric. Ecosyst. Environ. 12 : 229-233.
- Halstead, D.G.H. 1963. External sex differences in stored products Coleoptera. Bull. Entomol. Res. 54 : 119-134.
- Hawley, A.W. 1985. The effect of larval density on adult longevity of a mosquito, Aedes sierrensis: epidemiological consequences. J. Anim. Ecol. 54 : 955-964.
- Ho, F.K. et P.S. Dawson. 1966. Egg cannibalism by Tribolium larvae. Ecology 47 : 318-322.
- Holloway, G.J. 1984. Genetic differentiation and life history variation in the rice weevil, Sitophilus oryzae (L.). Thèse de Ph.D., University of Reading, Reading, UK. 156 pp.
- Holloway, G.J. 1985. The effect of increased grain moisture content on some life history characters of Sitophilus oryzae (L.) after staining egg plugs with acid fuchsin. J. Stored Prod. Res. 21 : 165-169.
- Honek, A. 1993. Intraspecific variation in body size and fecundity of insects: a general relationship. Oïkos 67 : 483-492.
- Johannesen, J. et V. Loeschcke. 1996. Distribution, abundance and oviposition patterns of four coexisting Chiastocheta species (Diptera : Anthomyiidae). J. Anim. Ecol. 65 : 567-576.
- Klingenberg, C.P. et J.R. Spence. 1997. On the role of body size for life-history evolution. Ecol. Entomol. 22 : 55-68.
- Klomp, H. 1964. Intraspecific competition and the regulation of insect numbers. Annu. Rev. Entomol. 9 : 17-40.
- Legg, D.E., R.J. Barney, P.W. Tipping et J.G. Rodriguez. 1987. Factors influencing the distribution of maize weevil (Coleoptera : Curculionidae) eggs on maize. Environ. Entomol. 16 : 809-813.
- Mangel, M., J.A. Rosenheim et F.R. Alder. 1994. Clutch size offspring performance and intergenerational fitness. Behav. Ecol. 5 : 412-417.
- Markham, R.H., N.A. Bosque-Pérez, C. Borgemeister et W.G. Meikle. 1994. Developing pest management strategies for Sitophiluszeamais and Prostephanustruncatus in the tropics. FAO Plant Prot. Bull. 42 : 97-116.
- Maynard-Smith, J. 1978. Optimization theory in evolution. Annu. Rev. Ecol. Syst. 7 : 247-251.
- McLagan, D.S. et E. Dunn. 1935. The experimental analysis of the growth of an insect population. Proc. R. Soc. Edinb. 55 : 126-139.
- Movery P.D., L.A. Hull et D. Asquith. 1980. Two new sampling plans for European red mite surveys on apple utilizing the negative binomial distribution. Environ. Entomol. 9 : 159-163.
- Myers, J.H. 1978. Selecting a measure of dispersion. Environ. Entomol. 7 : 619-621.
- Parker, G.A. et S.P. Courtney. 1984. Models of clutch size in insect oviposition. Theor. Popul. Biol. 26 : 27-48.
- Povey, S.R. et R.H. Sibly. 1992. No oviposition plasticity in Sitophilus oryzae. J. Stored Prod. Res. 28 : 11-14.
- Prout, T. et F. McChesney. 1985. Competition among immatures affects their adult fertility: population dynamics. Am. Nat. 126 : 521-558.
- Renshaw, M., J.B. Silver, M.W. Service et M.H. Birley. 1995. Spatial dispersion of larval Aedes cantans (Diptera : Culicidae) in temporary woodland pools. Bull. Entomol. Res. 85 : 125-133
- Richards, O.W. 1947. Observations on grain-weevils Calandra (Coleoptera : Curculionidae). I. General biology and oviposition. Proc. Zool. Soc. Lond. 117 : 1-43.
- Salt, G. 1961. Competition among insect parasitoids. Symp. Soc. Exp. Biol. 12 : 96-119.
- Schoonhoven, A.V., E. Horber et R.B. Mills. 1976. Conditions modifying expression of resistance of maize kernels to the maize weevil. Environ. Entomol. 5 : 163-168.
- Sharifi, S. 1972. Oviposition site and egg plug staining as related to development of two species of Sitophilus in wheat kernels. Z. Angew. Entomol. 71 : 428-431.
- Smith, R.H. et C.M. Lessells. 1985. Oviposition, ovicide and larval competition in granivorous insects. Pages 423-448 in R.M. Sibly et R.H. Smith (éds.), Behavioural ecology: Consequences of adaptive behaviour. Blackwell Scientific, Oxford.
- Stearns, S.C. 1992. The evolution of life histories. Oxford University Press, New York. 249 pp.
- Stejskal, V. et Z. Kucerova. 1996. The effect of grain size on the biology of Sitophilus granarius L. (Coleoptera : Curculionidae). I. Oviposition, distribution of eggs and adult emergence. J. Appl. Entomol. 120 : 143-146.
- Stevens, L. 1989. The genetics and evolution of cannibalism in flour beetles (genus Tribolium). Evolution 43 : 169-179.
- Throne, J.E. 1994. Life history of immature maize weevils (Coleoptera : Curculionidae) on corn stored at constant temperatures and relative humidities in the laboratory. Environ. Entomol. 23 : 1459-1471.
- Tilman, W. 1980. Resources: a graphical mechanistic approach to competition and predation. Am. Nat. 116 : 362-393.
- van Alphen, J.J.M. et M.E. Visser. 1990. Superparasitism as an adaptive strategy for an insect parasitoid. Annu. Rev. Entomol. 35 : 59-79.
- Via, S. 1999. Cannibalism facilitates the use of a novel environment in the flour beetle, Tribolium castaneum. Heredity 82 : 267-275.
- White, G.C. et R.E. Bennetts. 1996. Analysis of frequency count data using the negative binomial distribution. Ecology 77 : 249-255.
- Widstrom, N.M., W.W. McMillian et B.R. Wiseman. 1978. Improving effectiveness of measurements for seed resistance to maize weevil. J. Econ. Entomol. 71 : 901- 903.
- Zahner, P.H. et J. Baumgartner. 1984. Sampling statistics for Panonychus ulmi (Koch) (Acarina : Tetranychidae) and Tetranychus urticae Koch (Acarina : Tetranychidae) feeding on apple trees. Res. Popul. Ecol. 26 : 97-112.
- Zhang, Z.Q., P.R. Chen, K. Wang et X.Y. Wang. 1993. Overdispersion of Allothrombium pulvinum larvae (Acari : Trombidiidae) parasitic on Aphis gossypii (Homoptera : Aphididae) in cotton fields. Ecol. Entomol. 18 : 379-384.
List of tables
Tableau 1
Effet de la densité de grains sur le nombre d’oeufs pondus par femelle et sur le nombre de grains infestés par des couples de S. zeamais élevés pendant 10 jours en présence de 8, 16 et 32 grains de maïs
Tableau 2
Fréquences de distribution des oeufs pondus par grains (a) par des couples élevés pendant 10 jours sur différentes densités de grains de maïs comparées avec les valeurs attendues (b) d’une distribution aléatoire (loi de Poisson)
Tableau 3
Nombre moyen (moyenne ± écart-type) d’adultes, poids moyen (mg) et sexe-ratio des individus produits par des couples vierges de S. zeamais élevés pendant 10 jours en présence de 8, 16 et 32 grains de maïs