Abstracts
Résumé
Les traitements antirétroviraux de l’infection par le VIH sont responsables d’effets secondaires parfois sévères qui touchent en priorité le tissu adipeux, modifiant sa localisation (lipodystrophie avec lipoatrophie périphérique et hypertrophie centrale) et les paramètres du métabolisme glucido-lipidique (dyslipidémie, diabète). Les deux principales classes thérapeutiques, inhibiteurs de protéase et analogues nucléosidiques, sont délétères sur ces paramètres par des mécanismes différents mais qui convergent sur le tissu adipeux. Certaines des molécules de ces deux classes modifient profondément sa différenciation, son métabolisme, sa fonction mitochondriale et l’équilibre des hormones (leptine, adiponectine) et cytokines (TNFα, IL-6) qu’il sécrète. Ce syndrome de lipodystrophie induit un risque cardiovasculaire et de stéatohépatite grevant le pronostic vital. Le traitement reste difficile chez les patients atteints et privilégie le remplacement des molécules les plus délétères par des molécules antirétrovirales plus récentes et moins agressives sur le tissu adipeux.
Summary
HIV infection requires the continuous administration of antiretroviral molecules. Individual molecules belonging to the two main classes, protease inhibitors (PIs) and nucleoside analogues inhibitors of the viral reverse transcriptase (NRTIs) have been shown to be involved in deleterious side effects collectively called the lipodystrophy syndrome. This syndrome associates altered body fat repartition (peripheral lipoatrophy and visceral fat hypertrophy) and metabolic alterations (dyslipidemia, insulin resistance and diabetes). The pathophysiology of these alterations is complex but different studies argue for adipose tissue being a target of some PIs and NRTIs acting through different mechanisms. NRTIs are able to induce mitochondrial dysfonction and to modify adipocyte phenotype and adipose tissue pattern of secretion of cytokines (TNFα, IL-6) and other adipokines (adiponectin, leptin) probably through the production of reactive oxygen species. Some PIs also act on adipocyte, alter its differentiation and insulin sensitivity and also the pattern of secretion of adipokines by adipose tissue. These hypotheses could explain the loss of adipose tissue, while the mechanisms of visceral fat hypertrophy remain speculative. Since some adipokines and the free fatty acids released by adipocytes play a major role in the control of liver and muscles insulin sensitivity, these alterations are probably involved in the metabolic alterations seen in the patients. In addition, lipodystrophic adipose tissue could be involved in the increased lesions of atherogenesis and steatohepatitis presented by these patients. The treatment of lipodystrophy remains difficult and, at present, privileges the switch of the more deleterious drugs towards new molecules less aggressive for adipose tissue.
Article body
L’infection par le VIH constitue un problème important de santé publique : environ 100 000 patients sont infectés en France avec chaque année 6 000 nouvelles infections. Cette épidémie redoutable a pu être contrôlée dans les pays occidentaux grâce au développement de molécules antirétrovirales. La première classe thérapeutique disponible, celle des analogues nucléosidiques inhibiteurs de la réverse transcriptase virale (INTI), a permis de ralentir l’évolution de la maladie avec, en 1987, l’AZT (ou ZDV, zidovudine, un analogue de thymidine) suivie rapidement par d’autres molécules : analogues de thymidine comme le d4T (stavudine) ou d’autres bases comme la ddI (didanosine), la 3TC (lamivudine) et plus récemment ABC (abacavir) ou TDF (ténofovir, qui est en fait un analogue nucléotidique). L’utilisation de ces molécules a permis d’abaisser la charge virale et de ralentir la chute des lymphocytes CD4 et donc l’apparition des complications cliniques puis du stade Sida. Cependant, la grande majorité des patients mourraient de Sida dans un tableau d’immunodéficience sévère. Cette évolution s’accompagnait également d’un état de dénutrition marqué, le wasting syndrome, avec un amaigrissement massif touchant à la fois le tissu adipeux et les masses musculaires [1].
En 1996, une nouvelle classe thérapeutique est apparue sur le marché, celle des inhibiteurs de la protéase virale (IP). Les IP de première génération, associés à deux INTI dans le cadre de la « trithérapie », permettent d’obtenir des résultats très favorables sur la charge virale et le taux de CD4 et de transformer l’infection VIH en une infection chronique. Des patients au stade de Sida avancé et de pronostic très péjoratif retrouvent une espérance de vie. C’est dans ce contexte que sont décrites des modifications morphologiques avec redistribution du tissu adipeux (ou lipodystrophie) et des troubles métaboliques avec dyslipidémie et diabète. D’abord négligées chez ces patients, chez lesquels l’amaigrissement faisait partie du tableau évolutif attendu et où le bilan glucido-lipidique ne faisait pas partie de la surveillance de routine, ces anomalies s’imposent peu à peu par leur prévalence et leur survenue dans un cadre différent du Sida, chez des patients bien contrôlés pour leur infection virale.
La lipoatrophie, creusant le visage, est vécue comme un stigmate de la maladie VIH, affiché aux yeux de tous. Elle est parfois accompagnée d’une obésité viscérale créant un syndrome dysmorphique qui perturbe l’image sociale. Ce syndrome peut conduire le patient à une mauvaise observance de son traitement, augmentant le risque d’échappement thérapeutique. La responsabilité des molécules antirétrovirales est immédiatement suspectée, et celle des IP en premier lieu, du fait de la survenue de ces troubles peu après leur introduction. Les études de cohorte vont, un peu plus tard, faire porter la responsabilité en priorité aux INTI et surtout à la stavudine.
Plusieurs années après, la physiopathologie reste mal comprise, mais l’accent est mis sur l’agression du tissu adipeux par les molécules thérapeutiques appartenant aux deux principales classes utilisées chez les patients, agissant par des mécanismes différents mais probablement en synergie.
Clinique
La lipodystrophie est caractérisée par le type de redistribution du tissu adipeux et est souvent associée à des modifications des paramètres lipidiques et plus rarement glucidiques [2, 3] ((→) m/s 2001, n° 8-9, p. 889).
La lipoatrophie touche en priorité le tissu adipeux sous-cutané et va creuser le visage en faisant disparaître les boules de Bichat, atrophier le tissu adipeux des membres, laissant voir le réseau veineux, aplatir les fesses. Certaines régions vont être, au contraire, plutôt hypertrophiées en particulier la poitrine, le cou (avec parfois une bosse de bison) et l’abdomen du fait d’une augmentation du tissu adipeux viscéral. L’association des deux donne un syndrome mixte, caractéristique. Ce syndrome a une prévalence de l’ordre de 50 % chez les patients infectés. Cependant, sa prévalence et sa sévérité sont plus importantes chez les patients qui ont présenté dans leurs antécédents un stade avancé de la maladie et qui ont donc été traités plus longtemps, en particulier par la stavudine. Sa prévalence est plus faible chez les patients traités plus récemment, probablement du fait de l’utilisation de molécules moins agressives et de la plus courte durée de traitement cumulé.
Les troubles métaboliques sont souvent présents et leur nature dépend en partie des molécules thérapeutiques utilisées. Alors que la stavudine et surtout certains IP comme le ritonavir et le lopinavir donnent des dyslipidémies, l’indinavir va en priorité affecter le métabolisme glucidique et donner une résistance à l’insuline pouvant se compliquer d’un diabète [2, 3]. La présence même de la lipodystrophie avec lipoatrophie périphérique et surtout inflation du tissu adipeux viscéral, insulino-résistant, va également altérer secondairement les paramètres métaboliques. Le profil lipidique fréquemment trouvé chez ces patients est un profil athérogène avec augmentation des triglycérides et du cholestérol total, baisse du HDL-C, présence de LDL petites et denses. De fait, ces patients présentent un risque cardiovasculaire élevé. Par ailleurs, le risque de stéatohépatite associée au syndrome métabolique est accru.
Données in vitro
L’impact des molécules antirétrovirales a été testé depuis plusieurs années sur des modèles d’adipocytes en culture, soit adipocytes murins différenciés en culture grâce à un cocktail hormonal, comme les lignées 3T3-L1 et 3T3-F442A, soit lignées d’origine humaine qui demandent généralement un inducteur fort de différenciation de la classe thérapeutique des thiazolidinediones (TZD), agonistes du facteur de transcription PPARγ∈pour leur maturation adipocytaire.
De nombreuses fonctions du tissu adipeux ont été ainsi étudiées. Outre sa fonction de stockage lipidique pour une utilisation à distance des repas, le tissu adipeux a pris récemment de l’importance du fait de son rôle endocrine. En particulier, il secrète un nombre important de protéines, les adipokines, qui régulent, entre autres, le métabolisme énergétique en agissant soit au niveau local, soit à distance. L’adipocyte est entouré au sein du tissu adipeux de préadipocytes, de cellules endothéliales, de fibroblastes et de macrophages qui participent aux sécrétions de cytokines et chimiokines [4]. Ainsi, en fonction de son état physiologique ou pathologique, le tissu adipeux va moduler son spectre sécrétoire. Lorsque l’adiposité est bien répartie dans un cadre physiologique, la sécrétion d’adiponectine et de leptine permet le contrôle de la sensibilité à l’insuline et de la prise alimentaire et le tissu adipeux secrète peu de cytokines proinflammatoires. En revanche, dans des situations pathologiques comme l’obésité, ou en réponse aux molécules antirétrovirales, le tissu adipeux augmente sa production de TNFα ou d’IL-6 qui vont agir en retour sur l’adipocyte mais aussi à distance sur les muscles et le foie et participer à un état dysmétabolique et de résistance à l’insuline [5].
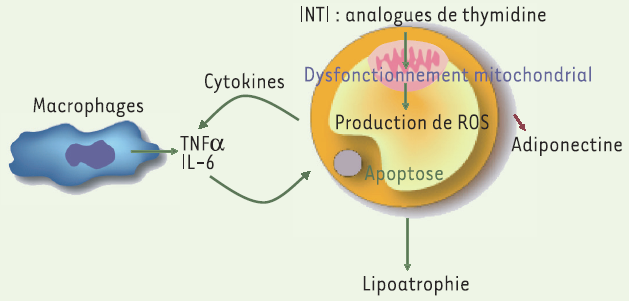
Les molécules antirétrovirales vont altérer l’adipocyte par plusieurs mécanismes. Les INTI sont connus pour induire une toxicité mitochondriale. Ces molécules inhibent l’ADN polymérase γ, seule présente dans les mitochondries, et bloquent ainsi la réplication de l’ADN mitochondrial (ADNmt). De ce fait, la synthèse des sous-unités des complexes de la chaîne respiratoire codées par cet ADN peut être diminuée, pouvant aboutir à un déficit en ATP. Une atteinte mitochondriale sévère a été rapportée chez certains patients traités par INTI. L’atteinte tissulaire est différente en fonction de la molécule et peut aboutir à un tableau clinique de myopathie, de neuropathie, d’hépatite voire d’acidose lactique parfois fatale. Le tissu adipeux peut être également une cible de la toxicité mitochondriale des INTI et de nombreux travaux mettent l’accent sur le rôle des analogues de thymidine et en particulier de la stavudine dans la lipoatrophie [6]. Les études in vitro ont objectivé la capacité de ces molécules à diminuer l’ADNmt et le potentiel mitochondrial des adipocytes 3T3-F442A en culture. Ils induisent un phénomène compensatoire de prolifération mitochondriale [7]. L’effet délétère sur la mitochondrie de ces molécules s’explique probablement plus par une augmentation du stress oxydant et de la production des dérivés réactifs de l’oxygène (ROS) que par un déficit en ATP. La stavudine et la zidovudine sont capables de modifier le profil de sécrétion des cytokines avec augmentation du TNFα et de l’IL-6 et diminution de l’adiponectine [8, 9]. Elles perturbent également l’expression du facteur central de l’adipogenèse, PPARγ∈[10]. Un schéma physiopathologique peut être proposé (Figure 1).
Figure 1
Mécanismes hypothétiques de l’effet délétère des analogues de thymidine sur l’adipocyte.
Stavudine et zidovudine pourraient induire un dysfonctionnement mitochondrial augmentant la production de dérivés réactifs de l’oxygène (ROS). Ceux-ci entraîneraient une augmentation de la sécrétion des cytokines TNFα et IL-6 qui en retour diminueraient l’expression de PPARγ∈et induiraient une apoptose aboutissant à une perte de tissu adipeux ou lipoatrophie. La diminution de sécrétion d’adiponectine modifierait la sensibilité à l’insuline du foie et des muscles.
Les études sur l’effet in vitro des IP montrent, de façon globale, qu’ils inhibent la différenciation adipocytaire et induisent une résistance à l’insuline, de façon variable selon la molécule. Les IP de première génération, comme l’indinavir ou le nelfinavir, ont un effet délétère marqué in vitro alors que le ritonavir et le lopinavir ont moins d’effet, et que les IP récemment mis sur le marché, comme l’amprénavir et l’atazanavir, ont très peu d’action délétère sur les adipocytes in vitro. Ces données sont globalement en bon accord avec les données cliniques. Un effet spécifique de l’indinavir et du nelfinavir a été montré sur le facteur de transcription SREBP-1 agissant en amont de PPARγ, aboutissant à une baisse de ces facteurs et donc de l’adipogenèse [11, 12]. Notre équipe a montré que ces IP inhibent la maturation de la prélamine A en lamine A, protéine nucléaire qui se dimérise avec les lamines de type B pour former le réseau filamentaire de la lamina [13]. La lamina joue un rôle important dans l’architecture du noyau, la division, mais également dans la régulation transcriptionnelle en interagissant avec SREBP-1. La lamine A subit une maturation par protéolyse par la métalloprotéase Zmpste24. Des mutations naturelles des gènes codant la lamine A/C et Zmpste24 chez l’homme donnent des tableaux de lipodystrophie et des syndromes de vieillissement accéléré dans le cadre d’un groupe de pathologies appelées laminopathies [14]. L’accumulation de prélamine A induit un vieillissement cellulaire, probablement du fait d’une instabilité génomique par hyperactivation de la voie p53 [15, 16]. La capacité de certains IP à inhiber la maturation de la prélamine A pourrait indiquer un potentiel de ces molécules à induire un vieillissement prématuré. Certains IP sont également capables de modifier la sécrétion des cytokines [8]. Un schéma physiopathologique peut être proposé (Figure 2).
Figure 2
Mécanismes hypothétiques de l’effet de certains inhibiteurs de la protéase virale (IP) sur l’adipocyte.
Certains IP sont capables d’inhiber la différenciation adipocytaire en altérant les facteurs de transcription dont SREBP-1 et PPARγ. Ils induisent également la production de ROS sans que le mécanisme en cause ne soit élucidé, ce qui pourrait participer à l’augmentation des cytokines pro-inflammatoires et à la baisse de l’adiponectine. Ils induisent une résistance à l’insuline qui conduit à une augmentation de la production d’acides gras libres.
La troisième classe thérapeutique utilisée chez ces patients est celle des analogues non nucléosidiques inhibiteurs de la transcriptase inverse ou INNTI, efavirenz et névirapine. In vitro, l’efavirenz inhibe la différenciation adipocytaire en inhibant SREBP-1, mais la névirapine n’a pas cette action [17].
Études in vivo
Les études épidémiologiques réalisées dans les cohortes de patients traités par des associations de molécules thérapeutiques ont montré, dans leur ensemble, que la survenue du syndrome de lipoatrophie périphérique était associée au traitement par INTI, stavudine en priorité, mais également zidovudine. Cependant, l’association avec certains IP, plus particulièrement ceux de première génération, est vraisemblablement responsable d’une évolution plus sévère de la lipoatrophie, suggérant que ces IP aggravent l’effet des INTI. Les études cliniques sur le devenir de la lipoatrophie après modification des traitements montrent une amélioration lente, demandant plusieurs années, de la lipoatrophie lorsque la stavudine (étude Tarheel) [18] ou la stavudine et la zidovudine (étude MITOX) [19] sont remplacées par de l’abacavir. Cependant, les malades qui récupèrent sont les moins sévèrement atteints et une lipoatrophie totale est souvent irréversible. Le remplacement des IP par d’autres molécules n’a pas permis de faire régresser la lipoatrophie.
Les études réalisées sur le tissu adipeux sous-cutané des patients traités par IP et INTI montrent une atteinte profonde de la morphologie du tissu adipeux (Figure 3) [20-22].
Figure 3
Altération morphologique du tissu adipeux sous-cutané des patients lipoatrophiques.
Le tissu adipeux est fibreux, avec des espaces inter-cellulaires marqués, de nombreux vaisseaux et des adipocytes de taille réduite. Certains adipocytes présentent plusieurs vacuoles lipidiques remplaçant la grande vacuole centrale (A et B). De nombreuses mitochondries sont présentes dans ces adipocytes (C et D). Une augmentation de l’apoptose est mise en évidence dans ce tissu. De façon remarquable, on observe des images de lipogranulome formé par des macrophages entourant des gouttelettes lipidiques (E et F) [22, 25]. C et D : coloration des mitochondries ; E et F coloration des macrophages (CD68).
Les images de lipogranulome avec infiltration macrophagique, proches de celles décrites dans le tissu adipeux des patients obèses, sont fortement en faveur d’un état inflammatoire à bas bruit de ce tissu [23, 24].
Les analyses moléculaires montrent dans le tissu adipeux des patients des anomalies de différenciation des adipocytes, un état de résistance à l’insuline et un dysfonctionnement mitochondrial [22]. L’expression des adipokines qui proviennent des adipocytes, mais également des cytokines qui proviennent probablement en priorité des macrophages tissulaires, est profondément altérée : l’expression de l’adiponectine et de la leptine est diminuée alors que celle du TNFα et de l’IL-6 est augmentée [22, 25] et corrélée à l’apoptose observée dans le tissu adipeux, ce qui est en faveur d’un rôle de ces cytokines dans ce processus. Le taux de l’ADNmt est diminué ainsi que l’expression des ARN codés par le génome mitochondrial. Cependant, une prolifération compensatrice des mitochondries permet de garder une fonction respiratoire normale. Ces résultats suggèrent que l’atteinte mitochondriale pourrait produire un excès de ROS qui modifieraient la production d’adipokines et de cytokines du tissu adipeux et favoriseraient la lipoatrophie. Ces modifications du tissu adipeux altéreraient la sensibilité à l’insuline de l’organisme du fait de la baisse de l’adiponectine et de l’augmentation des acides gras libres libérés par les adipocytes insulino-résistants.
Alors qu’aucune étude du tissu adipeux n’avait été réalisée chez des patients infectés par le VIH, mais naïfs de tout traitement anti-rétroviral à l’ère du wasting syndrome, avant la survenue des lipodystrophies, quelques études plus récentes ont utilisé comme groupe contrôle des patients infectés naïfs. Elles n’ont pas mis en évidence d’altération du tissu adipeux ni au plan morphologique, ni en ce qui concerne la sécrétion des cytokines, ni en terme de taux d’ADNmt [21, 26].
Hypertrophie centrale
Aucune étude, à ce jour, n’a apporté de données sur le tissu adipeux viscéral hypertrophié des patients infectés par le VIH. Il a été proposé que cette inflation permettrait de compenser la perte de tissu adipeux périphérique. Une hypothèse intéressante concerne le métabolisme du cortisol : le tissu adipeux viscéral est plus riche en récepteurs au cortisol que le tissu sous-cutané et aussi en 11β-hydroxy-stéroïde-déshydrogénase (11β-HSD1), enzyme capable de convertir la cortisone inactive en cortisol [27]. Le rôle du cortisol et de l’insuline dans la différenciation de préadipocytes humains viscéraux et sous-cutanés a été bien montré in vitro, mais seul le cortisol est capable d’augmenter l’expression et l’activité de la 11β–HSD1 dans ces cellules. De plus, la conversion de la cortisone en cortisol est plus importante dans les adipocytes viscéraux que dans les adipocytes sous-cutanés [28]. Le cortisol ou les autres corticoïdes sont capables de stimuler l’accumulation intracellulaire de lipides mais également d’induire une résistance à l’insuline et un déficit d’activation du transport du glucose via une activation de la voie p38 MAP-kinase [29]. Enfin, dans les adipocytes humains en culture, les glucocorticoïdes modifient l’équilibre des adipokines, diminuant la production d’IL-6 et d’adiponectine d’une part et augmentant celle de leptine, de façon synergique avec le TNF-α pour ce dernier effet [30, 31]. Les patients infectés par le VIH et présentant une hypertrophie du tissu adipeux viscéral ont souvent un déficit modéré en hormone de croissance ou en testostérone qui inhibent la 11β-HSD1 alors qu’elle est activée par le TNFα. Si le tissu adipeux viscéral produit, comme le tissu sous-cutané, un excès de TNF en réponse aux molécules antirétrovirales, on peut envisager une activation locale du système du cortisol aboutissant à une hypertrophie des adipocytes viscéraux insulino-résistants [5].
Conclusions et perspectives : l’avenir des traitements
Les molécules antirétrovirales induisent un syndrome lipodystrophique par des mécanismes physiopathologiques complexes et intriqués qui pourraient conduire à un état de vieillissement accéléré de l’organisme. Les traitements antirétroviraux, qui doivent être poursuivis pour maîtriser l’infection, jouent un rôle délétère. En évitant une immunodéficience sévère et une évolution fatale et rapide vers le SIDA, ces traitements pourraient entraîner à moyen terme des complications vasculaires, cardiaques et hépatiques grevant le pronostic vital.
Leur prévention passe par l’utilisation d’INTI et de PI de dernière génération efficaces, de prise simplifiée et présentant moins d’effets secondaires sur le tissu adipeux et le métabolisme ou de nouvelles classes thérapeutiques élargissant l’arsenal antiviral.
Alors que, au coeur de l’épidémie, on agissait vite et fort lors de la découverte de la séropositivité, les traitements sont actuellement entrepris plus tardivement, sont moins agressifs et excluent si possible les molécules les plus délétères comme la stavudine.
Le dépistage, la prévention et le traitement du risque métabolique (poussée d’hypertriglycéridémie sévère, diabète) et du risque cardiovasculaire font maintenant partie intégrante de la prise en charge des patients sous antirétroviraux. En dehors de l’utilisation de traitements spécifiques, chez les patients infectés depuis des années et présentant une lipodystrophie marquée, le traitement de celle-ci reste décevant. Pour la lipoatrophie, en dehors de la chirurgie plastique du visage, ce sont les changements thérapeutiques (avec exclusion de la stavudine) qui pour l’instant réussissent chez certains patients à faire réapparaître un peu de graisse sur les membres. L’utilisation des TZD a donné des résultats décevants pour la rosiglitazone alors que ceux de la pioglitazone sont attendus.
Alors que la majorité des patients infectés par le VIH dans le monde ne dispose pas actuellement de possibilité d’accéder à un traitement antiviral actif et meurt de Sida, les patients des pays occidentaux sont confrontés aux effets secondaires à long terme des thérapeutiques avec leurs complications cardiovasculaires et hépatiques, plus sévères dans cette population, mais assez semblables à celles du syndrome métabolique lié à une société de surconsommation.
Appendices
Références
- 1. Dworkin MS, Williamson JM. Adult/adolescent spectrum of HIV disease project. AIDS wasting syndrome : trends, influence on opportunistic infections, and survival. J Acquir Immune Defic Syndr 2003 ; 33 : 267-73.
- 2. Jain RG, Furfine ES, Pedneault L, et al. Metabolic complications associated with antiretroviral therapy. Antiviral Res 2001 ; 51 : 151-77.
- 3. Grinspoon S, Carr A. Cardiovascular risk and body-fat abnormalities in HIV-infected adults. N Engl J Med 2005 ; 352 : 48-62.
- 4. Mattison RE, Jensen M. The adipocyte as an endocrine cell. Curr Opin EndocrinolDiabetes 2003 ; 10 : 317-21.
- 5. Gougeon ML, Penicaud L, Fromenty B, et al. Adipocytes targets and actors in the pathogenesis of HIV-associated lipodystrophy and metabolic alterations. Antivir Ther 2004 ; 9 : 161-77.
- 6. Nolan D, Mallal S. Complications associated with NRTI therapy : update on clinical features and possible pathogenic mechanisms. Antivir Ther 2004 ; 9 : 849-63.
- 7. Caron M, Auclair M, Lagathu C, et al. HIV-1 nucleoside reverse transcriptase inhibitors stavudine and zidovudine alter adipocyte functions in vitro. AIDS 2004 ; 18 : 2127-36.
- 8. Lagathu C, Bastard JP, Auclair M, et al. Antiretroviral drugs with adverse effects on adipocyte lipid metabolism and survival alter the expression and secretion of proinflammatory cytokines and adiponectin in vitro. Antivir Ther 2004 ; 9 : 911-20.
- 9. Lagathu C, Kim M, Maachi M, et al. HIV antiretroviral treatment alters adipokine expression and insulin sensitivity of adipose tissue in vitro and in vivo. Biochimie 2005 ; 87 : 65-71.
- 10. Mallon PW, Unemori P, Sedwell R, et al.In vivo, nucleoside reverse-transcriptase inhibitors alter expression of both mitochondrial and lipid metabolism genes in the absence of depletion of mitochondrial DNA. J Infect Dis 2005 ; 191 : 1686-96.
- 11. Dowell P, Flexner C, Kwiterovich PO, Lane MD. Suppression of preadipocyte differentiation and promotion of adipocyte death by HIV protease inhibitors. J Biol Chem 2000 ; 275 : 41325-32.
- 12. Caron M, Auclair M, Vigouroux C, et al. The HIV protease inhibitor indinavir impairs sterol regulatory element-binding protein-1 intranuclear localization, inhibits preadipocyte differentiation, and induces insulin resistance. Diabetes 2001 ; 50 : 1378-88.
- 13. Caron M, Auclair M, Sterlingot H, et al. Some HIV protease inhibitors alter lamin A/C maturation and stability, SREBP-1 nuclear localization and adipocyte differentiation. AIDS 2003 ; 17 : 2437-44.
- 14. Vigouroux C. Laminopathies : lipodystrophies, insulin resistance, syndromes of accelerated ageing… and others. Ann Endocrinol (Paris) 2005 ; 66 : 270-8.
- 15. Liu B, Wang J, Chan KM, et al. Genomic instability in laminopathy-based premature aging. Nat Med 2005 ; 11 : 780-5.
- 16. Varela I, Cadinanos J, Pendas AM, et al. Accelerated ageing in mice deficient in Zmpste24 protease is linked to p53 signalling activation. Nature 2005 ; 437 : 564-8.
- 17. Hadri KE, Glorian M, Monsempes C, et al. In vitro suppression of the lipogenic pathway by the nonnucleoside reverse transcriptase inhibitor efavirenz in 3T3 and human preadipocytes or adipocytes. J Biol Chem 2004 ; 279 : 15130-41.
- 18. McComsey GA, Ward DJ, Hessenthaler SM, et al. Trial to assess the regression of hyperlactatemia and to evaluate the regression of established lipodystrophy in HIV-1-positive subjects (TARHEEL ; ESS40010) study team. Improvement in lipoatrophy associated with highly active antiretroviral therapy in human immunodeficiency virus-infected patients switched from stavudine to abacavir or zidovudine : the results of the TARHEEL study. Clin Infect Dis 2004 ; 38 : 263-70.
- 19. Martin A, Smith DE, Carr A, et al. Mitochondrial Toxicity Study Group. Reversibility of lipoatrophy in HIV-infected patients 2 years after switching from a thymidine analogue to abacavir : the MITOX Extension Study. AIDS 2004 ; 18 : 1029-36.
- 20. Domingo P, Matias-Guiu X, Pujol RM, et al. Subcutaneous adipocyte apoptosis in HIV-1 protease inhibitor-associated lipodystrophy. AIDS 1999 ; 13 : 2261-7.
- 21. Nolan D, Hammond E, Martin A, et al. Mitochondrial DNA depletion and morphologic changes in adipocytes associated with nucleoside reverse transcriptase inhibitor therapy. AIDS 2003 ; 17 : 1329-38.
- 22. Jan V, Cervera P, Maachi M, et al. Altered fat differentiation and adipocytokine expression are inter-related and linked to morphological changes and insulin resistance in HIV-1-infected lipodystrophic patients. Antivir Ther 2004 ; 9 : 555-64.
- 23. Weisberg SP, McCann D, Desai M, et al. Obesity is associated with macrophage accumulation in adipose tissue. J Clin Invest 2003 ; 112 : 1796-808.
- 24. Cancello R, Henegar C, Viguerie N, et al. Reduction of macrophage infiltration and chemoattractant gene expression changes in white adipose tissue of morbidly obese subjects after surgery-induced weight loss. Diabetes 2005 ; 54 : 2277-86.
- 25. Bastard JP, Caron M, Vidal H, et al. Association between altered expression of adipogenic factor SREBP1 in lipoatrophic adipose tissue from HIV-1-infected patients and abnormal adipocyte differentiation and insulin resistance. Lancet 2002 ; 359 : 1026-31.
- 26. Hammond E, Nolan D, McKinnon E, et al. Assessing the contribution of ART, HIV and host factors to changes occurring in adipose tissue of HIV-infected individuals : risk profile for lipoatrophy. Antivir Ther 2005 ; 10(suppl 3) : L4.
- 27. Stulnig TM, Waldhausl W. 11beta-Hydroxysteroid dehydrogenase Type 1 in obesity and Type 2 diabetes. Diabetologia 2004 ; 47 : 1-11.
- 28. Bujalska IJ, Kumar S, Hewison M, Stewart PM. Differentiation of adipose stromal cells : the roles of glucocorticoids and 11b-hydroxysteroid dehydrogenase. J Clin Endocrinol Metab 1999 ; 140 : 3189-96.
- 29. Bazuine M, Carlotti F, Tafrechi RS, et al. Mitogen-activated protein kinase (MAPK) phosphatase-1 and -4 attenuate p38 MAPK during dexamethasone-induced insulin resistance in 3T3-L1 adipocytes. Mol Endocrinol 2004 ; 18 : 1697-707.
- 30. Degawa-Yamauchi M, Moss KA, Bovenkerk JE, et al. Regulation of adiponectin expression in human adipocytes : effects of adiposity, glucocorticoids, and tumor necrosis factor alpha. Obes Res 2005 ; 13 : 662-9.
- 31. Trujillo ME, Lee MJ, Sullivan S, et al. Tumor necrosis factor (alpha) and glucocorticoid synergistically increase leptin production in human adipose tissue : role for p38 MAPK. J Clin Endocrinol Metab 2006 ; 10 janvier : online.
List of figures
Figure 1
Mécanismes hypothétiques de l’effet délétère des analogues de thymidine sur l’adipocyte.
Stavudine et zidovudine pourraient induire un dysfonctionnement mitochondrial augmentant la production de dérivés réactifs de l’oxygène (ROS). Ceux-ci entraîneraient une augmentation de la sécrétion des cytokines TNFα et IL-6 qui en retour diminueraient l’expression de PPARγ∈et induiraient une apoptose aboutissant à une perte de tissu adipeux ou lipoatrophie. La diminution de sécrétion d’adiponectine modifierait la sensibilité à l’insuline du foie et des muscles.
Figure 2
Mécanismes hypothétiques de l’effet de certains inhibiteurs de la protéase virale (IP) sur l’adipocyte.
Certains IP sont capables d’inhiber la différenciation adipocytaire en altérant les facteurs de transcription dont SREBP-1 et PPARγ. Ils induisent également la production de ROS sans que le mécanisme en cause ne soit élucidé, ce qui pourrait participer à l’augmentation des cytokines pro-inflammatoires et à la baisse de l’adiponectine. Ils induisent une résistance à l’insuline qui conduit à une augmentation de la production d’acides gras libres.
Figure 3
Altération morphologique du tissu adipeux sous-cutané des patients lipoatrophiques.
Le tissu adipeux est fibreux, avec des espaces inter-cellulaires marqués, de nombreux vaisseaux et des adipocytes de taille réduite. Certains adipocytes présentent plusieurs vacuoles lipidiques remplaçant la grande vacuole centrale (A et B). De nombreuses mitochondries sont présentes dans ces adipocytes (C et D). Une augmentation de l’apoptose est mise en évidence dans ce tissu. De façon remarquable, on observe des images de lipogranulome formé par des macrophages entourant des gouttelettes lipidiques (E et F) [22, 25]. C et D : coloration des mitochondries ; E et F coloration des macrophages (CD68).