Article body
L’urotensine II (UII) est un neuropeptide cyclique qui a été initialement isolé à partir de l’urophyse[1] ((→) m/s1999, n° 5, p. 709) des poissons téléostéens en raison de ses propriétés vasomotrices [1]. Par la suite, l’existence de l’UII a été établie chez l’ensemble des vertébrés et notamment chez l’homme [2-4]. Chez les tétrapodes qui, contrairement aux poissons, sont dépourvus d’urophyse, l’UII est produite presque exclusivement par les motoneurones de la moelle épinière et du tronc cérébral.
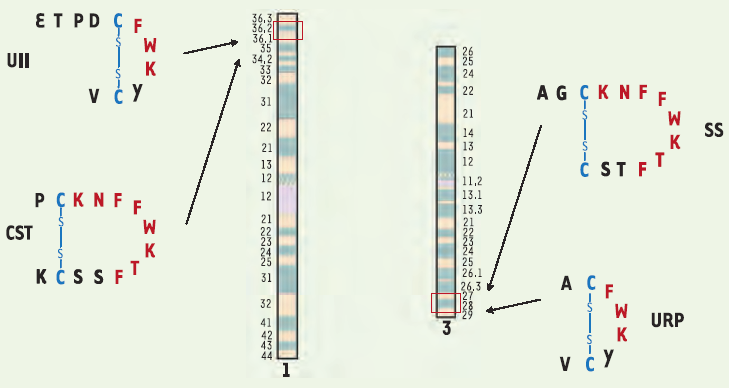
L’UII présente d’importantes similitudes de structure avec un autre peptide, la somatostatine (SS), à tel point, d’ailleurs, qu’elle a été initialement décrite comme un somatostatin-like peptide par ses découvreurs [1]. De fait, l’UII et la SS sont des molécules cycliques, de taille similaire, qui possèdent l’une et l’autre le motif Phe-Trp-Lys dans leur région cyclique (Figure 1). L’hypothèse selon laquelle l’UII et la SS seraient issues d’un même peptide ancestral a donc été proposée [1].
Figure 1
Comparaison de la structure des peptides apparentés à l’urotensine II (UII) et à la somatostatine (SS), ainsi que de la localisation de leurs gènes.
Elle a été toutefois rapidement abandonnée car il est apparu que les précurseurs de l’UII et de la SS, malgré une organisation générale similaire, ne présentaient quasiment aucune identité de séquence [3]. Par la suite, des variants de l’UII et de la SS, appelés respectivement UII-related peptide (URP) et cortistatine (CST) ((→) m/s 1996, n° 10, p. 1131), ont été découverts [5-7] (Figure 1), confortant l’idée selon laquelle ces peptides appartenaient à deux familles distinctes.
Lorsque les séquences de gènes apparentés sont trop divergentes, les méthodes classiques de la phylogénie moléculaire s’avèrent souvent inefficaces pour reconstituer leur histoire, voire même attester de leur origine commune. Il existe cependant un moyen de contourner le problème en examinant leur localisation chromosomique. En effet, lorsqu’un gène se duplique, la position relative des copies qu’il engendre dépend souvent directement du mécanisme de duplication qu’il a subi et peut donc, en retour, témoigner de la réalité de l’événement. La localisation des gènes sur leurs chromosomes est devenue une tâche relativement aisée, grâce aux données de séquençage et de cartographie accumulées chez de nombreuses espèces. Appliquées au cas de l’UII et de la SS, elles permettent aujourd’hui de proposer de nouvelles hypothèses sur l’origine de ces deux familles de neuropeptides [8].
La première ébauche de la séquence du génome humain a très vite permis de constater que les gènes de l’UII et de la CST sont situés au voisinage l’un de l’autre à l’extrémité du bras court du chromosome 1, en 1p36 (Figure 1) [8]. A l’époque toutefois, le gène de l’URP n’était pas encore connu, et la proximité des deux gènes pouvait être considérée comme fortuite. Cette hypothèse s’est néanmoins trouvée rapidement invalidée lorsque le gène de l’URP a été découvert, car sa localisation, en 3q28, s’est avérée extrêmement proche de celle du gène de la SS (Figure 1) [5]. Par la suite, il a été établi que les positions relatives de ces quatre gènes sont parfaitement conservées chez plusieurs autres espèces, notamment chez le poulet et le poisson zèbre [8].
De ces observations, il ressort que les gènes de la SS et de la CST, d’une part, et ceux de l’UII et de l’URP, d’autre part, ont été très probablement engendrés par duplication segmentaire (Figure 2). À l’appui de cette thèse, nous avons identifié chez l’homme plusieurs autres paires de gènes dupliqués, dont l’une des copies est localisée en 1p36 et l’autre en 3q28, démontrant ainsi que ces deux régions sont paralogues [8].
Figure 2
Modèle illustrant les processus évolutifs à l’origine des gènes de la famille de l’urotensine II (UII) et de la somatostatine (SS).
La localisation actuelle des gènes de l’UII et de l’URP, et de ceux de la SS et de la CST, suggère également que les deux gènes ancestraux dont ils dérivent étaient eux-mêmes vraisemblablement très proches l’un de l’autre, sur le même segment de chromosome. Il est peu probable que cette disposition soit le simple fait du hasard. Compte tenu des similitudes de structure entre les deux peptides évoquées précédemment, il est légitime d’attribuer la proximité de leur gène au résultat d’une duplication en tandem (Figure 2). Certes, les gènes de l’UII et de la CST, de même que ceux de la SS et de l’URP ne sont pas strictement disposés en tandem puisqu’ils sont séparés par plusieurs autres gènes sur une distance qui varie de 1,1 à 3,7 Mb suivant les espèces étudiées. Néanmoins, on peut parfaitement imaginer qu’ils ont été engendrés dans cette configuration en tandem puis ont été ensuite séparés par insertion de nouveaux gènes. Une autre possibilité serait que la duplication originelle n’ait pas affecté seulement le gène ancestral putatif de l’UII et de la SS mais tout un groupe d’autres gènes situés dans son voisinage. A l’appui de cette dernière hypothèse, nous avons identifié chez l’homme plusieurs autres paires de gènes en 1p36. Ils semblent donc avoir été dupliqués ensemble [8]. Quelle que soit l’hypothèse exacte, l’ensemble de ces observations plaide clairement en faveur d’une origine commune des gènes de l’UII et de la SS (Figure 2).
Il est par ailleurs intéressant de noter que la parenté des peptides de la famille de l’UII et de la SS peut être mise en parallèle avec celle de leurs récepteurs. En effet, le récepteur de l’UII (UTR) [4] et ceux de la SS, dont on connaît actuellement 5 sous-types (sst1-5) [9], appartiennent à la même famille des récepteurs à sept domaines transmembranaires couplés aux protéines G et partagent un taux de similarité relativement important. Or, chez l’homme, nous avons constaté que les gènes UTR et sst2 sont localisés dans la même région du chromosome 17, suggérant que les deux gènes proviennent également d’une duplication en tandem. Cette observation est en accord avec l’idée d’une co-évolution des gènes de la famille de l’UII/SS et des gènes codant leurs récepteurs.
Le moment exact où les gènes de l’UII et la SS sont apparus, puis à leur tour se sont dupliqués, est difficile à préciser. On peut cependant penser que la première duplication est antérieure à l’émergence des lamproies, car l’UII et la SS existent déjà dans ce groupe, alors que seule la SS est présente chez les myxines. Rappelons que les lamproies et les mixines, en tant que représentants du groupe des agnathes, sont considérées comme des descendants des vertébrés les plus primitifs, apparus il y a plus de 550 millions d’années. La seconde duplication, quant à elle, serait intervenue avant l’apparition des poissons osseux, puisque des séquences apparentées à l’URP et à la CST sont détectées à la fois chez le poisson-zèbre, le Fugu et le Tetraodon. Cette seconde duplication pourrait coïncider avec l’un des deux événements de tétraploïdisation qui est vraisemblablement intervenu chez les vertébrés, il y a 450 mA environ, et qui serait responsable de la diversification de nombreuses autres familles de neuropeptides [10].
À ce jour, ni l’UII ni la SS n’ont été identifiées chez les invertébrés. Pourtant, chez la drosophile, une étude récente a établi l’existence d’un gène apparenté à ceux codant les récepteurs de la SS, dont l’environnement chromosomique est homologue à celui des gènes sst3 et sst5 humains [11]. De façon intéressante, le récepteur codé par ce gène a pour ligand naturel un peptide cyclique, comme la SS, mais qui ne présente aucune autre similarité de structure avec elle [12]. La question actuellement non résolue est de savoir si ce peptide, qui appartient à la famille des allatostatines, est ou non apparenté à la SS. D’un point de vue fonctionnel, il est troublant de constater que, comme la SS, il est exprimé dans des cellules neuroendocrines et participe au contrôle de la croissance comme inhibiteur de sécrétions hormonales, en premier lieu, celle de l’hormone juvénile par les corps allates, d’où sa famille tire son nom.
Appendices
Note
-
[1]
Urophyse : organe neurosécréteur, analogue à la neurohyophyse, situé à l’extrémité caudale de la moelle épinière des poissons téléostéens.
Références
- 1. Pearson D, Shively JE, Clark BR, et al. Urotensin II : a somatostatin-like peptide in the caudal neurosecretory system of fishes. Proc Natl Acad Sci USA 1980 ; 77 : 5021-4.
- 2. Coulouarn Y, Lihrmann I, Jégou S, et al. Cloning of the cDNA encoding the urotensin II precursor in frog and human reveals intense expression of the urotensin II gene in motoneurons of the spinal cord. Proc Natl Acad Sci USA 1998 ; 95 : 15803-8.
- 3. Conlon JM, Tostivint H, Vaudry H. Somatostatin- and urotensin II-related peptides : molecular diversity and evolutionary perspectives. Regul Pept 1997 ; 69 : 95-103.
- 4. Lihrmann I, Bern HA, Vaudry H. Urotensin II and urotensin II-related peptide. In : Kastin AJ, ed. Handbok of biologically active peptides. Paris : Elsevier, 2006 ; 109 : 815-23.
- 5. Sugo T, Murakami Y, Shimomura Y, et al. Identification of urotensin II-related peptide as the urotensin II-immunoreactive molecule in the rat brain. Biochem Biophys Res Commun 2003 ; 310 : 860-8.
- 6. Tostivint H, Lihrmann I, Bucharles C, et al. Occurrence of two somatostatin variants in the frog brain : characterization of the cDNAs, distribution of the mRNAs, and receptor-binding affinities of the peptides. Proc Natl Acad Sci USA 1996 ; 93 : 12605-10.
- 7. de Lecea L, Criado JR, Prospero-Garcia O, et al. A cortical neuropeptide with neuronal depressant and sleep-modulating properties. Nature 1996 ; 381 : 242-5.
- 8. Tostivint H, Joly L, Lihmann I, et al. Comparative genomics provides evidence for close evolutionary relationships between the urotensin II and somatostatin gene families. Proc Natl Acad Sci USA 2006 ; 103 : 2237-42.
- 9. Olias G, Viollet C, Kusserow H, et al. Regulation and function of somatostatin receptors. J Neurochem 2004 ; 89 : 1057-91.
- 10. Conlon JM, Larhammar. The evolution of neuroendocrine peptides. Gen Comp Endocrinol 2005 ; 142 : 53-9.
- 11. Popovici C, Leveugle M, Birnbaum D, Coulier F. Coparalogy : physical and functional clusterings in the human genome. Biochem Biophys Res Commun 2001 ; 288 : 362-70.
- 12. Kreienkamp HJ, Larusson HJ, Witte I, et al. Functional annotation of two orphan G-coupled receptors, Drostar1 and -2, from Drosophola melanogaster and their ligands by reverse pharmacology. J Biol Chem 2002 ; 277 : 39937-43.
List of figures
Figure 1
Comparaison de la structure des peptides apparentés à l’urotensine II (UII) et à la somatostatine (SS), ainsi que de la localisation de leurs gènes.
Figure 2
Modèle illustrant les processus évolutifs à l’origine des gènes de la famille de l’urotensine II (UII) et de la somatostatine (SS).