Article body
Le mouvement dirigé au sein des cellules est assuré en grande partie par des moteurs moléculaires se déplaçant le long du cytosquelette (vaste réseau de filaments polarisés d’actine ou de microtubules). La superfamille des myosines correspond aux moteurs moléculaires se déplaçant le long de l’actine grâce à la conversion de l’énergie chimique (produite par l’hydrolyse de l’ATP) en énergie mécanique. Ces moteurs sont impliqués dans des processus cellulaires critiques comme la contraction musculaire, la cytocinèse et le transport vésiculaire. Le dysfonctionnement de ces moteurs peut entraîner des pathologies humaines graves, comme des cardiomyopathies, des surdités, ou la maladie de Griscelli qui est un désordre héréditaire rare caractérisé par un déficit pigmentaire pouvant conduire à la mort. Les myosines sont de grosses protéines (plus de 120 kDa) constituées : (1) d’une tête, ou domaine moteur, où se situe le site d’interaction au filament d’actine et le site de fixation et d’hydrolyse de l’ATP ; (2) d’un cou, ou bras de levier, de forme allongée, variable en longueur et constitué de motifs IQ capables de recruter des chaînes légères de type calmoduline ; et (3) d’une queue permettant l’interaction spécifique avec différents partenaires cellulaires (Figure 1). Une grande variabilité de séquence est observée au niveau des queues de myosine, ce qui correspond à une grande diversité de fonctions cellulaires associées à ces moteurs. Les différences de séquence au niveau du domaine moteur des myosines ont permis d’identifier à ce jour 18 classes distinctes.
Figure 1
Dimère de myosine VI.
Représentation schématique d’un dimère de myosine VI avec les domaines et sous-domaines annotés et indiqués par des couleurs différentes.
Certaines myosines s’assemblent pour former des filaments et produire une contraction ou un mouvement. D’autres, comme les myosines V, VI et IX, agissent en tant que molécules isolées et sont processives : elles sont capables d’effectuer plusieurs pas le long du filament d’actine avant de s’en détacher, ce qui leur permet d’être impliquées dans le transport de cargos tels que des protéines ou des vésicules. La processivité des myosines V et VI est assurée par l’association et la coordination de deux têtes moteur (Figure 1) qui leur permettent de « marcher » le long du filament d’actine avec au moins une tête toujours associée à l’actine.
La myosine VI, une myosine atypique
La myosine VI fait exception à plus d’un titre au sein de la superfamille de myosines. Alors que toutes les myosines se déplacent ou produisent un mouvement dirigé vers le bout (+) des filaments d’actine, la myosine VI se dirige en sens inverse [1]. Par ailleurs, la myosine VI ne semble pas suivre la « théorie du bras de levier » selon laquelle la distance parcourue le long du filament d’actine par une myosine est proportionnelle à la longueur de son bras de levier. En effet, la myosine VI effectue un pas de longueur aussi importante que celui de la myosine V alors qu’elle a un bras de levier six fois plus petit [2]. Cela est particulièrement surprenant étant donné la grande homologie de séquence au sein du domaine moteur entre ces deux myosines.
Différentes études ont été menées pour comprendre la directionnalité inversée de la myosine VI. Tout d’abord, il a été suggéré qu’une insertion spécifique de 39 résidus entre le domaine moteur et le bras de levier, présente uniquement chez la myosine VI, pourrait repositionner le bras de levier de façon à rediriger le mouvement en sens inverse [1]. Cependant, une étude faite avec des myosines chimériques composées en partie de myosine V et de myosine VI suggère que cette insertion n’est pas responsable de la directionnalité inversée de la myosine VI, et que le domaine moteur seul est suffisant pour cette inversion [3]. Par la suite, et de façon tout à fait inattendue, notre laboratoire a montré que cette insertion contient un site de très forte affinité pour une calmoduline pourvue de calcium [4], suggérant que cette insertion contribuerait à l’allongement du bras de levier.
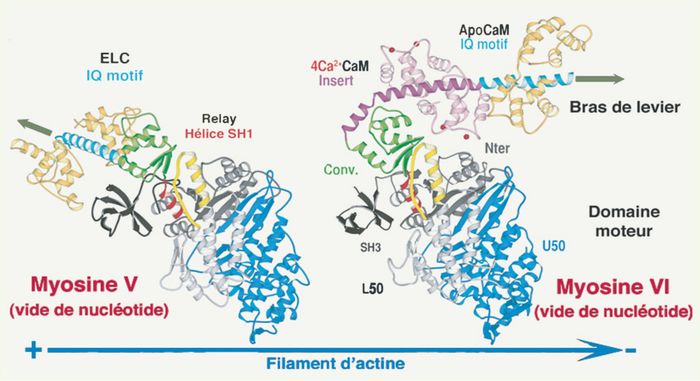
Pour identifier les éléments du moteur essentiels pour l’inversion du mouvement, nous avons déterminé la structure cristallographique de la myosine VI en l’absence de nucléotide dans un état proche de l’état de rigueur, c’est-à-dire un état de forte affinité pour l’actine, consécutif à la production de force [5]. Ainsi, il a été possible de faire une comparaison directe avec la structure de la myosine V précédemment décrite dans le même état [6]. Alors qu’aucune différence majeure n’a été observée au niveau du domaine moteur, le bras de levier de la myosine VI est redirigé dans la direction opposée de celui de la myosine V (Figure 2). Cela est possible grâce à l’insertion (Figure 2, en violet) dont la partie proximale au domaine moteur interagit étroitement et spécifiquement avec le convertisseur (région charnière entre le domaine moteur et le bras de levier 5 [Figure 2, en vert]) et le contourne. La calmoduline (Figure 2, en rose) recrutée par la partie distale de l’insertion interagit également avec le convertisseur et contribue au maintien de cette nouvelle direction. Dans le prolongement de l’insertion, le motif IQ du bras de levier (Figure 2, en turquoise) recrute une seconde calmoduline (Figure 2, en jaune) et s’étend vers le bout (-) du filament d’actine.
Figure 2
La structure de la myosine VI est comparée à la structure de la myosine V (gauche) dans le même état conformationnel (orientation et couleur identique).
Noter l’orientation opposée des bras de levier des myosines V et VI, celui de la myosine VI étant orienté vers le bout (-) du filament d’actine.
La structure de la myosine VI montre comment l’insertion redirige le bras de levier à l’opposé de celui de la myosine V vers le bout (-) du filament d’actine, biaisant ainsi la direction de la seconde tête du dimère vers cette même extrémité du filament. Cette observation révèle un rôle critique de l’insertion au niveau de la directionnalité inversée de la myosine VI. Toutefois, cette structure, décrivant l’état à la fin de la production de force, n’explique pas comment la myosine VI peut accomplir des pas aussi grands le long des filaments d’actine. En effet, un modèle de l’état précédant la production de force de la myosine VI (obtenu à partir de la structure d’une myosine II) indique que le déplacement du bras de levier le long du filament d’actine est plus court que celui mesuré in vitro par manipulation sur molécule unique [7] (Figure 3A). Cette modélisation suggère que les changements conformationnels de la myosine VI au cours de son déplacement sont différents de ceux observés pour les autres myosines. Un modèle proche de celui proposé pour la motilité des kinésines conventionnelles [8] pourrait être proposé pour la myosine VI (Figure 3B). Selon ce modèle, une région charnière entre le domaine moteur et le bras de levier qui est structurée et impose une position rigide au bras de levier au cours de la production de force (myosines fortement liées au filament d’actine) pourrait se déstructurer et permettre au bras de levier de se détacher du domaine moteur lorsque ce dernier est faiblement lié au filament d’actine. Ainsi, le bras de levier aurait la liberté nécessaire pour adopter une position optimale et permettre à la seconde tête d’atteindre un site d’interaction éloigné. Ce modèle est soutenu par une étude d’imagerie par fluorescence (FIONA) qui montre qu’une sonde placée au bout du bras de levier de la myosine VI décrit de larges fluctuations qui disparaissent lorsque la myosine VI est fortement liée à l’actine au moment de la production de force [9]. Bien que nous ne puissions pas éliminer l’hypothèse selon laquelle l’insertion unique soit cette région charnière, une autre région, l’hélice SH1, appartenant au domaine moteur et le reliant au convertisseur (Figure 3B, en rouge) a déjà été observée déstructurée dans la myosine II de coquille Saint-Jacques [10] et aurait par conséquent les propriétés structurales pour jouer ce rôle.
Figure 3
Modèles du déplacement du bras de levier de la myosine VI le long du filament d’actine.
Une représentation schématique fondée sur les structures cristallographiques des myosines V et VI dans l’état de rigueur (R : état consécutif à la production de force) est indiquée sans chaînes légères par simplification. A. En l’absence de structure cristallographique pour les myosines V et VI dans l’état de transition (T : état précédant la production de force), nous avons modélisé la position de leur bras de levier en tenant compte des mouvements observés pour la myosine II au cours de la production de force. Ainsi, la représentation schématique du bras de levier des myosines V et VI dans l’état de transition est superposée à celle de l’état de rigueur de façon à observer la position du bras de levier avant (T) et après (R) production de force. Noter que la myosine V produit une force de déplacement en direction du bout (+) du filament d’actine, alors que la myosine VI produit sa force en direction du bout (-). La distance mesurée entre les extrémités du bras de levier indique la longueur du déplacement produit par ces myosines. La myosine V produit un déplacement proche de celui mesuré expérimentalement. En revanche, la myosine VI a un déplacement nettement inférieur à celui mesuré expérimentalement (12 nm). B. De la même façon, nous avons représenté le déplacement du bras de levier de la myosine VI dans le cas où ce dernier se détacherait du domaine moteur (mécanisme apparenté à celui des kinésines conventionnelles). Dans ces conditions, le déplacement du bras de levier peut atteindre une longueur proche de 11 nm en direction du bout (-) du filament d’actine, comme cela a été mesuré expérimentalement.
Finalement, ce travail a élargit de façon conséquente notre connaissance des mécanismes moléculaires à la base de la motilité de la myosine VI. Maintenant, seule une structure supplémentaire de la myosine VI dans un état précédant la production de force permettra de décrire et comprendre dans le détail la directionnalité inversée de ce moteur tout à fait atypique.
Appendices
Références
- 1. Wells AL, Lin AW, Chen LQ, et al. Myosin VI is an actin-based motor that moves backwards. Nature 1999 ; 401 : 505-8.
- 2. Rock RS, Rice SE, Wells AL, et al. Myosin VI is a processive motor with a large step size. Proc Natl Acad Sci USA 2001 ; 98 : 13655-9.
- 3. Homma K, Yoshimura M, Saito J, et al. The core of the motor domain determines the direction of myosin movement. Nature 2001 ; 412 : 831-4.
- 4. Bahloul A, Chevreux G, Wells AL, et al. The unique insert in myosin VI is a structural calcium-calmodulin binding site. Proc Natl Acad Sci USA 2004 ; 101 : 4787-92.
- 5. Ménétrey J, Bahloul A, Wells AL, et al. The structure of myosin VI reveals the mechanism of directionality reversal for the myosin motors. Nature 2005 ; 435 : 779-85.
- 6. Coureux PD, Wells AL, Ménétrey J, et al. A structural state of the myosin V motor without bound nucleotide. Nature 2003 ; 425 : 419-23.
- 7. Rock RS, Ramamurthy B, Dunn AR, et al. A flexible domain is essential for the large step size and processivity of myosin VI. Mol Cell 2005 ; 17 : 603-9.
- 8. Rosenfeld SS, Fordyce PM, Jefferson GM, et al. Stepping and stretching : how kinesin uses internal strain to walk processively. J Biol Chem 2003 ; 278 : 18530-6.
- 9. Yildiz A, Park H, Safer D, et al. Myosin VI steps via a hand-over-hand mechanism with its lever arm undergoing fluctuations when attached to actin. J Biol Chem 2004 ; 279 : 37223-6.
- 10. Houdusse A, Kalabokis VN, Himmel D, et al. Atomic structure of scallop myosin subfragment S1 complexed with MgADP : a novel conformation of the myosin head. Cell 1999 ; 97 : 459-70.
List of figures
Figure 1
Dimère de myosine VI.
Figure 2
La structure de la myosine VI est comparée à la structure de la myosine V (gauche) dans le même état conformationnel (orientation et couleur identique).
Figure 3
Modèles du déplacement du bras de levier de la myosine VI le long du filament d’actine.
Une représentation schématique fondée sur les structures cristallographiques des myosines V et VI dans l’état de rigueur (R : état consécutif à la production de force) est indiquée sans chaînes légères par simplification. A. En l’absence de structure cristallographique pour les myosines V et VI dans l’état de transition (T : état précédant la production de force), nous avons modélisé la position de leur bras de levier en tenant compte des mouvements observés pour la myosine II au cours de la production de force. Ainsi, la représentation schématique du bras de levier des myosines V et VI dans l’état de transition est superposée à celle de l’état de rigueur de façon à observer la position du bras de levier avant (T) et après (R) production de force. Noter que la myosine V produit une force de déplacement en direction du bout (+) du filament d’actine, alors que la myosine VI produit sa force en direction du bout (-). La distance mesurée entre les extrémités du bras de levier indique la longueur du déplacement produit par ces myosines. La myosine V produit un déplacement proche de celui mesuré expérimentalement. En revanche, la myosine VI a un déplacement nettement inférieur à celui mesuré expérimentalement (12 nm). B. De la même façon, nous avons représenté le déplacement du bras de levier de la myosine VI dans le cas où ce dernier se détacherait du domaine moteur (mécanisme apparenté à celui des kinésines conventionnelles). Dans ces conditions, le déplacement du bras de levier peut atteindre une longueur proche de 11 nm en direction du bout (-) du filament d’actine, comme cela a été mesuré expérimentalement.