Abstracts
Résumé
Le paludisme est responsable de plus de deux millions de décès par an, essentiellement en Afrique. Chez l’homme, le parasite infecte à la fois les hépatocytes et les érythrocytes, mais la symptomatologie de la maladie est seulement associée à l’infestation des globules rouges. Les érythrocytes matures sont à la fois incapables de synthèse de novo de protéines et dépourvus de tout type de transport intracellulaire. Aussi, pour sa survie, le parasite doit-il développer non seulement son propre transport vésiculaire, mais aussi un système membranaire qui lui permet de transporter les substances, dont les antigènes variants, jusqu’à la surface de l’érythrocyte. Quoique semblables au transport vésiculaire des mammifères dans leur régulation par les Rab GTPases, les systèmes membranaires développés par le parasite lui sont spécifiques et occupent même le cytosol de l’érythrocyte. La contribution des Rab codées par le parasite dans ce réseau sécrétoire élaboré est examinée dans cet article.
Summary
To survive within erythrocytes, Plasmodium parasites have to put into place different membrane and sub-cellular compartments in order to import different nutrients and to export proteins/antigens. Infected cells pose not only a major world health risk by killing two million people per year, but also a very interesting cell biology problem, as within the erythrocyte the parasite resides inside a vacuole called the parasitophorous vacuole and as a consequence, it is separated from the blood stream by three membrane barriers, its own plasma membrane, the parasitophorous vacuole membrane and the erythrocyte plasma membrane. In spite of these three barriers the parasite is capable of secreting antigens and importing nutrients, and to do this, it has developed a complex vesicular system that extends into the red blood cell cytoplasm to the plasma membrane. Understanding how the parasite controls this extensive vesicular traffic has driven research into Plasmodium Rabs, whose potential role is discussed.
Article body
Plasmodium, l’agent du paludisme, est transmis à l’homme par la piqûre d’un moustique, l’anophèle. Le parasite (sporozoïte) va très vite atteindre le foie et s’y développer pour donner des milliers de mérozoïtes qui seront relargués dans la circulation sanguine pour infecter les globules rouges et entamer un cycle de multiplication dit intra-érythrocytaire[1], qui correspond à la phase symptomatique de la maladie. En effet, après développement à l’intérieur des érythrocytes, les nouveaux mérozoïtes sont libérés par rupture de la membrane des globules rouges toutes les 48 heures (durée du cycle de P.falciparum, l’espèce la plus redoutable pouvant entraîner un neuropaludisme mortel) et infectent de nouveaux érythrocytes.
En se développant à l’intérieur des globules rouges, le parasite se trouve dans un environnement peu hospitalier. En effet, ces cellules anucléées, dépourvues d’organites intracellulaires, incapables de synthèse de novo, ne disposent pas de machinerie d’endocytose. La survie de Plasmodium exige donc la mise en place de compartiments membranaires afin, d’une part, d’importer des nutriments du milieu extérieur et, d’autre part, d’exporter de nombreuses protéines jusqu’à la surface du globule rouge. Aussi, pour se développer et proliférer après infection des érythrocytes, le parasite effectue-t-il des transformations essentielles, à la fois lipidiques et protéiques, dans l’organisation même de la cellule hôte.
Comment le parasite s’organise-t-il pour assurer le trafic des protéines parasitaires ? Quelles sont les protéines impliquées dans la formation des vésicules à l’origine du trafic dynamique à l’intérieur du parasite et au-delà de sa membrane ? Quelles molécules régulent ce trafic intense ? Cet article se propose d’apporter des réponses à ces différentes questions.
Compartiments membranaires de l’érythrocyte infecté
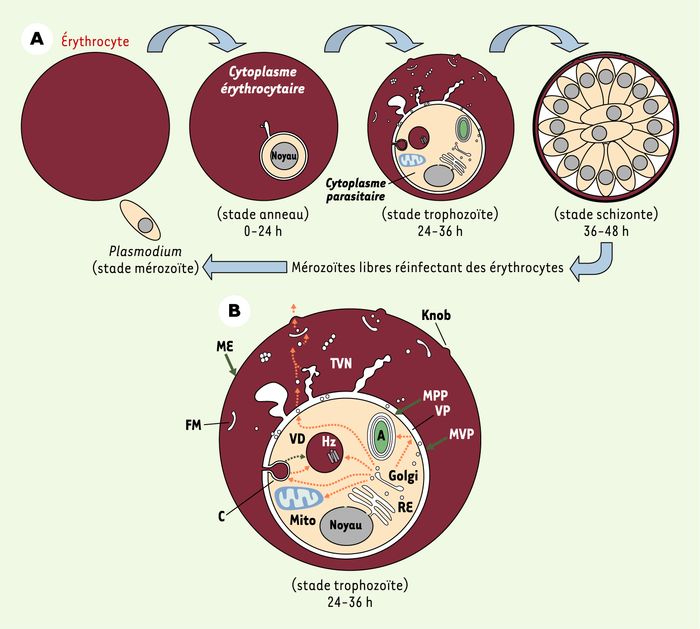
Au moment de l’invasion de l’érythrocyte, le parasite, lui-même bordé par sa membrane plasmique (MPP), s’entoure d’une vacuole parasitophore (VP) dont la membrane (MVP) forme une barrière entre le parasite et le cytoplasme de l’érythrocyte (Figure 1A) [1]. La MPP et la MVP sont capables de s’invaginer pour former le cytostome, une vacuole d’endocytose qui permet au parasite de capturer l’hémoglobine du globule rouge dont il se nourrit (Figure 1B).
Figure 1
A. Développement de Plasmodium lors de son cycle intra-érythrocytaire. Lors de son développement dans les globules rouges, Plasmodium évolue en trois étapes. Le stade mérozoïte, issu de la prolifération initiale du parasite dans le foie, est capable d’infecter un érythrocyte. Il va s’enfermer dans une vacuole parasitophore (stade anneau). Au stade trophozoïte, la néosynthèse de ses protéines est intense et leur trafic efficace via de nombreux compartiments membranaires que le parasite étend dans le cytosol du globule rouge. Le parasite se développe ensuite en schizonte, et celui-ci se divise pour donner de nombreux mérozoïtes, lesquels, après rupture de la membrane érythrocytaire, vont pouvoir infecter d’autres érythrocytes. B. Ultrastructure schématique de l’érythrocyte infecté. Au stade trophozoïte, le parasite contient des organites internes comme le noyau, le réticulum endoplasmique (RE), le Golgi, une mitochondrie (Mito), un apicoplaste (A), un cytostome (C), lequel fusionne avec la vacuole digestive (VD) dans laquelle l’hémoglobine est dégradée en un déchet, le pigment malarique dit hématine ou hémozoïne (Hz). Le parasite, entouré d’une membrane plasmique (MPP), est logé dans une vacuole parasitophore (VP) dont la membrane (MVP) peut se différencier en structures membranaires et vésiculaires (TVN) comme les fissures de Maurer (FM). Le parasite adresse de nombreuses protéines parasitaires via ces structures jusqu’à la membrane du globule rouge (ME), au niveau de laquelle celles-ci forment des protubérances (Knob) impliquées dans la cytoadhérence de Plasmodium dans les vaisseaux sanguins, phénomène responsable notamment du neuropaludisme. Les flèches en orange décrivent succinctement les chemins qu’empruntent les protéines parasitaires pour être adressées dans les compartiments du parasite, ou bien à partir de la vacuole parasitophore vers le cytosol du globule et au-delà de sa membrane.
À l’intérieur du parasite, on retrouve des compartiments impliqués dans la synthèse et la maturation des protéines parasitaires tels qu’un réticulum endoplasmique (RE) et un Golgi rudimentaire. à partir de ces organites, les protéines sont soit adressées à l’intérieur même du parasite vers d’autres organites, soit exportées dans le cytosol et dans la membrane du globule rouge via des structures membranaires intra-érythrocytaires d’origine parasitaire. Ces structures se présentent sous forme de diverses invaginations tubulaires sinueuses, de larges boucles, de vésicules libres, ou bien sous forme de chaînette, ou de crevasses (fissures de Maurer) [2]. Certains auteurs les regroupent sous le nom de réseau tubulovésiculaire (ou TVN, tubulovesicular network) qu’ils supposent continu [3]. Ce réseau, qui émerge de la MVP, s’étend profondément à l’intérieur du cytoplasme de la cellule hôte au stade trophozoïte (Figure 1B) [4]. Cependant, d’autres auteurs montrent que ce sont de petites vésicules initialement libres qui progressivement s’assemblent en multimères hautement organisés, comme les fissures de Maurer, et forment ainsi un réseau membranaire qui serait en définitive étendu mais non continu [5].
Trafic protéique intraparasitaire
Les protéines synthétisées par le parasite sont dirigées vers le compartiment où leurs fonctions sont nécessaires. Leur adressage s’effectue par l’intermédiaire d’une séquence signal classique (hydrophobe) à l’extrémité aminoterminale, permettant initialement aux protéines de suivre la voie sécrétoire RE/Golgi de type eucaryote (Figure 1B) [6]. Selon la destination finale de la protéine, les signaux d’adressage sont ensuite plus ou moins complexes.
En direction de l’apicoplaste (un organite parasitaire issu vraisemblablement d’une endosymbiose secondaire), le processus s’effectue en deux étapes [7]. La préséquence aminoterminale bipartite comprend non seulement le peptide signal classique de type RE/Golgi, mais aussi un signal de ciblage à l’apicoplaste SS-PTS (signal sequence plastid targeting signal) similaire au peptide de transit retrouvé chez les plantes [8]. En fait, les protéines seraient adressées du RE vers la MVP puis finalement importées vers le parasite et délivrées à l’apicoplaste [9]. En revanche, l’adressage des protéines à la mitochondrie nécessiterait des peptides de transit mitochondriaux (mTP) qui diffèrent considérablement de ceux observés chez d’autres organismes [10]. Vers la vacuole digestive parasitaire, certaines protéines de dégradation de l’hémoglobine sont adressées sous forme de proenzyme contenant un signal hydrophobe interne. Cette séquence signal leur permet une intégration membranaire dans le RE suivie d’un transport au cytostome. La vacuole cytostomale fusionne ensuite avec la vacuole digestive dans laquelle le signal est clivé pour libérer une enzyme mature et active [11]. Certaines protéines sont cependant adressées directement du RE à la vacuole digestive [38].
Exportation des protéines parasitaires vers l’érythrocyte
La vacuole parasitophore : un compartiment de transit
Chez Plasmodium, le trafic protéique implique un certain niveau de sophistication puisque le parasite vit dans une vacuole parasitophore à l’intérieur même du globule rouge. Les protéines destinées au cytosol ou à la membrane du globule rouge empruntent d’abord la voie sécrétoire RE/Golgi puis sont délivrées à la vacuole parasitophore (Tableau I). L’exportation au-delà de la VP nécessite ensuite une information supplémentaire dont l’existence reste sujette à controverses. Les protéines sécrétées seraient transloquées à travers la MVP via un transporteur dépendant de l’ATP [12]. Cette étape dépendante de l’ATP serait donc critique pour l’exportation et conduirait à l’accumulation provisoire de ces protéines dans l’espace vacuolaire jouant le rôle de compartiment de transit [13].
Tableau I
Caractéristiques de quelques protéines de P. falciparum adressées à l’intérieur du parasite et/ou exportées vers le globule rouge.
Cette liste non exhaustive de protéines parasitaires, adressées à l’intérieur du parasite ou vers le cytosol et la membrane du globule rouge, donne un aperçu global de l’intérêt du trafic des protéines parasitaires selon le compartiment final dans lequel elles exercent leurs fonctions. VD : vacuole digestive ; RE : réticulum endoplasmique ; GR : globule rouge ; FM : fissures de Maurer ; VP : vacuole parasitophore ; PfEMP1 : P. falciparum erythrocyte membrane protein 1.
Certains auteurs suggèrent qu’une séquence signal serait indispensable pour retenir les protéines dans la VP, alors que l’exportation des protéines vers le cytosol érythrocytaire ne serait en définitive qu’une voie par défaut [14].
À l’inverse, selon d’autres travaux, la voie de sécrétion par défaut concernerait le transit jusqu’à la VP, et une séquence signal serait indispensable à l’exportation au-delà de la VP [15, 16]. Une fois dans le cytosol érythrocytaire, les protéines seraient transportées à la face cytoplasmique des fissures de Maurer et finalement à la membrane de l’érythrocyte [16].
Cependant, d’autres travaux ont mis en évidence un signal tripartite dont les différents domaines contribuent ensemble à l’adressage des protéines de la VP au cytoplasme de la cellule hôte. Ces domaines comprennent une séquence signal de type RE suivie d’un signal de translocation vacuolaire (VTS) bipartite. La sortie des protéines à la face cytoplasmique de l’érythrocyte, déterminée par le VTS, pourrait se produire non pas à partir de la VP, mais directement à partir des fissures de Maurer [17].
Récemment, un motif PEXEL, présent dans près de 400 protéines différentes représentant 8 % de toutes les séquences codantes, a été décrit comme indispensable pour le passage des protéines au-delà de la MVP : il définirait un signal de liaison aux protéines chaperons. Ce motif est absent dans les protéines d’autres parasites du globule rouge, comme Theileria, qui est d’ailleurs dépourvu de MVP. Ce motif étant plus ou moins conservé au sein de toutes les espèces de Plasmodium, il pourrait représenter une voie de ciblage des protéines dans le cytosol des globules rouges [36, 37].
Mouvement des vésicules
Le tri entre les protéines destinées à la membrane érythrocytaire et celles résidentes de la VP s’effectue par bourgeonnement de la MVP [18]. Ce sont des vésicules recouvertes qui, à partir de régions spécialisées de la VP, permettent le transport des protéines sécrétées à travers le cytoplasme érythrocytaire [16, 19]. Les vésicules peuvent soit fusionner directement avec la membrane plasmique de l’érythrocyte, soit effectuer un passage intermédiaire dans les fissures de Maurer avant d’accéder à la membrane érythrocytaire et/ou au cytosquelette sous-membranaire [18, 19]. Le déplacement des vésicules dépendrait d’un processus actine/myosine similaire à celui des mammifères [19], alors que les fissures de Maurer ne diffuseraient pas librement à l’intérieur du cytoplasme érythrocytaire [20], attachées à la membrane du globule rouge notamment via l’actine [19].
De plus, des agrégats appelés inclusions intra-érythrocytaires serviraient de points de transit pour les protéines en route vers la surface du globule rouge [5]. Des protéines chaperons de la cellule hôte seraient associées à ces inclusions intra-érythrocytaires [21] et faciliteraient le transport et l’assemblage des protéines parasitaires destinées à la membrane érythrocytaire [12].
Enfin, des protéines membranaires pourraient être adressées au cytosol du globule rouge via une classe distincte de vésicules à double membrane qui bourgeonnent à partir du RE, fusionnent à la MPP et bourgeonnent à la MVP. Ce mécanisme permettrait l’exportation, dans le cytosol érythrocytaire, de compartiments membranaires entiers provenant de l’intérieur du parasite [22].
Formation des vésicules
Le système de vésicules mobiles à l’intérieur du globule rouge infecté met en jeu des protéines COPII qui induiraient le bourgeonnement des vésicules à partir de la VP pour le transport des protéines à la membrane érythrocytaire [19, 23]. En revanche, à la différence de COPII qui se trouve à la fois dans le parasite (transport antérograde du RE/Golgi à la VP) et dans le cytosol érythrocytaire, COPI permet uniquement un transport rétrograde des protéines à partir du Golgi vers le RE. COPI ne jouant aucun rôle dans le secteur externe de la voie de trafic, le trafic vésiculaire des protéines à travers le cytosol érythrocytaire serait donc unidirectionnel [15]. Le NSF (N-ethylmaleimide sensitive factor), qui fait partie du complexe de fusion/arrimage des vésicules chez les eucaryotes, participerait également au trafic intra-érythrocytaire [24].
Régulation du trafic
Protéines Rab
Les protéines Rab, membres de la superfamille Ras, sont impliquées dans la régulation du transport vésiculaire [25]. La famille entière des Rab de P. falciparum vient d’être décrite avec dix gènes exprimés dans les érythrocytes infectés et un gène (Pfrab11b) qui semble spécifique d’un autre stade de développement du parasite (voirTableau II, pour les fonctions potentielles) [26].
Tableau II
Fonctions potentielles des protéines Rab de Plasmodium falciparum dans le transport vésiculaire.
Les Rab sont associées aux membranes après prénylation de leur extrémité carboxyterminale (des di-peptides CXC ou CC) par une enzyme parasitaire [27]. Le recyclage des vésicules d’une membrane donneuse à la membrane accepteuse dépend des protéines Rab dans une conformation liant le GDP, et en association avec un transporteur appelé rabGDI dont le gène correspondant (Pfrabgdi) a été isolé chez le parasite [28]. Plasmodium semble donc capable de coder pour certains des effecteurs nécessaires au recyclage des Rab.
Fonctions potentielles des Rab
La famille Rab étant limitée à onze gènes chez P. falciparum, P. berghei et S. cerevisiae, et à sept gènes chez S. pombe, une comparaison entre les trois espèces peut permettre de cerner la fonction d’une protéine Rab du parasite [26]. Pour démontrer l’homologie entre les Rab du parasite (P. falciparum et P. berghei) et les deux espèces de levure, nous avons construit une arbre phylogénique (Figure 2). Ainsi, PfRab6 et PfRab7 sont clairement les orthologues de SpRyh1-ScYpt6 et SpTyp7-ScYpt7, respectivement. L’inactivation du gène ScYpt7 entraîne une fragmentation des vacuoles chez la levure [29]. Il est donc possible que PfRab7 joue un rôle dans la régulation de la taille, soit de la vacuole parasitophore (VP) entourant le parasite, soit de la vacuole digestive ; l’expression tardive du gène dans le globule rouge infecté conforte cette idée [26].
Figure 2
Arbre phylogénétique entre Rab parasitaires et Rab de levures.
Les differents Rab des parasites, P. berghei (Pb) et P. falciparum (Pf), et les Rab de deux levures (S. cerevisiae et S. pombe) sont homologues et forment des clad (groupements sur une branche), indiquant qu’une Rab donnée peut avoir une fonction similaire entre les quatre espèces. Les séquences ont été prises entre le domaine liant la GTP (PM3) et le domaine (G3), avec comme out-group la Rho6 humaine, comme nous l’avons déjà décrit pour P. falciparum [26].
Par ailleurs, PfRab2 et SpYpt4 sont orthologues et l’inactivation de SpYpt4 entraîne également une fragmentation des vacuoles chez S. pombe [29]. PfRab2 pourrait posséder une fonction similaire chez Plasmodium. Par ailleurs, le profil d’expression de Pfrab2 étant différent de celui de Pfrab7, ces deux protéines semblent jouer des rôles distincts dans la régulation de la taille des vacuoles ou, peut-être, des rôles précis dans la régulation de la taille de vacuoles de natures différentes (par exemple, digestive ou parasitophore).
Les trois protéines Rab5 du parasite sont homologues notamment de SpYpt5 et ScYpt10. L’interruption de ScYpt10 ne donne aucun phénotype particulier, mais celle de SpYpt5 entraîne une accumulation de vésicules [30]. Il est donc difficile de prédire l’éventuel rôle régulateur de PfRab5A, PfRab5B ou PfRab5C dans la fonction des endosomes ou dans la fusion entre les vacuoles chez P. falciparum. PfRab5A comporte une insertion de 30 acides aminés dans le domaine qui se lie au GTP et PfRab5B ne peut pas s’associer à la membrane en l’absence d’un motif de prénylation carboxyterminal. Ces deux protéines Rab5 pourraient donc avoir des fonctions atypiques. En revanche, PfRab5C, très proche d’une Rab5 classique, reste donc le candidat le plus probable en tant que régulateur de fusion endosomique. Chez Toxoplasma gondii, TgRab5 est impliquée dans l’importation de cholestérol [31] et chez Leishmania donovani, LdRab5 régule l’endocytose précoce de l’hémoglobine [32]. Chez Plasmodium, la MVP est très enrichie en cholestérol et le parasite importe l’hémoglobine de l’érythrocyte infecté pour la dégrader dans sa vacuole digestive [11]. Cela suggère que des parasites mutants pour Pfrab5c pourraient avoir un déficit dans l’importation de cholestérol et d’hémoglobine.
Les anticorps dirigés contre PfRab11A marquent des vésicules à proximités de la MVP [26], en accord avec un rôle régulateur de recyclage de certains récepteurs vers cette membrane. Un blocage dans le recyclage d’un éventuel récepteur se liant à l’hémoglobine pourrait entraîner une diminution dans l’importation d’hémoglobine et nuire à la vie du parasite. De plus, chez les mammifères, Rab11 est connu pour réguler le recyclage du récepteur β-adrénergique (β2-AR) [34]. Sachant que β2-AR s’accumule dans la MVP après invasion des globules rouges par le parasite [35], cette accumulation pourrait être nettement diminuée chez les parasites mutants pour Pfrab11a.
Conclusions et perspectives
Logé dans une cellule qui lui permet d’échapper au système immunitaire mais qui ne lui offre aucune ultrastructure d’importation/exportation de protéines, Plasmodium a développé un système dynamique très complexe de structures membranaires à l’intérieur du globule rouge. Ce système lui permet d’assurer un trafic intense de ses protéines jusqu’à leur destination finale. La compréhension des voies et des composants impliqués dans ce trafic a révélé l’existence à la fois de mécanismes d’adressage classiques des eucaryotes, mais aussi d’autres mécanismes spécifiques au parasite, et dont le ciblage pourrait constituer un nouveau moyen d’interférer avec le développement parasitaire. La régulation de ce trafic fait intervenir les protéines de la famille Rab qui jouent un rôle connu et prépondérant dans la régulation du trafic vésiculaire chez les eucaryotes. Aussi, pour comprendre les mécanismes utilisés par Plasmodium pour réguler sa survie via l’importation de nutriments comme l’hémoglobine et la sécrétion d’antigènes variants, de nombreux arguments plaident-ils en faveur d’une étude systématique des Rab dans l’infection palustre. La caractérisation des fonctions des GTPases Rab pourrait être très informative non seulement dans les érythrocytes, mais aussi dans les hépatocytes infectés, où la communication avec le parasite est plus riche puisque la cellule hôte est nucléée. Étant donné le nombre limité de gènes Pfrab du parasite, une approche d’inactivation génétique systématique, combinée à la caractérisation phénotypique des mutants, pourrait ainsi donner un nouvel éclairage sur le rôle des Rab dans la pathogénie du paludisme.
Appendices
Note
-
[1]
Les termes « globules rouges » et « érythrocytes » sont équivalents et utilisés indifféremment dans le texte.
Références
- 1. Bannister LH, Hopkins JM, Fowler RE, et al. A brief illustrated guide to the ultrastructure of Plasmodium falciparum asexual blood stages. Parasitol Today 2000 ; 16 : 427-33.
- 2. Przyborski JM, Wickert H, Krohne G, et al. Maurer’s clefts : a novel secretory organelle ? Mol Biochem Parasitol 2003 ; 132 : 17-26.
- 3. Wickert H, Wissing F, Andrews KT, et al. Evidence for trafficking of PfEMP1 to the surface of P. falciparum-infected erythrocytes via a complex membrane network. Eur J Cell Biol 2003 ; 82 : 271-84.
- 4. Elmendorf HG, Haldar K. Plasmodium falciparum exports the Golgi marker sphingomyelin synthase into a tubovesicular network in the cytoplasm of mature erythrocytes. J Cell Biol 1994 ; 124 : 449-62.
- 5. Haeggstrom M, Kironde F, Berzins K, et al. Common trafficking pathway for variant antigens destined for the surface of the Plasmodium falciparum-infected erythrocyte. Mol Biochem Parasitol 2004 ; 133 : 1-14.
- 6. Albano FR, Foley M, Tilley L. Export of parasite proteins to the erythrocyte cytoplasm : secretory machinery and traffic signals. Novartis Found Symp 1999 ; 226 : 157-75.
- 7. Goodyer ID, Pouvelle B, Schneider TG, et al. Characterization of macromolecular transport pathways in malaria-infected erythrocytes. Mol Biochem Parasitol 1997 ; 87 : 13-28.
- 8. Waller RF, Reed MB, Cowman AF, et al. Protein trafficking to the plastid of Plasmodium falciparum is via the secretory pathway. EMBO J 2000 ; 19 : 1794-802.
- 9. Cheresh P, Harrison T, Fujioka H, et al. Targeting the malarial plastid via the parasitophorous vacuole. J Biol Chem 2002 ; 277 : 16265-77.
- 10. Bender A, van Dooren GG, Ralph SA, et al. Properties and prediction of mitochondrial transit peptides from Plasmodium falciparum. Mol Biochem Parasitol 2003 ; 132 : 59-66.
- 11. Klemba M, Beatty W, Gluzman I, et al. Trafficking of plasmepsin II to the food vacuole of the malaria parasite Plasmodium falciparum. J Cell Biol 2004 ; 164 : 47-56.
- 12. Ansorge I, Benting J, Bhakdi S, et al. Protein sorting in Plasmodium falciparum-infected red blood cells permeabilized with the pore-forming protein streptolysin O. Biochem J 1996 ; 315 : 307-14.
- 13. Lingelbach K. Protein trafficking in the Plasmodium-falciparum-infected erythrocyte: from models to mechanisms. Ann Trop Med Parasitol 1997 ; 91 : 543-9.
- 14. Burghaus PA, Lingelbach K. Luciferase, when fused to an N-terminal signal peptide, is secreted from transfected Plasmodium falciparum and transported to the cytosol of infected erythrocytes. J Biol Chem 2001 ; 276 : 26838-45.
- 15. Adisa A, Rug M, Foley M, et al. Characterisation of a delta-COP homologue in the malaria parasite, Plasmodium falciparum. Mol Biochem Parasitol 2002 ; 123 : 11-21.
- 16. Wickham ME, Rug M, Ralph S, et al. Trafficking and assembly of the cytoadherence complex in Plasmodium falciparum-infected human erythrocytes. EMBO J 2001 ; 20 : 5636-49.
- 17. Lopez-Estrano C, Bhattacharjee S, Harrison T, et al. Cooperative domains define a unique host cell-targeting signal in Plasmodium falciparum-infected erythrocytes. Proc Natl Acad Sci USA 2003 ; 100 : 12402-7.
- 18. Adisa A, Rug M, Klonis N, et al. The signal sequence of exported protein-1 directs the green fluorescent protein to the parasitophorous vacuole of transfected malaria parasites. J Biol Chem 2003 ; 278 : 6532-42.
- 19. Taraschi TF, O’Donnell M, Martinez S, et al. Generation of an erythrocyte vesicle transport system by Plasmodium falciparum malaria parasites. Blood 2003 ; 102 : 3420-6.
- 20. Blisnick T, Morales Betoulle ME, Barale JC, et al. Pfsbp1, a Maurer’s cleft Plasmodium falciparum protein, is associated with the erythrocyte skeleton. Mol Biochem Parasitol 2000 ; 111 : 107-21.
- 21. Banumathy G, Singh V, Tatu U. Host chaperones are recruited in membrane-bound complexes by Plasmodium falciparum. J Biol Chem 2002 ; 277 : 3902-12.
- 22. Cooke BM, Lingelbach K, Bannister LH, et al. Protein trafficking in Plasmodium falciparum-infected red blood cells. Trends Parasitol 2004 ; 20 : 581-9.
- 23. Adisa A, Albano FR, Reeder J, et al. Evidence for a role for a Plasmodium falciparum homologue of Sec31p in the export of proteins to the surface of malaria parasite-infected erythrocytes. J Cell Sci 2001 ; 114 : 3377-86.
- 24. Hayashi M, Taniguchi S, Ishizuka Y, et al. A homologue of N-ethylmaleimide-sensitive factor in the malaria parasite Plasmodium falciparum is exported and localized in vesicular structures in the cytoplasm of infected erythrocytes in the brefeldin A-sensitive pathway. J Biol Chem 2001 ; 276 : 15249-55.
- 25. Spang A. Vesicle transport : a close collaboration of Rabs and effectors. Curr Biol 2004 ; 14 : R33-4.
- 26. Quevillon E, Spielmann T, Brahimi K, et al. The Plasmodium falciparum family of Rab GTPases. Gene 2003 ; 306 : 13-25.
- 27. Chakrabarti D, AzamT, DelVecchio C, et al. Protein prenyl transferase activities of Plasmodium falciparum. Mol Biochem Parasitol 1998 ; 94 : 175-84.
- 28. Attal G, Langsley G. A Plasmodium falciparum homologue of rab specific GDP dissociation inhibitor (rabGDI). Mol Biochem Parasitol 1996 ; 79 : 91-5.
- 29. Gotte M, Lazar T, Yoo JS, et al. The full complement of yeast Ypt/Rab-GTPases and their involvement in exo- and endocytic trafficking. Subcell Biochem 2000 ; 34 : 133-73.
- 30. Armstrong J, Craighead MW, Watson R, et al. Schizosaccharomyces pombe ypt5 : a homologue of the rab5 endosome fusion regulator. Mol Biol Cell 1993 ; 4 : 583-92.
- 31. Robibaro B, Stedman TT, Coppens I, et al. Toxoplasma gondii Rab5 enhances cholesterol acquisition from host cells. Cell Microbiol 2002 ; 4 : 139-52.
- 32. Singh SB, Tandon R, Krishnamurthy G, et al. Rab5-mediated endosome-endosome fusion regulates hemoglobin endocytosis in Leishmania donovani. EMBO J 2003 ; 22 : 5712-22.
- 33. Haldar K, Mohandas N, Samuel BU, et al. Protein and lipid trafficking induced in erythrocytes infected by malaria parasites. Cell Microbiol 2002 ; 4 : 383-95.
- 34. Moore RH, Millman EE, Alpizar-Foster E, et al. Rab11 regulates the recycling and lysosome targeting of beta2-adrenergic receptors. J Cell Sci 2004 ; 117 : 3107-17.
- 35. Harrison T, Samuel BU, Akompong T, et al. Erythrocyte G protein-coupled receptor signaling in malarial infection. Science 2003 ; 301 : 1734-6.
- 36. Marti M, Good RT, Rug M, et al. Targeting malaria virulence and remodeling proteins to the host erythrocyte. Science 2004 ; 306 : 1930-3.
- 37. Hiller NL, Bhattacharjee S, van Ooij C, et al. A host-targeting signal in virulence proteins reveals a secretome in malarial infection. Science 2004 ; 306 : 1934-7.
- 38. Akompong T, Kadekoppala M, Harrison T, et al. Trans expression of a Plasmodium falciparum histidine-rich protein II (HRPII) reveals sorting of soluble proteins in the periphery of the host erythrocyte and disrupts transport to the malarial food vacuole. J Biol Chem 2002 ; 277 : 28923-33.
- 39. De Castro FA, Ward GE, Jambou R, et al. Identification of a family of Rab G-proteins in Plasmodium falciparum and a detailed characterisation of pfrab6. Mol Biochem Parasitol 1996 ; 80 : 77-88.
- 40. Gorlich D, Prehn S, Hartmann E, et al. A mammalian homolog of SEC61p and SECYp is associated with ribosomes and nascent polypeptides during translocation. Cell 1992 ; 71 : 489-503.
- 41. Dahl EL, Rosenthal PJ. Biosynthesis, localization, and processing of falcipain cysteine proteases of Plasmodium falciparum. Mol Biochem Parasitol 2005 ; 139 : 205-12.
- 42. Liu J, Gluzman IY, Drew ME, Goldberg DE. The role of Plasmodium falciparum food vacuole plasmepsins. J Biol Chem 2005 ; 280 : 1432-7.
- 43. Foth BJ, Stimmler LM, Handman E, et al. The malaria parasite Plasmodium falciparum has only one pyruvate dehydrogenase complex, which is located in the apicoplast. Mol Microbiol 2005 ; 55 : 39-53.
- 44. Yano K, Komaki-Yasuda K, Kobayashi T, et al. Expression of mRNAs and proteins for peroxiredoxins in Plasmodium falciparum erythrocytic stage. Parasitol Int 2005 ; 54 : 35-41.
- 45. Hodder AN, Drew DR, Epa VC, et al. Enzymic, phylogenetic, and structural characterization of the unusual papain-like protease domain of Plasmodium falciparum SERA5. J Biol Chem 2003 ; 278 : 48169-77.
- 46. Culvenor JG, Crewther PE. S-antigen localization in the erythrocytic stages of Plasmodium falciparum. J Protozool 1990 ;37 : 59-65.
- 47. Chen Q, Barragan A, Fernandez V, et al. Identification of Plasmodiumfalciparum erythrocyte membrane protein 1 (PfEMP1) as the rosetting ligand of the malaria parasite P. falciparum. J Exp Med 1998 ; 187 : 15-23.
- 48. Kyes SA, Rowe JA, Kriek N, Newbold CI. Rifins : a second family of clonally variant proteins expressed on the surface of red cells infected with Plasmodium falciparum. Proc Natl Acad Sci USA 1999 ; 96 : 9333-8.
- 49. Kaviratne M, Khan SM, Jarra W, Preiser PR. Small variant STEVOR antigen is uniquely located within Maurer’s clefts in Plasmodium falciparum-infected red blood cells. Eukaryot Cell 2002 ; 1 : 926-35.
- 50. Waller KL, Cooke BM, Nunomura W, et al. Mapping the binding domains involved in the interaction between the Plasmodium falciparum knob-associated histidine-rich protein (KAHRP) and the cytoadherence ligand P. falciparum erythrocyte membrane protein 1 (PfEMP1). J Biol Chem 1999 ; 274 : 23808-13.
- 51. Benedetti CE, Kobarg J, Pertinhez TA, et al. Plasmodium falciparum histidine-rich protein II binds to actin, phosphatidylinositol 4,5-bisphosphate and erythrocyte ghosts in a pH-dependent manner and undergoes coil-to-helix transitions in anionic micelles. Mol Biochem Parasitol 2003 ; 128 : 157-66.
- 52. Gardner MJ, Tettelin H, Carucci DJ, et al. Chromosome 2 sequence of the human malaria parasite Plasmodium falciparum. Science 1998 ; 282 : 1126-32.
- 53. Spielmann T, Beck HP. Analysis of stage-specific transcription in Plasmodium falciparum reveals a set of genes exclusively transcribed in ring stage parasites. Mol Biochem Parasitol 2000 ; 111 : 453-8.
- 54. Langsley G, Chakrabarti D. Plasmodium falciparum : the small GTPase rab11. Exp Parasitol 1996 ; 83 : 250-1.
- 55. Hez-Deroubaix S, Brahimi K, Sauerwein R, et al. The Plasmodium falciparum GTPase Rab11B, a new liver-stage specific protein. Mol Biochem Parasitol 2005 (soumis pour publication).
List of figures
Figure 1
A. Développement de Plasmodium lors de son cycle intra-érythrocytaire. Lors de son développement dans les globules rouges, Plasmodium évolue en trois étapes. Le stade mérozoïte, issu de la prolifération initiale du parasite dans le foie, est capable d’infecter un érythrocyte. Il va s’enfermer dans une vacuole parasitophore (stade anneau). Au stade trophozoïte, la néosynthèse de ses protéines est intense et leur trafic efficace via de nombreux compartiments membranaires que le parasite étend dans le cytosol du globule rouge. Le parasite se développe ensuite en schizonte, et celui-ci se divise pour donner de nombreux mérozoïtes, lesquels, après rupture de la membrane érythrocytaire, vont pouvoir infecter d’autres érythrocytes. B. Ultrastructure schématique de l’érythrocyte infecté. Au stade trophozoïte, le parasite contient des organites internes comme le noyau, le réticulum endoplasmique (RE), le Golgi, une mitochondrie (Mito), un apicoplaste (A), un cytostome (C), lequel fusionne avec la vacuole digestive (VD) dans laquelle l’hémoglobine est dégradée en un déchet, le pigment malarique dit hématine ou hémozoïne (Hz). Le parasite, entouré d’une membrane plasmique (MPP), est logé dans une vacuole parasitophore (VP) dont la membrane (MVP) peut se différencier en structures membranaires et vésiculaires (TVN) comme les fissures de Maurer (FM). Le parasite adresse de nombreuses protéines parasitaires via ces structures jusqu’à la membrane du globule rouge (ME), au niveau de laquelle celles-ci forment des protubérances (Knob) impliquées dans la cytoadhérence de Plasmodium dans les vaisseaux sanguins, phénomène responsable notamment du neuropaludisme. Les flèches en orange décrivent succinctement les chemins qu’empruntent les protéines parasitaires pour être adressées dans les compartiments du parasite, ou bien à partir de la vacuole parasitophore vers le cytosol du globule et au-delà de sa membrane.
Figure 2
Arbre phylogénétique entre Rab parasitaires et Rab de levures.
Les differents Rab des parasites, P. berghei (Pb) et P. falciparum (Pf), et les Rab de deux levures (S. cerevisiae et S. pombe) sont homologues et forment des clad (groupements sur une branche), indiquant qu’une Rab donnée peut avoir une fonction similaire entre les quatre espèces. Les séquences ont été prises entre le domaine liant la GTP (PM3) et le domaine (G3), avec comme out-group la Rho6 humaine, comme nous l’avons déjà décrit pour P. falciparum [26].
List of tables
Tableau I
Caractéristiques de quelques protéines de P. falciparum adressées à l’intérieur du parasite et/ou exportées vers le globule rouge.
Cette liste non exhaustive de protéines parasitaires, adressées à l’intérieur du parasite ou vers le cytosol et la membrane du globule rouge, donne un aperçu global de l’intérêt du trafic des protéines parasitaires selon le compartiment final dans lequel elles exercent leurs fonctions. VD : vacuole digestive ; RE : réticulum endoplasmique ; GR : globule rouge ; FM : fissures de Maurer ; VP : vacuole parasitophore ; PfEMP1 : P. falciparum erythrocyte membrane protein 1.
Tableau II
Fonctions potentielles des protéines Rab de Plasmodium falciparum dans le transport vésiculaire.