Article body
La division cellulaire est le processus fondamental conduisant à la formation de deux cellules filles identiques à partir d’une cellule mère. Elle comprend deux parties, la mitose qui permet la séparation des chromosomes, et la cytocinèse qui conduit à la séparation du cytoplasme des deux cellules filles. La mitose et la cytocinèse nécessitent l’intervention de nombreux complexes moléculaires et sont coordonnées dans le temps et l’espace. En anaphase, un anneau contractile d’actine et de myosine II se met en place sous la membrane plasmique, au niveau de l’équateur métaphasique. En se contractant, il entraîne un étranglement de la cellule et forme le sillon de clivage. Ce sillon se creuse progressivement et finit par comprimer une structure de microtubules centraux, appelée microtubules de la zone intermédiaire. En télophase, les cellules filles sont reliées par un pont cytoplasmique, appelé le midbody, constitué de reliquats des microtubules de la zone intermédiaire et de l’anneau contractile. Les mécanismes requis pour la scission de cette connexion intercellulaire sont encore peu connus et nécessiteraient trois étapes : la stabilisation du midbody, le désassemblage de l’anneau contractile et un remodelage membranaire.
Une vingtaine de protéines conservées lors de l’évolution et jouant un rôle dans la cytocinèse ont été identifiées par de nombreuses approches expérimentales. Il s’agit de protéines impliquées dans la formation de l’anneau contractile d’actine/myosine II et du fuseau central de microtubules, dans la régulation de la structure de la chromatine, et dans le contrôle du trafic membranaire. Parmi les mécanismes moléculaires utilisés pour contrôler l’activité de ces protéines, des événements de phosphorylation sont fréquemment observés (pour revue, voir [1]).
Nous venons de démontrer que l’adaptateur moléculaire CD2AP (CD2- associated protein) est impliqué dans la cytocinèse des cellules HeLa [2]. CD2AP est composé de plusieurs domaines lui permettant de s’oligomériser et de s’associer à de multiples protéines (Figure 1). Nous avons observé que l’altération du niveau d’expression de CD2AP par surexpression, ou inhibition grâce à des petits ARN interférents, provoque une augmentation du nombre de cellules binucléées, signe d’une complétion anormale de la cytocinèse. L’observation en temps réel de cellules n’exprimant plus CD2AP montre que c’est la phase finale, la scission, qui est affectée. La cytocinèse s’effectue normalement jusqu’à la formation des deux cellules filles reliées par un pont cytoplasmique. Mais ce pont ne se rompt pas et le cytoplasme des deux cellules filles communique à nouveau pour donner naissance à une cellule contenant deux noyaux.
Figure 1
CD2AP, une molécule adaptatrice aux multiples partenaires.
Les domaines SH3 (Src homology 3) interagissent avec des régions riches en prolines. Le domaine coiled-coil est un domaine d’interaction protéine/protéine. Il permet l’oligomérisation de CD2AP. Les barres représentent les zones impliquées dans l’interaction entre CD2AP et les partenaires indiqués. CIN85: Cbl interacting protein of 85 kDa ; Tyr-P-Cbl : proto-oncogène Cbl phosphorylé sur des résidus de tyrosine ; CD2BP1 : CD2 binding protein 1/PSTPIP1: proline, serine, threonine phosphatase interacting protein ; CAP-Z : capping protein from the Z line of skeletal muscle ; CAMGAP1 : CIN85 associated multi-domain containing RhoGAP1 ; SB1: homologue d’un antigène tumoral rénal ; ASAP1 : Arf-GTPase activating protein containing SH3, ankyrin repeats, and pleckstrin homology domain 1 ; Alix/AIP1 : ALG-2 (apoptosis-linked gene 2)-interacting protein X.
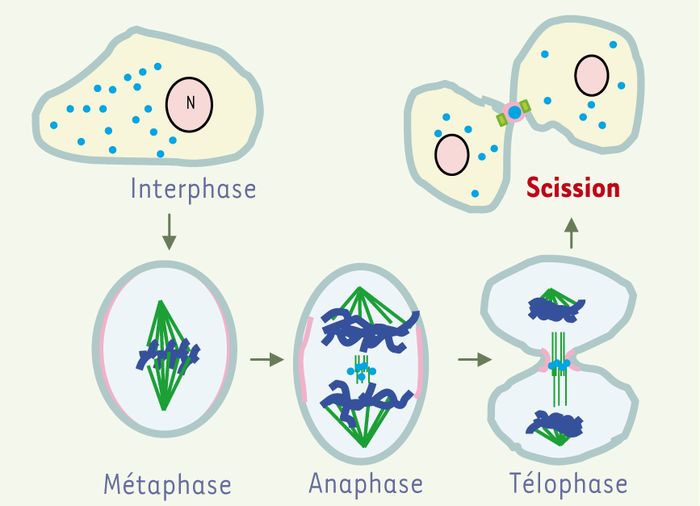
La localisation intracellulaire de CD2AP pendant la mitose est compatible avec une fonction dans la cytocinèse. En interphase, CD2AP est essentiellement associé à des endosomes [3]. En métaphase, CD2AP est phosphorylé et est cytosolique. Il est ensuite progressivement déphosphorylé et relocalisé dans une fraction membranaire. En anaphase, CD2AP est présent à l’équateur des microtubules de la zone intermédiaire. Il se concentre ensuite dans le midbody. CD2AP n’interagit pas directement avec les microtubules et son association aux fractions membranaires suggère qu’il est associé à des vésicules qui se forment ou transitent dans cette région de la cellule (Figure 2) [2].
Figure 2
Représentation schématique de la localisation subcellulaire de CD2AP et de l’anilline pendant la mitose.
CD2AP, représenté en bleu clair, est exprimé tout au long du cycle cellulaire alors que l’expression de l’anilline, représentée en rose, est augmentée pendant la transition S/G2. D’abord nucléaire, l’anilline se retrouve associée au cortex cellulaire quand la membrane nucléaire se fragmente. Elle est alors co-localisée avec le cytosquelette d’actine. CD2AP est associé à des endosomes en interphase, devient cytosolique en métaphase, puis se retrouve au niveau du fuseau central des microtubules. Les microtubules sont représentés en vert. On notera la présence du fuseau mitotique depuis la métaphase jusqu’en télophase, puis la formation du fuseau central des microtubules en anaphase. Les chromosomes sont représentés en bleu foncé. N : noyau.
Nous montrons également que CD2AP interagit avec l’anilline, un composant spécifique du sillon de clivage, impliquée dans la régulation de l’anneau contractile et requis également en fin de cytocinèse ([4] et, pour revue, voir [1]). Cette interaction se fait par l’intermédiaire des deux premiers domaines SH3 de CD2AP, et d’un motif PX(P/A)XXR conservé lors de l’évolution, présent dans l’extrémité aminoterminale de l’anilline. Comme le montre la Figure 2, de par leur localisation respective, l’interaction entre l’anilline et CD2AP ne peut se faire qu’en phase finale de cytocinèse, suggérant que le couple anilline/CD2AP soit requis pendant la scission.
Aucun défaut de cytocinèse n’a été à ce jour observé dans les animaux invalidés pour CD2AP [5], suggérant un mécanisme possible de compensation. CD2AP possède, en effet, un homologue, CIN85, avec lequel il partage un grand nombre de partenaires, hormis Rab4a et l’actine [6]. Bien que nous ayons caractérisé CD2AP comme un effecteur de Rab4a, cette interaction ne semble pas nécessaire pour la cytocinèse. De plus, CIN85 est aussi phosphorylé et localisé comme CD2AP pendant la mitose. Il est donc probable que les deux protéines puissent jouer un rôle équivalent dans la cytocinèse.
Les fonctions moléculaires de CD2AP ainsi que le rôle de l’interaction CD2AP/anilline dans la cytocinèse ne sont pas établis. La fonction exacte de CD2AP dans une cellule en interphase n’est également pas entièrement comprise. Cependant, CD2AP a été impliqué dans la voie de dégradation lysosomale de plusieurs récepteurs des facteurs de croissance et du récepteur T des lymphocytes [7], ainsi que de protéines extracellulaires par les podocytes, cellules spécialisées du glomérule rénal [8]. CD2AP joue également un rôle important dans la stabilisation de jonctions spécialisées, dont le diaphragme de fente dans le glomérule rénal, une jonction importante pour la fonction du rein, et la synapse immunologique qui est nécessaire à la réaction immunitaire. Il est possible que la stabilisation de ces jonctions spécialisées soit dépendante de processus d’endocytose.
La nature des partenaires de CD2AP permet de proposer qu’il joue un rôle dans la coordination des événements d’endocytose et le remodelage du cytosquelette d’actine (Figure 1) [7], probablement à différentes étapes de trafic, depuis la membrane plasmique jusqu’aux endosomes tardifs. De plus, CD2AP est associé à des endosomes dont la mobilité dépend de la polymérisation de l’actine [9]. Il pourrait, en contrôlant la polymérisation de l’actine sur une vésicule, et donc en formant une comète d’actine, favoriser son trafic intracellulaire vers les compartiments de dégradation.
L’implication de l’endocytose dans la cytocinèse est un concept en émergence, particulièrement dans les phases tardives. CD2AP affecte ces dernières étapes et pourrait donc participer à l’endocytose de protéines et/ou de lipides présents dans le midbody dans le but de le stabiliser ou de permettre la scission. On pourrait donc imaginer que CD2AP contrôle la formation de comètes d’actine au niveau du midbody pour favoriser des événements d’endocytose nécessaires à la complétion de la cytocinèse.
Appendices
Références
- 1. Glotzer M. The molecular requirements for cytokinesis. Science 2005 ; 307 : 1735-9.
- 2. Monzo P, Gauthier, NC, Keslair, F, et al. Clues to CD2AP involvement in cytokinesis. Mol Biol Cell 2005 ; 16 : 2891-902.
- 3. Cormont M, Meton I, Mari M., et al. CD2AP/CMS regulates endosome morphology and traffic to the degradative pathway through its interaction with Rab4 and c-Cbl. Traffic 2003 ; 4 : 97-112.
- 4. Oegema K, Savoian M, Mitchison T, Field C. Functional analysis of a human homologue of the Drosophila actin binding protein anillin suggests a role in cytokinesis. J Cell Biol 2000 ; 150 : 539-52.
- 5. Shih NY, Li J, Karpitskii V, Nguyen A, et al. Congenital nephrotic syndrome in mice lacking-CD2-associated protein. Science 1999 ; 286 : 312-5.
- 6. Dikic I. CIN85/CMS family of adaptor molecules. FEBS Lett 2002 ; 529 : 110-5.
- 7. Szymkiewicz I, Shupliakov O, Dikic I. Cargo- and compartment-selective endocytic scaffold proteins. Biochem J 2004 : 383 : 1-11.
- 8. Kim JM, Wu H, Green G, et al. CD2-associated protein haploinsufficiency is linked to glomerular disease suseptibility. Science 2003 ; 300 : 1298-300.
- 9. Welsch T, Endlich N, Gokce C, et al. Association of CD2AP with dynamic actin on vesicles in podocytes. Am J Physiol Renal Physiol 2005 ; 289 : F1134-43.
List of figures
Figure 1
CD2AP, une molécule adaptatrice aux multiples partenaires.
Les domaines SH3 (Src homology 3) interagissent avec des régions riches en prolines. Le domaine coiled-coil est un domaine d’interaction protéine/protéine. Il permet l’oligomérisation de CD2AP. Les barres représentent les zones impliquées dans l’interaction entre CD2AP et les partenaires indiqués. CIN85: Cbl interacting protein of 85 kDa ; Tyr-P-Cbl : proto-oncogène Cbl phosphorylé sur des résidus de tyrosine ; CD2BP1 : CD2 binding protein 1/PSTPIP1: proline, serine, threonine phosphatase interacting protein ; CAP-Z : capping protein from the Z line of skeletal muscle ; CAMGAP1 : CIN85 associated multi-domain containing RhoGAP1 ; SB1: homologue d’un antigène tumoral rénal ; ASAP1 : Arf-GTPase activating protein containing SH3, ankyrin repeats, and pleckstrin homology domain 1 ; Alix/AIP1 : ALG-2 (apoptosis-linked gene 2)-interacting protein X.
Figure 2
Représentation schématique de la localisation subcellulaire de CD2AP et de l’anilline pendant la mitose.
CD2AP, représenté en bleu clair, est exprimé tout au long du cycle cellulaire alors que l’expression de l’anilline, représentée en rose, est augmentée pendant la transition S/G2. D’abord nucléaire, l’anilline se retrouve associée au cortex cellulaire quand la membrane nucléaire se fragmente. Elle est alors co-localisée avec le cytosquelette d’actine. CD2AP est associé à des endosomes en interphase, devient cytosolique en métaphase, puis se retrouve au niveau du fuseau central des microtubules. Les microtubules sont représentés en vert. On notera la présence du fuseau mitotique depuis la métaphase jusqu’en télophase, puis la formation du fuseau central des microtubules en anaphase. Les chromosomes sont représentés en bleu foncé. N : noyau.