Article body
On s’était récemment habitué à ce que la découverte des gènes gouvernant le métabolisme du cholestérol provienne de l’étude de maladies génétiques à transmission autosomique récessive comme la sitostérolémie[1] [1]. À l’inverse, c’est à partir des effets d’une molécule hypocholestérolémiante déjà commercialisée, l’Ezetimibe, que S.W. Altmann et al. [2] ont identifié une voie métabolique majeure assurant l’absorption intestinale du cholestérol au niveau de la bordure en brosse entérocytaire intestinale.
Du pôle apical au pôle basolatéral de l’entérocyte
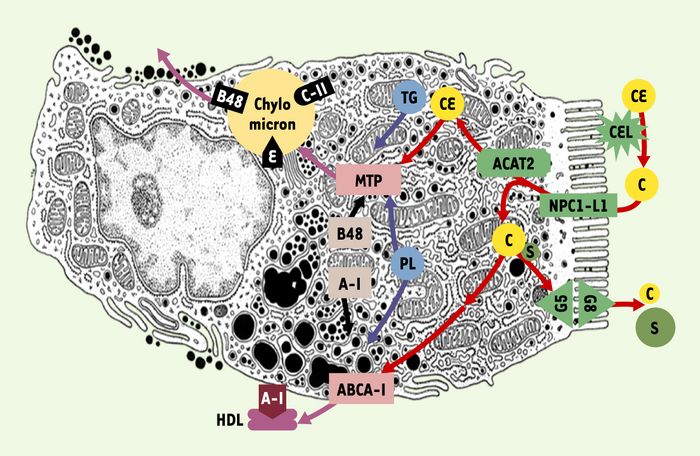
L’absorption intestinale du cholestérol commence par l’action d’une enzyme pancréatique, la carboxyl ester lipase (CEL), qui se lie à la membrane des entérocytes du duodéno-jéjunum. Activée par les acides biliaires, la CEL hydrolyse les esters de cholestérol d’origine alimentaire, libérant ainsi du cholestérol libre et des acides gras absorbables au pôle apical entérocytaire [3]. Dans l’entérocyte, les acides gras et le cholestérol sont à nouveau estérifiés par l’acyl cholestérol acyl transferase ACAT2 (Figure 1). Sous l’action de la microsomal transfer protein MTP, les esters de cholestérol sont assemblés avec des triglycérides, des phospholipides et de l’apoB48 dans les chylomicrons sécrétés au pôle basolatéral [4].
Figure 1
Étapes successives de l’absorption intestinale du cholestérol par l’entérocyte.
Le cholestérol (C) issu de l’hydrolyse des esters de cholestérol (CE) par la carboxyl ester lipase (CEL) est absorbé par NPC1-L1 au niveau de la bordure en brosse des entérocytes. Une petite partie du cholestérol absorbé ressort de l’entérocyte soit au pôle apical via les transporteurs de stérols végétaux (S) ABCG5 et ABCG8 (G5, G8) soit au pôle basolatéral associé avec des phospholipides (PL) et de l’apolipoprotéine A-I (A-I) dans des lipoprotéines de haute densité (HDL) via le transporteur ABCA-1. La majeure partie du cholestérol absorbé est en fait ré-estérifiée par l’ACAT2 puis assemblée par la MTP à de l’apolipoprotéine B48 (B48) avec des PL et des triglycérides (TG) au sein des chylomicrons. Les chylomicrons sont sécrétés au pôle basolatéral entérocytaire.
Les gènes candidats
Il existait quatre gènes candidats susceptibles de contrôler l’étape initiale d’absorption du cholestérol alimentaire, mais aucun ne semble jouer de rôle direct et/ou majeur. Les transporteurs ABCG5/8 (ATP-binding cassette G-5 et G-8) défectueux chez les patients sitostérolémiques sont responsables de l’exclusion des stérols d’origine végétale par l’entérocyte [1] ((→) m/s 2004, n° 1, p. 73) et limitent sensiblement l’absorption intestinale du cholestérol (Figure 1) lors d’apports alimentaires lipidiques excessifs [5, 6]. ABCA1, le transporteur responsable de l’efflux du cholestérol entérocytaire au pôle basolatéral, n’est pas impliqué dans l’absorption intestinale du cholestérol [7-9]. De même, l’absorption intestinale du cholestérol n’est pas altérée chez des souris dépourvues de SRBI (scavenger receptor class B, type I), alors qu’in vitro, l’action de ce récepteur sélectif pour les esters de cholestérol est bloquée par l’Ezetimibe [10].
Une régulation sophistiquée
L’absorption intestinale du cholestérol est contrôlée de manière indirecte au niveau hépatique par les récepteurs nucléaires LXR (liver X receptor), FXR, et LRH1 (liver receptor homolog 1) qui gouvernent la synthèse des acides biliaires à partir du cholestérol ((→) m/s 2000, n° 12, p. 1456). Dans le pancréas exocrine, LRH1 promeut l’expression de CEL, assurant l’hydrolyse des esters de cholestérol et en conséquence indirectement l’absorption intestinale du cholestérol [3]. La réabsorption intestinale des acides biliaires au niveau de l’iléon est également sous le contrôle de LRH1 et de FXR qui modulent l’expression de l’ileal bile acid transporter IBAT et de l’ileal bile acid binding protein IBABP ((→) m/s 2004, n° 1, p. 73). Enfin, dans l’entérocyte, LXR gouverne l’expression d’ABCG5/8 et d’ABCA1 [1] alors que FXR semble moduler négativement l’absorption intestinale du cholestérol chez la souris [11]. Malheureusement ces travaux n’ont pas permis l’identification du gène directement responsable de l’absorption intestinale du cholestérol.
La protéine Niemann Pick C1 like 1 (NPC1-L1)
L’analyse in vivo de la fonction d’un inhibiteur pharmacologique de l’absorption intestinale du cholestérol, l’Ezetimibe, suggère que ce processus est assuré par un transporteur spécifique. S.W. Altmann et al. [2] ont entrepris l’analyse génomique exhaustive des 16 500 séquences exprimées (EST, expressed sequence tags) au niveau jéjunal chez le rat, en sélectionnant les régions présentant les caractéristiques attendues pour un transporteur de cholestérol et conservées chez la souris et l’homme. Un seul gène candidat, NPC1-L1, se dégage de cette analyse : il partage 50 % d’homologies avec NPC1, un gène défectueux dans la maladie de Niemann-Pick autosomique récessive que caractérise l’accumulation de cholestérol dans les lysosomes [12, 13]. S.W. Altmann et al. [2] montrent également que contrairement à NPC1 dont l’expression est ubiquitaire, NPC1-L1 est exprimée principalement au niveau intestinal et dans une moindre mesure au niveau du foie, de la vésicule biliaire, de l’estomac, des testicules et des ovaires. Dans l’intestin, l’expression de NPC1-L1 est maximale au niveau du duodénum et surtout du jéjunum proximal, alors qu’elle est minimale dans l’iléon. Cette expression est confinée à la bordure en brosse des entérocytes essentiellement au niveau apical (Figure 1).
Validation du rôle de NPC1-L1 in vivo
Pour déterminer le rôle physiologique exact de ce nouveau transporteur, S.W. Altmann et al. [2] ont construit des souris déficientes en NPC1-L1. Ces animaux sont normolipémiques, et la seule caractéristique phénotypique qui les distingue de souris témoins est une moindre teneur hépatique en esters de cholestérol, ainsi qu’une réduction attendue de 69 % des niveaux de cholestérol alimentaire absorbé lors d’un régime alimentaire standard. Cette diminution est du même ordre de grandeur que celle qui est observée chez des souris déficientes en Cyp7a ou Cyp27 dont la sécrétion biliaire est altérée ((→) m/s 1999, n° 12, p. 1472). Chez ces dernières, l’ajout d’acide cholique au régime alimentaire suffit à restaurer des valeurs normales d’absorption intestinale des lipides alimentaires. Ce n’est pas le cas pour les souris dépourvues de NPC1-L1, indiquant que la circulation entéro-hépatique des acides biliaires n’est pas altérée dans ce modèle animal et n’est par conséquent pas la cause de la diminution d’absorption observée [2].
La cible thérapeutique de l’Ezetimibe : NPC1-L1
L’Ezetimibe, qui diminue d’environ 70 %, l’absorption intestinale du cholestérol chez les souris témoins n’a pas d’effet chez la souris dépourvue de NPC1-L1, ce qui suggère fortement que NPC1-L1 est la cible moléculaire de cet agent thérapeutique. Malheureusement, les tentatives pour montrer une interaction directe entre Ezetimibe et NPC1-L1 se sont avérées infructueuses. Lorsque le régime alimentaire contient de l’acide cholique, qui favorise l’absorption intestinale des lipides et du cholestérol alimentaires, S.W. Altmann et al. [2] observent une diminution de l’ordre de 80 % des niveaux d’absorption du cholestérol chez les souris NPC1-L1 déficientes, alors que l’absorption des triglycérides est identique à celle des souris témoins. La diminution de l’absorption du cholestérol alimentaire chez la souris déficiente en NPC1-L1 semble compensée par l’activation de l’expression des gènes HMGCoA réductase au niveau intestinal et HMGCoAsynthase au niveau hépatique, tous deux impliqués dans la biosynthèse endogène du cholestérol.
L’ensemble de ces travaux permet de conclure que NPC1-L1, cible moléculaire très vraisemblable de l’Ezetimibe, est un élément central du mécanisme direct d’absorption entérocytaire du cholestérol. L’existence d’un niveau d’absorption basal chez la souris dépourvue de ce récepteur suggère que d’autres mécanismes directs d’absorption du cholestérol existent : il est très probable que d’autres protéines sont associées à NPC1-L1 dans ce processus d’absorption original.
Appendices
Note
-
[1]
Dans cette maladie rarissime, les patients absorbent non seulement le cholestérol mais aussi tous les autres stérols, notamment d’origine végétale (phytostérols), dont l’un des plus abondants est le sitostérol. Ces patients ont des taux très élevés de stérols végétaux dans le plasma et développent des xanthomes, une athérosclérose accélérée et une maladie coronaire précoce.
Références
- 1. Berge KE, Tian H, Graf GA, et al. Accumulation of dietary cholesterol in sitosterolemia caused by mutations in adjacent ABC transporters. Science 2000 ; 290 : 1771-5.
- 2. Altmann SW, Davis Jr. HR, Zhu L, et al. Niemann-Pick C1 like 1 protein is critical for intestinal cholesterol absorption. Science 2004 ; 303 : 1201-4.
- 3. Fayard E, Schoonjans K, Annicotte JS, Auwerx J. Liver receptor homolog 1 controls the expression of carboxyl ester lipase. J Biol Chem 2003 ; 278 : 35725-31.
- 4. Turley SD, Dietschy JM. Sterol absorption by the small intestine. Curr Opin Lipidol 2003 ; 14 : 233-40.
- 5. Yu L, Hammer RE, Li-Hawkins J, et al. Disruption of Abcg5 and Abcg8 in mice reveals their crucial role in biliary cholesterol secretion. Proc Natl Acad Sci USA 2002 ; 99: 16237-42.
- 6. Yu L, Li-Hawkins J, Hammer RE, et al. Overexpression of ABCG5 and ABCG8 promotes biliary cholesterol secretion and reduces fractional absorption of dietary cholesterol. J Clin Invest 2002 ; 110 : 671-80.
- 7. Plösch T, Kok T, Bloks VW, et al. Increased hepatobiliary and fecal cholesterol excretion upon activation of the liver X receptor is independent of ABCA1. J Biol Chem 2002 ; 277 : 33870-7.
- 8. Mulligan JD, Flowers MT, Tebon A, et al. ABCA1 is essential for efficient basolateral cholesterol efflux during the absorption of dietary cholesterol in chickens. J Biol Chem 2003 ; 278 : 13356-66.
- 9. Iqbal J, Anwar K, Hussain MM. Multiple, independently regulated pathways of cholesterol transport across the intestinal epithelial cells. J Biol Chem 2003 ; 278 : 31610-20.
- 10. Altmann SW, Davis Jr. HR, Yao X, et al. The identification of intestinal scavenger receptor class B, type I (SR-BI) by expression cloning and its role in cholesterol absorption. Biochem Biophys Acta 2002 ; 1580 : 77-93.
- 11. Lambert G, Amar MJA, Guo G, et al. The nuclear receptor FXR regulates the enterohepatic circulation of cholesterol. J Biol Chem 2003 ; 278 : 2563-70.
- 12. Davies JP, Levy B, Ioannou YA. Evidence for a Niemann-Pick C (NPC) gene family : identification and characterization of NPC1L1. Genomics 2000 ; 65 : 137-45.
- 13. Ioannou YA. Multidrug permeases and subcellular cholesterol transport. Nat Rev Mol Cell Biol 2001 ; 2 : 657-68.
List of figures
Figure 1
Étapes successives de l’absorption intestinale du cholestérol par l’entérocyte.
Le cholestérol (C) issu de l’hydrolyse des esters de cholestérol (CE) par la carboxyl ester lipase (CEL) est absorbé par NPC1-L1 au niveau de la bordure en brosse des entérocytes. Une petite partie du cholestérol absorbé ressort de l’entérocyte soit au pôle apical via les transporteurs de stérols végétaux (S) ABCG5 et ABCG8 (G5, G8) soit au pôle basolatéral associé avec des phospholipides (PL) et de l’apolipoprotéine A-I (A-I) dans des lipoprotéines de haute densité (HDL) via le transporteur ABCA-1. La majeure partie du cholestérol absorbé est en fait ré-estérifiée par l’ACAT2 puis assemblée par la MTP à de l’apolipoprotéine B48 (B48) avec des PL et des triglycérides (TG) au sein des chylomicrons. Les chylomicrons sont sécrétés au pôle basolatéral entérocytaire.