Article body
Depuis quelques années, les laboratoires disposent de méthodes d’analyse globale des gènes et de leurs produits (ARN messagers, protéines). Appliquées à des organismes ou des organes dans leur globalité, ces méthodes procurent un foisonnement de données qui bouleversent la vision que l’on avait jusqu’ici des processus biologiques. Il faut d’ailleurs reconnaître que la lecture de ces « catalogues » n’est pas toujours explicite. Les documents restent encore peu accessibles au profane et sont, même pour les spécialistes, parfois difficiles à interpréter, ne serait-ce qu’en raison de l’hétérogénéité cellulaire du matériel examiné. Un travail récent [1], dépassant ces difficultés, illustre la puissance de ces nouvelles démarches et leurs vertus exploratrices. Il met en effet en oeuvre, à l’échelle cellulaire, un outil applicable à l’étude des fonctions rénales chez l’homme.
La méthode SAGE
En collaboration avec les chirurgiens de l’hôpital Necker et le Centre national de séquençage d’Évry, un travail coordonné par J.M. Elalouf au CEA-Saclay a permis d’établir une cartographie quantitative à haute résolution des transcrits du rein humain, en ayant recours à la méthode SAGE (serial analysis of gene expression) appliquée à des segments de néphrons obtenus par microdissection. La méthode SAGE mesure, en termes quantitatifs, l’expression de tous les gènes, connus et inconnus. Elle repose sur le séquençage d‘un court fragment (une « étiquette », ou tag) de chacun des ADNc obtenus à partir des transcrits issus du tissu d’origine. Autrement dit, pour un ADNc donné, le nombre d’étiquettes séquencées est directement proportionnel au nombre de copies d’ARN exprimées par le gène correspondant. Pour conduire cette analyse à l’échelle cellulaire, la méthode a été modifiée à Saclay [2] pour lui donner la sensibilité requise et la rendre compatible avec l’analyse de segments de néphrons bien individualisés, prélevés sur des fragments de tissu rénal provenant d’interventions chirurgicales [3].
Expression des gènes dans le néphron
Les fonctions vitales du rein résultent d‘un processus d’ultrafiltration du sang par les glomérules, puis d’une succession de processus de transport qui modifient la composition du filtrat au cours de sa progression dans les structures tubulaires du néphron. Dans ce travail [1], le glomérule et sept segments tubulaires différents ont été explorés (Figure 1). Quatre des sept segments ne comportent qu’un seul type cellulaire, les trois autres n’en comptant que deux ou trois. Au total, plus de 400 000 étiquettes ont été analysées, le nombre variant de 44 000 à 67 000 pour chacune des structures explorées. Les auteurs mettent notamment l’accent sur les gènes préférentiellement exprimés dans chacune des structures. Parmi ceux-ci, on en trouve plusieurs dizaines dont la ou les mutations sont associées à des maladies humaines. Les informations contenues dans l’article publié ne représentent cependant qu’une infime partie de ce qui peut être extrait de ce travail. L’ensemble des résultats est librement accessible sur le web [4].
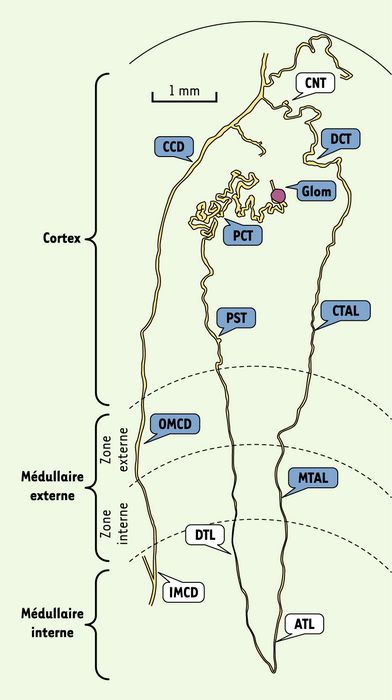
Figure 1
Néphron humain obtenu par microdissection.
Les segments sont nommés selon la nomenclature internationale. Glom : glomérule ; PCT : tubule contourné proximal ; PST : pars recta, partie droite du tubule proximal ; DTL : segment grêle descendant ; ATL : segment grêle ascendant ; MTAL : segment large ascendant médullaire ; CTAL : segment large ascendant cortical ; DCT : tubule contourné distal ; CNT : tubule connecteur ; CCD : canal collecteur cortical ; OMCD : canal collecteur médullaire externe ; IMCD : canal collecteur médullaire interne. En bleu : structures analysées ayant fait l’objet de cette étude. La ligne courbe en haut de la figure correspond à la surface du rein, les courbes en pointillé indiquent les zones rénales. Ce néphron a été disséqué par O. Gontcharevskaïa (d’après [1]).
La pertinence de la méthodologie est attestée par le fait que l’on retrouve, aux endroits attendus, les gènes dont l’expression met en place les marqueurs distinctifs du segment concerné. Dans certains cas, ces marqueurs ne sont exprimés que dans une seule structure. Par exemple, on note que les gènes AQP1, SLC12A3 et AQP3, qui codent respectivement pour un canal hydrique apical et basolatéral, un cotransporteur NaCl sensible au thiazide et une aquaporine basolatérale, ne sont exprimés, exclusivement ou presque exclusivement, que dans le tubule proximal, le tubule distal et les canaux collecteurs, c’est-à-dire dans les structures où ces molécules ont été déjà répertoriées le long du néphron, chez l’animal.
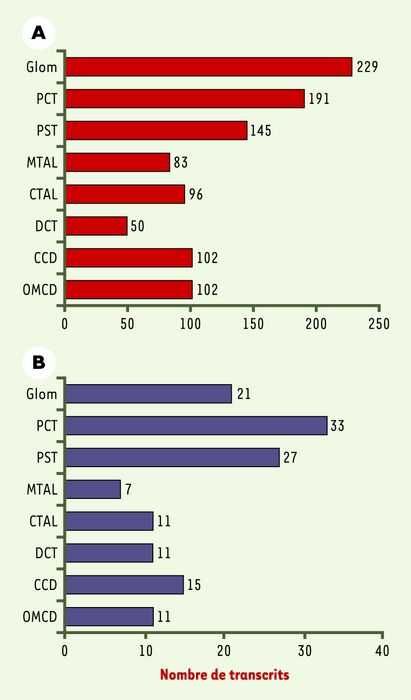
Les auteurs ont classé les gènes en fonction de leur niveau d’expression dans chaque structure. Ils ont retenu le terme d’ « expression différentielle » pour des variations importantes, lorsque l’abondance d’un transcrit est au moins sept fois plus élevée dans une structure que dans les autres. Près d’un millier (998) de gènes présentent ainsi une expression différentielle le long du néphron (Figure 2A). On se prend à rêver du nombre considérable de gènes qui seront mis en évidence lorsque des analyses statistiques plus subtiles seront effectuées. Parmi les gènes « différentiellement » exprimés, une centaine (136) peuvent être mutés dans des maladies génétiques affectant le rein (syndrome de Bartter, syndrome de Liddle…) ou d’autres tissus (Figure 2B). Curieusement, AQP2, qui code pour l’aquaporine contrôlée par l’hormone antidiurétique, et dont la mutation est responsable d’un diabète insipide néphrogénique, est non seulement retrouvé dans les segments terminaux du néphron, comme l’on s’y attendait, mais encore dans la pars recta du tubule proximal. Cela est probablement à mettre au compte de différences d’espèces, que l’on peut par ailleurs relever pour d’autres éléments.
Figure 2
A. Nombre de gènes exprimés de façon différentielle dans les différentes structures du néphron humain. B. Nombre de gènes différentiellement exprimés dont la ou les mutations sont associées à une maladie génétique affectant le rein ou un autre système cellulaire. Glom : glomérule ; PCT : tubule contourné proximal ; PST : pars recta, partie droite du tubule proximal ; MTAL : segment large ascendant médullaire ; CTAL : segment large ascendant cortical ; DCT : tubule contourné distal ; CCD : canal collecteur cortical ; OMCD : canal collecteur médullaire externe.
Recherche de gènes candidats
S’agissant de l’identification de gènes responsables de maladies rénales pour lesquelles on manque encore de candidats, cette méthodologie peut singulièrement réduire le champ d’exploration. Prenons le cas du pseudohypoaldostéronisme de type 2A (PHA2A), un syndrome associant hypertension et hyperkaliémie. Les formes héréditaires d’hypertension artérielle concernent principalement des gènes dont les produits contrôlent la réabsorption rénale du sel. Bon nombre d’entre eux s’expriment dans les portions distales du néphron. PHA2A a été cartographié en 1q31-q42, une zone qui ne compte pas moins de 400 gènes. L’analyse des gènes préférentiellement exprimés dans les segment distaux et localisés dans ce segment de chromosome réduit le nombre de candidats à quatre ! Le même type d‘analyse, appliqué à une néphropathie à immunoglobuline A, réduit le nombre de candidats à trois, alors que la région chromosomique impliquée comporte 263 gènes.
Délimitation de gènes
Les auteurs de l’étude ont indiqué systématiquement la position chromosomique des gènes correspondant aux transcrits détectés (voirtableaux 4 et 8 dans [4]). Prenons le cas du chromosome 12, dont une portion porte trois gènes identifiés (AQP2, AQP5, et AQP6) et une séquence anonyme (Figure 3). Les quatre séquences sont transcrites selon la même orientation, ce qui évoque un complexe d’aquaporines. Lorsque l’on reporte sur la carte chromosomique l’abondance des étiquettes de ces transcrits, on s’aperçoit que les gènes des trois aquaporines sont exprimés dans le canal collecteur. Toutefois, on est surpris de voir que l’expression majoritaire est obtenue pour la séquence anonyme. Ce fragment correspondrait-il à une partie du gène AQP2 ? Pour le savoir, les auteurs ont recherché une continuité transcriptionnelle entre AQP2 et cette séquence anonyme. Il y a effectivement continuité puisque la taille du fragment obtenu par RT-PCR à partir de l’ARN extrait du rein est la même que celle obtenue directement à partir de l’ADN génomique (Figure 3). Cet exemple montre qu’à partir de ces données, on peut reprendre l’annotation de la séquence génomique de façon très précise, en repérant de façon exacte les extrémités des gènes.
Figure 3
Utilisation des données d’expression pour l’annotation du génome humain.
Les barres horizontales rouges indiquent la position et l’abondance (ici la somme des valeurs obtenues à partir des canaux collecteurs corticaux et médullaires externes) des étiquettes SAGE détectées. À droite, image des produits d’amplification obtenus par PCR à partir d’ARN (RT-PCR) et d’ADN génomique. Les amorces de PCR correspondent respectivement à la séquence exonique terminale de l’AQP2 et à la séquence initiale de l’ADNc FLJ31262. La taille du fragment amplifié à partir de l’ARN et de l’ADN est identique, indiquant une continuité transcriptionnelle entre AQP2 et FLJ31262. RT- : contrôle sans transcriptase inverse.
Vers une physiologie intégrée du néphron
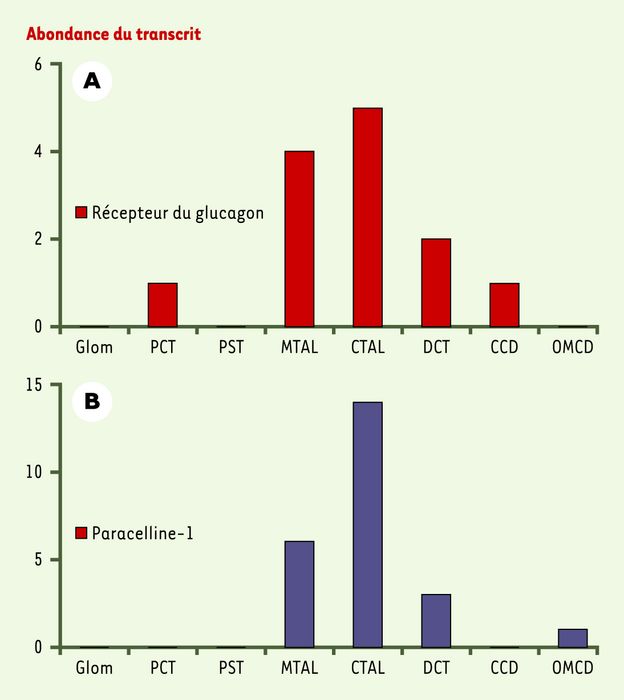
L’exploitation systématique des données accessibles sur le web, en s’appuyant sur les connaissances acquises chez l’animal, devrait permettre de positionner toutes les protéines de transport (enzymes, transporteurs, canaux) et leurs systèmes régulateurs le long de chaque segment du néphron humain (voir tableau 8 dans [4]). Prenons l’exemple de la régulation de l’excrétion du magnésium chez l’homme. G. Friedlander et al. [5], dans l’un des rares travaux consacrés à ce sujet, rapportaient une augmentation de la réabsorption rénale du magnésium sous l’influence du glucagon. Chez le rat et la souris, on constate le même effet, résultant d’une stimulation de la réabsorption de cet ion le long du tubule contourné distal et de la partie corticale du segment large ascendant de l’anse de Henle, à la différence de la partie médullaire de ce segment qui ne transporte pas cet ion divalent. Dans la partie corticale de la branche large ascendante du néphron, chez les rongeurs, le transport de magnésium se fait au travers de la voie paracellulaire [6] grâce à la présence, dans les jonctions serrées, d’une protéine nommée paracelline-1 [7]. Qu’en est-il chez l’homme ? La séquence du récepteur du glucagon étant connue, on va rechercher dans son ADNc l’étiquette correspondante (AACTTCTTCA), puis déterminer à partir de cette étiquette l’abondance des transcrits dans la banque de données établie pour le néphron (voir tableau 7 dans [4]). On retrouve essentiellement le récepteur là où s’exprime également le gène de la paracelline-1, c’est-à-dire dans le segment large ascendant (partie médullaire et corticale) et au début du tubule distal (Figure 4). On peut donc en déduire que, chez l’homme, le magnésium est très vraisemblablement réabsorbé, via la voie paracellulaire, dans la partie corticale du segment large ascendant et que son transport y est modulé par le glucagon. Il est possible que la partie médullaire du segment large ascendant de l’anse et le début du tubule contourné distal soient aussi le siège d’un tel transport. On mesure ainsi l’intérêt d’avoir une information globale sur l’ensemble des processus qui participent à une fonction, car elle permet non seulement de bien préciser leur localisation, mais encore d’identifier et de dénombrer les gènes impliqués dans ces processus.
Figure 4
Niveaux d’expression du gène codant pour le récepteur du glucagon et du gène codant pour la paracelline-1 le long du néphron humain.
Glom : glomérule ; PCT : tubule contourné proximal ; PST : pars recta, partie droite du tubule proximal ; MTAL : segment large ascendant médullaire ; CTAL : segment large ascendant cortical ; DCT : tubule contourné distal ; CCD : canal collecteur cortical ; OMCD : canal collecteur médullaire externe.
Perspectives
Ce travail montre toute la portée d’une exploration qui allie biologie moléculaire, génétique, physiologie et médecine sur des structures bien identifiées à l’échelle cellulaire. Ce type d’analyse devrait permettre de décrire les voies métaboliques majeures, de relever les détails structurels ou d’aboutir à la découverte de nouveaux gènes. Tous ces éléments vont sans nul doute faire progresser de façon décisive nos connaissances sur les propriétés physiologiques spécifiques du rein humain et leurs désordres pathologiques. J.M. Elalouf et son équipe ont aussi appliqué la technique SAGE modifiée [2] à l’exploration de plusieurs régions bien individualisées du cerveau [8]. Au vu de la prodigieuse moisson d’observations offerte par le travail sur le rein, on doit souhaiter que de solides collaborations puissent être plus systématiquement établies entre médecins et biologistes, spécialistes des grandes fonctions, sur la base de méthodes d’exploration globale des génomes, de leur transcrits et de leurs produits, pour assurer une progression rapide des connaissances en physiologie et physiopathologie humaine.
Appendices
Références
- 1. Chabardès-Garonne D, Méjean A, Aude JC, et al. A panoramic view of gene expression in the human kidney. Proc Natl Acad Sci USA 2003 ; 100 : 13710-15.
- 2. Cheval L, Virlon B, Elalouf JM. SADE. A microassay for serial analysis of gene expression. In : Hunt S, Livesey JP, eds. Functional Genomics : A pratical approach. Oxford : Oxford University Press, 2000 : 139-63.
- 3. Tissus issus d’exérèses thérapeutiques, utilisés avec l’accord des patients. Protocole approuvé par le Comité d’éthique de l’hôpital Necker.
- 4. http://www.pnas.org/cgi/content/full/2234604100/DC1.
- 5. Friedlander G, Blanchet-Benqué F, Bailly C, et al. Effets tubulaires rénaux du glucagon chez l’homme. Méd Sci (Paris) 1985 ; 1 : 100-3.
- 6. Quamme GA, de Rouffignac C. In : Seldin DW, Giebisch G, eds. Renal magnesium handling. The Kidney. Baltimore : Lippincott Williams & Wilkins, 2000 : 1711-29.
- 7. Simon DB, Lu Y, Choate KA, et al. Paracellin-1, a renal tight junction protein required for paracellular Mg2+ resorption. Science 1999 ; 285 : 103-6.
- 8. De Chaldée M, Gaillard MC, Bizat N, et al. Quantitative assessment of transcriptome differences between brain territories. Genome Res 2003 ; 13 : 1646-53.
List of figures
Figure 1
Néphron humain obtenu par microdissection.
Les segments sont nommés selon la nomenclature internationale. Glom : glomérule ; PCT : tubule contourné proximal ; PST : pars recta, partie droite du tubule proximal ; DTL : segment grêle descendant ; ATL : segment grêle ascendant ; MTAL : segment large ascendant médullaire ; CTAL : segment large ascendant cortical ; DCT : tubule contourné distal ; CNT : tubule connecteur ; CCD : canal collecteur cortical ; OMCD : canal collecteur médullaire externe ; IMCD : canal collecteur médullaire interne. En bleu : structures analysées ayant fait l’objet de cette étude. La ligne courbe en haut de la figure correspond à la surface du rein, les courbes en pointillé indiquent les zones rénales. Ce néphron a été disséqué par O. Gontcharevskaïa (d’après [1]).
Figure 2
A. Nombre de gènes exprimés de façon différentielle dans les différentes structures du néphron humain. B. Nombre de gènes différentiellement exprimés dont la ou les mutations sont associées à une maladie génétique affectant le rein ou un autre système cellulaire. Glom : glomérule ; PCT : tubule contourné proximal ; PST : pars recta, partie droite du tubule proximal ; MTAL : segment large ascendant médullaire ; CTAL : segment large ascendant cortical ; DCT : tubule contourné distal ; CCD : canal collecteur cortical ; OMCD : canal collecteur médullaire externe.
Figure 3
Utilisation des données d’expression pour l’annotation du génome humain.
Les barres horizontales rouges indiquent la position et l’abondance (ici la somme des valeurs obtenues à partir des canaux collecteurs corticaux et médullaires externes) des étiquettes SAGE détectées. À droite, image des produits d’amplification obtenus par PCR à partir d’ARN (RT-PCR) et d’ADN génomique. Les amorces de PCR correspondent respectivement à la séquence exonique terminale de l’AQP2 et à la séquence initiale de l’ADNc FLJ31262. La taille du fragment amplifié à partir de l’ARN et de l’ADN est identique, indiquant une continuité transcriptionnelle entre AQP2 et FLJ31262. RT- : contrôle sans transcriptase inverse.
Figure 4
Niveaux d’expression du gène codant pour le récepteur du glucagon et du gène codant pour la paracelline-1 le long du néphron humain.
Glom : glomérule ; PCT : tubule contourné proximal ; PST : pars recta, partie droite du tubule proximal ; MTAL : segment large ascendant médullaire ; CTAL : segment large ascendant cortical ; DCT : tubule contourné distal ; CCD : canal collecteur cortical ; OMCD : canal collecteur médullaire externe.