Article body
Expression de l’information génétique
Au sein d’un organisme, une information génétique identique conduit à l’élaboration de phénotypes cellulaires différents, ce qu’expliquent l’activation et/ou la répression sélectives d’un répertoire de gènes. Ces événements moléculaires permettent également la réponse appropriée de la cellule à une variation locale des concentrations en hormones. La transcription requiert la présence de l’ARN polymérase II (Pol II), recrutée au niveau du promoteur du gène sous l’influence de la liaison d’un ou de plusieurs facteurs de transcription dits enhancer sur des séquences cis précises. Cet enhancer va provoquer la mise en place du complexe de pré-initiation (CPI) au niveau du site d’initiation de la transcription. Le CPI inclut la Pol II inactive ainsi que les six complexes TFIIA, B, C, D, E et F [1]. D’autres complexes protéiques composés de plusieurs sous-unités, les TRAP/DRIP/Mediator (TRAP pour thyroid receptor-associated protein complex, DRIP pour vitamin D receptor interacting proteins),∈établissent un pont entre le CPI et l’activateur et permettent la transition entre le CPI et un complexe Pol II compétent pour la transcription. Cette transition est due à la phosphorylation de la sous-unité Rbp1 (ou extension carboxy-terminale) de la Pol II qui permet un échange des protéines de type Mediator pour des protéines spécifiques (de type Elongator) de la Pol II active.
Chromatine et dynamique d’activation de la transcription d’un gène
Au sein de la chromatine, l’ADN est compacté par les histones sous forme de nucléosomes. L’initiation de la transcription d’un gène se déroule donc in vivo dans un contexte très restrictif, car cette structure compacte est physiquement peu propice à la liaison des complexes protéiques de haut poids moléculaire formant le CPI. Au niveau du promoteur, la plasticité de la chromatine requise pour l’initiation de la transcription est assurée par le recrutement et l’assemblage de complexes protéiques spécifiques [2]. Ces événements impliquent soit des protéines de type SWI/SNF qui altèrent l’organisation spatiale des nucléosomes en présence d’ATP, soit des protéines qui, en modifiant les lysines et les arginines des histones tails par acétylation (activité HAT, histone acétyltransférase) ou méthylation (HMT, histone méthyltransférase), vont affaiblir les liaisons physiques entre les histones et l’ADN [3]. Il y a déjà maintenant près de 20 ans, s’est posé la question de la cinétique de ces événements : les complexes recrutés au niveau d’un promoteur sont-ils déjà préformés ou bien s’assemblent-ils sur le promoteur, et dans quel ordre ?
Le modèle des signalisations oestrogéniques
Les oestrogènes, comme le 17β-oestradiol (E2), sont des hormones lipophiles qui contrôlent un grand nombre de processus physiologiques via la modulation de l’expression de gènes cibles. Cela s’opère par l’intermédiaire de récepteurs nucléaires spécifiques, les récepteurs des oestrogènes (ER), qui se fixent sur des séquences spécifiques (ERE pour estrogen responsive element) situées dans le promoteur du gène sélectionné. Ces facteurs de transcription majoritairement activateurs interagissent avec certains des composants du CPI, SWI/SNF, des HAT (comme SRC1 et CBP/p300) et des HMT (comme CARM1 et PRMT1), ainsi qu’avec les complexes de type TRAP/Mediator [4]. En utilisant des techniques d’immunoprécipitation de complexes chromatiniens (ChIP) et une étude cinétique des remodelages de la chromatine au niveau du promoteur du gène pS2 contrôlé par les oestrogènes in vivo, nous avons récemment défini plusieurs points importants et novateurs pour la compréhension des mécanismes d’initiation de la transcription [5].
Activation de la transcription : un processus combinatoire, cyclique et séquentiel
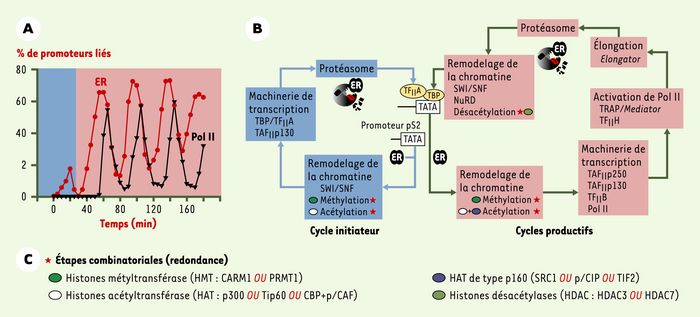
La première conclusion de ces expériences est que l’association des complexes régulateurs avec la chromatine est cyclique, et se produit toutes les 40 à 45 minutes sur notre promoteur modèle. L’activation de la Pol II se fait en cinq à dix minutes (Figure 1A). Lors de ces cycles, la structure chromatinienne du promoteur pS2 alterne entre des états permissifs et non permissifs pour la transcription. Ces transitions, créées par des fluctuations régulières du positionnement des nucléosomes et des niveaux d’acétylation et de méthylation des histones, sont sous l’influence de recrutements coordonnés par l’ER d’enzymes de type SWI/SNF, HAT et HMT. De plus, des complexes protéiques habituellement considérés comme répresseurs de la transcription (par exemple les HDAC, histone désacétylase), sont impliqués dans la genèse de ces cycles. Enfin, la dégradation de l’ER par le protéasome définit un point d’arrêt à la stimulation de la transcription du gène pS2(Figure 1B).
Figure 1
Cycles transcriptionnels d’un gène contrôlé par les oestrogènes : un assemblage combinatoire mais séquentiel.
A. Expérience de ChIP (immunoprécipitation de la chromatine), mesurant in vivo la permissivité du promoteur pS2 à la liaison du récepteur de l’oestrogène (ER) et au recrutement de la polymérase II (Pol II). Ces mesures mettent en évidence deux types de cycles ; seul le second type permet un recrutement cyclique de la Pol II toutes les 45 minutes. B. Illustration des séquences de recrutement de divers facteurs de transcription dans les deux cycles, et de leur conséquence au niveau de l’organisation chromatinienne du promoteur. Le premier cycle est appelé « initiateur », car il prépare le promoteur à répondre ensuite au niveau transcriptionnel. Dans les deux cas, la dégradation de l’ER par le protéasome termine le cycle. C. Les astérisques rouges indiquent les points où nous avons observé un recrutement combinatoire, c’est-à-dire un recrutement alternatif de protéines ayant la même activité, comme par exemple CARM1 et PRMT1.
La seconde observation révèle que plusieurs combinaisons de protéines différentes peuvent assurer chacune des étapes de cette séquence complexe d’événements enzymatiques, reflétant une redondance fonctionnelle entre les protéines recrutées in vivo(Figure 1C). On peut donc parler de recrutements stochastiques : pour un promoteur et une cellule données, une parmi plusieurs protéines ayant la même activité va avoir une certaine probabilité de se lier sur le promoteur. Une préférence de recrutement, certainement due à une différence d’affinité entre les protéines, a été montrée dans le cas de récepteurs d’autres hormones stéroïdes [6].
Existence d’un « synchronisateur » allostérique
La transcription d’un gène serait donc un processus cyclique au cours duquel les protéines régulatrices recrutées s’associeraient et se dissocieraient continuellement. On doit donc postuler l’existence d’un mécanisme de contrôle de ces cycles qui synchronise l’accessibilité du promoteur pour tel ou tel complexe protéique et qui orchestre la progression des cycles à travers une séquence d’événements requis pour une activation transcriptionnelle. Ce « synchronisateur » serait créé par des processus allostériques mettant en jeu à la fois des événements ayant lieu au niveau de la structure même du promoteur, et des activités enzymatiques apportées par tel ou tel facteur de transcription. Par exemple, illustrant le concept du « code histone » [7], un changement dans le statut d’acétylation et de méthylation des histones peut être un des éléments essentiels de cette signalétique, permettant à la cellule de savoir à quelle étape particulière du cycle se situe le promoteur. De plus, certaines protéines sont recrutées si et seulement si une histone du promoteur est acétylée ou méthylée [8]. Les changements conformationnels produits au sein de deux partenaires interagissant physiquement représentent en eux-mêmes un signal pouvant également marquer l’état de progression des complexes présents sur le promoteur dans le cycle d’activation de la transcription.
Un modèle général pour l’initiation de la transcription ?
La séquence de recrutement des protéines que nous avons décrite ne peut vraisemblablement pas être extrapolée au fonctionnement de tous les promoteurs, car d’autres enchaînements ont été observés, notamment au niveau du gène IFNβ [9]. En revanche, nous proposons, et d’autres auteurs partagent cette vision [10], que les principes qui se dégagent de nos résultats servent pour établir un modèle général. Une initiation de la transcription résulte : (1) du recrutement séquentiel et stochastique de protéines redondantes ; et (2) de processus cycliques assurés par un « synchronisateur » qui contrôle ces recrutements et les modifications structurales du promoteur. Cela reste cependant à confirmer dans d’autres systèmes modèles. L’intérêt primordial du caractère cyclique de ces événements serait de permettre à la cellule de pouvoir ajuster la transcription d’un gène à une situation précise, telle qu’on peut la rencontrer lors des variations du taux d’hormones circulantes auxquelles elle doit s’adapter.
Appendices
Références
- 1. Berk AJ. Activation of RNA polymerase II transcription. Curr Opin Cell Biol 1999 ; 11 : 330-5.
- 2. Dillon N, Festenstein R. Unraveling heterochromatin : competition between positive and negative factors regulates accessibility. Trends Genet 2002 ; 18 : 252-8.
- 3. Berger SL. Histone modifications in transcriptional regulation. Curr Opin Genet Dev 2002 ; 12 : 142-8.
- 4. Klinge CM. Estrogen receptor interaction with co-activators and co-repressors. Steroids 2000 ; 65 : 227-51.
- 5. Metivier R, Penot G, Hubner MR, etal. Estrogen receptor-alpha directs ordered, cyclical, and combinatorial recruitment of cofactors on a natural target promoter. Cell 2003 ; 115: 751-63.
- 6. Li X, Wong J, Tsai SY, et al. Progesterone and glucocorticoid receptors recruit distinct coactivator complexes and promote distinct patterns of chromatin modification. Mol Cell Biol 2003 ; 23 : 3763-73.
- 7. Jenuwein T, Allis CD. Translating the histone code. Science 2001 ; 293 : 1074-9.
- 8. Hassan AH, Neely KE, Workman JL. Histone acetyltransferase complexes stabilize swi/snf binding to promoter nucleosomes. Cell 2001 ; 104 : 817-27.
- 9. Agalioti T, Chen G, Thanos D. Deciphering the transcriptional histone acetylation code for a human gene. Cell 2002 ; 111 : 381-92.
- 10. Vermeulen W, Houtsmuller AB. The transcription cycle in vivo. A blind watchmaker at work. Mol Cell 2002 ; 10 : 1264-6.
List of figures
Figure 1
Cycles transcriptionnels d’un gène contrôlé par les oestrogènes : un assemblage combinatoire mais séquentiel.
A. Expérience de ChIP (immunoprécipitation de la chromatine), mesurant in vivo la permissivité du promoteur pS2 à la liaison du récepteur de l’oestrogène (ER) et au recrutement de la polymérase II (Pol II). Ces mesures mettent en évidence deux types de cycles ; seul le second type permet un recrutement cyclique de la Pol II toutes les 45 minutes. B. Illustration des séquences de recrutement de divers facteurs de transcription dans les deux cycles, et de leur conséquence au niveau de l’organisation chromatinienne du promoteur. Le premier cycle est appelé « initiateur », car il prépare le promoteur à répondre ensuite au niveau transcriptionnel. Dans les deux cas, la dégradation de l’ER par le protéasome termine le cycle. C. Les astérisques rouges indiquent les points où nous avons observé un recrutement combinatoire, c’est-à-dire un recrutement alternatif de protéines ayant la même activité, comme par exemple CARM1 et PRMT1.