Abstracts
Résumé
Le sac endolymphatique constitue l’organe non sensoriel de l’oreille interne. Ses fonctions ne sont pas formellement démontrées. Elles varient probablement selon les espèces. Chez les mammifères, le sac endolymphatique jouerait un rôle dans la régulation du volume et de la pression de l’endolymphe, liquide riche en potassium baignant le pôle apical des cellules sensorielles de l’oreille interne, dans la défense immunitaire de l’oreille interne et dans l’élimination des débris, notamment d’origine cellulaire, présents dans l’endolymphe. Un dysfonctionnement du sac endolymphatique serait impliqué dans certains cas de maladie de Ménière, maladie associant surdité, vertiges et acouphènes, et caractérisée sur le plan histologique par une augmentation du volume du compartiment endolymphatique ou hydrops endolymphatique.
Summary
The endolymphatic sac is a non-sensory organ of the inner ear. It is connected to the endolymphatic compartment that is filled with endolymph, a potassium-rich fluid that bathes the apical side of inner ear sensory cells. The main functions ascribed to the endolymphatic sac are the regulation of the volume and pressure of endolymph, the immune response of the inner ear, and the elimination of endolymphatic waste products by phagocytosis. Functional alteration of these functions, leading to deficient endolymph homeostasis and/or altered inner ear immune response, may participate to the pathophysiology of Ménière’s disease, an inner ear pathology that causes episodes of vertigo, sensorineural hearing loss and tinnitus, and is characterized by an increase in volume of the cochleo-vestibular endolymph (endolymphatic hydrops).
Article body
L’oreille interne, ou labyrinthe membraneux, des mammifères est constituée de plusieurs structures individualisées par leurs fonctions: la cochlée est l’organe de l’audition, le vestibule est celui de l’équilibration. Le vestibule comprend le saccule et l’utricule, les organes otholitiques répondant aux accélérations linéaires, et les canaux semi-circulaires répondant aux accélérations angulaires. En dérivation sur ce système, se trouve le sac endolymphatique, qui est une extension intra-crânienne du labyrinthe membraneux (Figure 1). Les atteintes de la cochlée se traduisent par une surdité, celles du vestibule par des vertiges de type périphérique allant de la simple instabilité au grand vertige rotatoire, souvent rapidement résolutifs du fait des mécanismes de compensation centrale. En ce qui concerne le sac endolymphatique, l’absence de fonctions physiologiques bien définies ainsi que les difficultés de son abord chirurgical en font un organe relativement peu étudié. Un rôle de ce sac dans la survenue de certaines maladies de l’oreille interne comme la maladie de Ménière (associant surdité, vertiges et acouphènes, et évoluant par crises) avait été proposé dès 1926 par G. Portmann. Cet auteur, ayant constaté des troubles du comportement natatoire après cautérisation du sac endolymphatique chez le sélacien, avait postulé l’existence d’un excès de liquide dans l’oreille interne au cours de la maladie de Ménière (hypothèse qui fut confirmée en 1938 par C.S. Hallpikes et H. Cairns) et proposé le drainage chirurgical du sac pour traiter cette maladie.
Figure 1
Schéma des compartiments et composition des différents liquides de l’oreille interne.
La composition de l’endolymphe, liquide contenu à l’intérieur du labyrinthe membraneux (bleu foncé), varie d’un compartiment à l’autre. Dans la cochlée, c’est un liquide dont la composition est proche de celle d’un liquide intracellulaire, pratiquement dépourvu de sodium mais positivement polarisé. Dans le sac endolymphatique, les travaux effectués in vivo à l’aide de microélectrodes à sélectivité ionique ou par dosage ultramicrospectrophotométrique, ont montré que la composition du liquide luminal (toujours appelé endolymphe) est intermédiaire entre celles de l’endolymphe et de la périlymphe [26, 27]. Le potentiel transépithélial mesuré entre les compartiments endolymphatique et périlymphatique est positif dans l’endolymphe, il varie en fonction de l’organe où il est mesuré: + 100 mV dans la cochlée et de + 8 à + 15mV dans le sac endolymphatique. A: ampoule; S: saccule; ST: scala tympani; SV: scala vestibuli; U: utricule.
Le sac endolymphatique: extension intracrânienne du labyrinthe membraneux
La partie proximale du sac endolymphatique est reliée au labyrinthe membraneux vestibulaire par le canal endolymphatique qui chemine dans l’os temporal à l’intérieur d’un canalicule osseux appelé aqueduc vestibulaire (Figure 1). Sa partie distale est logée dans un dédoublement de la dure-mère de la fosse cérébrale postérieure. Chez la plupart des mammifères, le sac endolymphatique possède une lumière unique (Figure 2A); chez les bipèdes, le sac est constitué par un réseau de tubules épithéliaux interconnectés (Figure 2B). L’épithélium du sac est monostratifié (Figure 2C); il est bordé par une membrane basale et entouré par un tissu conjonctif lâche riche en capillaires fenêtrés [1]. La vascularisation du sac dépend des territoires vertébrobasilaire et carotide externe. Le drainage veineux s’effectue par la veine de l’aqueduc du vestibule qui se jette dans le sinus latéral. Le sac endolymphatique est la seule portion de l’oreille interne possédant un drainage lymphatique. Le tissu conjonctif basolatéral est innervé, notamment par des fibres adrénergiques.
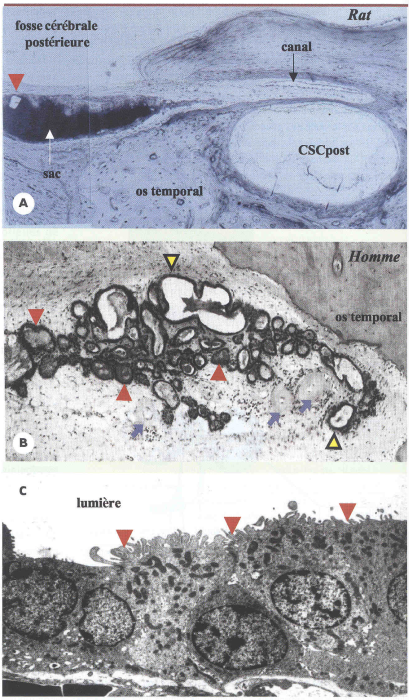
Figure 2
Aspect histologique du sac endolymphatique chez le rat et chez l’homme.
La lumière du sac endolymphatique contient en quantités variables, selon les espèces, des amas de matériel organique granuleux appelé substance homogène. Ce matériel, constitué de protéines, glycoprotéines et glycosaminoglycanes, est synthétisé localement par l’épithélium du sac endolymphatique, stocké sous forme de vésicules intracytoplasmiques et libéré dans la lumière du sac par fusion entre les membranes plasmiques et vésiculaires. Il peut être éliminé par phagocytose par les macrophages présents dans la lumière du sac. Il pourrait intervenir dans certaines fonctions du sac, notamment dans l’homéostasie de l’endolymphe. A. Chez le rat, le sac endolymphatique est constitué par une lumière unique et est totalement rempli de substance homogène (prenant fortement la coloration, en noir). Dans la lumière on distingue également un cristal calcique (tête de flèche rouge). CSCpost: canal semi-circulaire postérieur. B. Chez l’homme, la lumière du sac se présente sous forme d’un système de tubules épithéliaux interconnectés. Certains sont remplis de substance homogène (têtes de flèche rouges), d’autres apparaissent plus ou moins vides (têtes de flèche jaunes). Des vaisseaux sont présents dans le tissu conjonctif, en regard du sac endolymphatique (flèches bleues) (adapté de [28]). C. Microscopie électronique des cellules du sac endolymphatique de souris. Ces cellules possèdent des projections membranaires apicales (têtes de flèche rouges), des replis basolatéraux et des vésicules intracytoplasmiques contenant un matériel organique granuleux. En fonction de leurs caractéristiques morphologiques, plusieurs types cellulaires (cellules claires et sombres) ont été décrits, sans que l’on connaisse les fonctions spécifiques de chacun d’eux.
Anomalies du sac endolymphatique dans la maladie de Ménière
Des anomalies du sac endolymphatique ont été mises en évidence par l’étude histologique et radiologique de rochers de patients atteints de maladie de Ménière. L’examen histologique des rochers de ces patients a mis en évidence une augmentation de volume du compartiment endolymphatique ou hydrops endolymphatique (Figure3), parfois associée à des anomalies du sac endolymphatique. L’anomalie la plus fréquemment observée, tant sur le plan radiologique qu’histologique, est une hypoplasie du sac endolymphatique [2, 3]. Devant l’association hydrops/anomalie du sac, certains auteurs ont proposé un drainage ou une destruction chirugicales du sac endolymphatique afin de corriger son éventuel dysfonctionnement et de stopper ainsi l’évolution de la maladie de Ménière. Malheureusement, du fait de l’extrême sensibilité des vertiges à l’effet placebo de tout traitement, les résultats de la chirurgie du sac endolymphatique sont difficiles à interpréter. Afin de mieux préciser les rapports entre sac endolymphatique et hydrops, des modèles expérimentaux ont été développés dans différentes espèces animales.
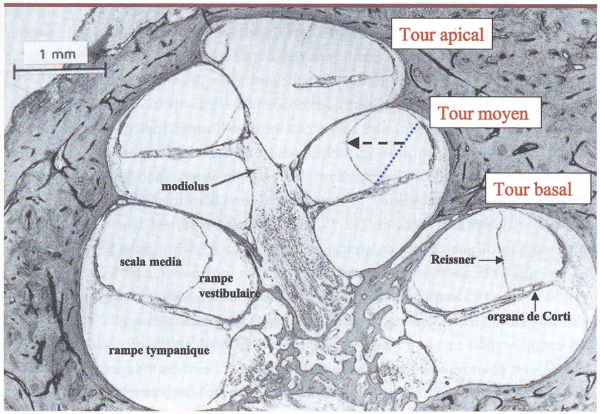
Figure 3
Hydrops endolymphatique au cours de la maladie de Ménière.
Sur une coupe sagittale, la forme en limaçon de la cochlée apparaît clairement. Chez l’homme, la cochlée est enroulée sur deux tours et demi de spire. La distension (flèche en pointillé) de la membrane de Reissner, structure qui sépare les compartiments endolymphatique et périlymphatique, signe l’hydrops endolymphatique. La position normale de la membrane de Reissner est indiquée en trait bleu pointillé au tour moyen de la cochlée (adapté de [29]).
Rôle du sac endolymphatique dans l’homéostasie de l’endolymphe cochléo-vestibulaire
Les cavités limitées par le labyrinthe membraneux sont remplies d’endolymphe, liquide baignant le pôle apical des cellules sensorielles ciliées cochléaires et vestibulaires. L’endolymphe est sécrétée à partir de la périlymphe, liquide qui baigne le pôle basolatéral des cellules ciliées. L’endolymphe est riche en potassium (140-170 mM), pratiquement dépourvue de sodium (1-5mM) (pour revue, voir [4]). Dans la cochlée, son osmolarité est supérieure de 30 à 40 mosm/l à celle du plasma et le potentiel endolymphatique, mesuré de part et d’autre de l’épithélium, est d’environ + 80 mV par rapport à l’espace périlymphatique. Le maintien du volume et de la composition électrochimique de l’endolymphe est essentiel à la transformation des stimulations physiques auditives (sons) et vestibulaires (accélérations) en messages nerveux (transduction mécano-bio-électrique). Toute anomalie de composition, de volume ou de pression de l’endolymphe induit une surdité et/ou des troubles de l’équilibre.
Le rôle du sac endolymphatique dans l’homéostasie de l’endolymphe a été mis en évidence par l’observation d’un hydrops endolymphatique après destruction du sac. Ce rôle a été confirmé par l’étude des modifications des liquides de l’oreille interne et de l’épithélium du sac endolymphatique au cours de l’hyperosmolarité plasmatique.
Hydrops endolymphatique expérimental
Chez le cochon d’Inde, la destruction du sac endolymphatique entraîne dans 100 % des cas le développement d’un hydrops endolymphatique [5]. Cet hydrops s’accompagne d’une surdité de perception initialement fluctuante qui touche les fréquences graves, ainsi que d’altérations de la fonction vestibulaire [6, 7], ces anomalies étant proches de celles observées dans la maladie de Ménière chez l’homme. Des modifications de la composition électrochimique de l’endolymphe (baisse du potentiel transépithélial, augmentation de la concentration du calcium endolymphatique) apparaissent progressivement dans les semaines suivant la destruction du sac [7, 8].
Ce modèle expérimental d’hydrops endolymphatique a fait suggérer l’implication du sac endolymphatique dans la réabsorption de l’endolymphe: c’est la théorie du flux longitudinal d’endolymphe selon laquelle l’endolymphe, sécrétée dans la cochlée et le vestibule, serait réabsorbée par le sac. En accord avec cette hypothèse, des traceurs injectés dans l’endolymphe cochléaire migrent en quelques heures dans la lumière puis dans le compartiment basolatéral des cellules du sac endolymphatique [9]. De plus, la morphologie de l’épithélium du sac (Figure 2) et les systèmes de transport mis en évidence dans cette structure (Figure 4) sont en faveur de l’existence de flux hydro-électrolytiques transépithéliaux. Cependant, à l’état basal chez le cochon d’Inde, le flux longitudinal d’endolymphe est probablement nul, comme l’a montré la mesure de la diffusion endolymphatique d’un traceur de petit poids moléculaire, le tétraméthylammonium, injecté dans l’endolymphe cochléaire par iontophorèse[1], donc sans modification des volume et pression endolymphatiques (pour revue, voir [10]). D’autres hypothèses ont donc été avancées pour rendre compte de l’hydrops induit par l’oblitération du sac endolymphatique. La plus pertinente est la suppression d’une régulation de type hormonal, paracrine ou endocrine, contrôlant les transports ioniques responsables de la sécrétion de l’endolymphe dans la cochlée et le vestibule. En faveur de cette hypothèse, certains aspects histologiques du sac évoquent une fonction endocrine [11]. Par ailleurs, l’injection de broyats de sacs endolymphatiques de rats à d’autres rats modifie la natriurèse des animaux receveurs sans modifier la pression artérielle, le débit de filtration glomérulaire ou la clairance du lithium [12]. Cependant, la nature moléculaire de cette substance reste à déterminer.
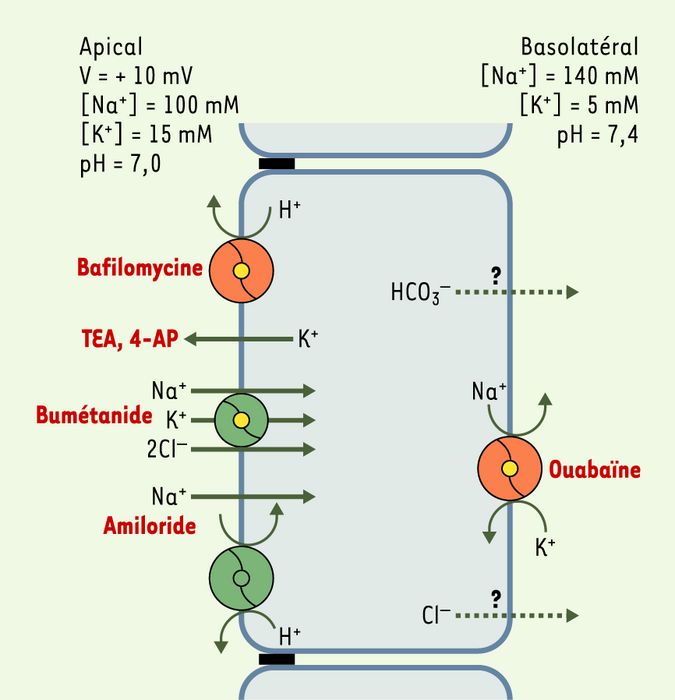
Figure 4
Modèle des transports épithéliaux dans le sac endolymphatique.
Les gradients électrochimiques de Na+ et de K+ de part et d’autre de l’épithélium du sac suggèrent que les flux transépithéliaux passifs de ces ions se font dans le sens d’une sécrétion de Na+ et d’une réabsorption de K+. à l’état stationnaire, ces flux passifs doivent être compensés par des transports actifs de sens opposé. Cette hypothèse est confirmée par la baisse de la concentration luminale de K+ et l’augmentation de celle de Na+ observées lors de l’inhibition des systèmes de transport actif au cours de l’anoxie [30]. Le Na+ serait réabsorbé par l’action conjuguée de transporteurs apicaux, cotransport Na-K-2Cl (inhibé par le bumétanide), échangeur Na+/H+ (inhibé par l’amiloride) et canal Na de type ENaC (epithelial Na channel), et d’une Na+,K+-ATPase basolatérale (inhibée par l’ouabaïne) [31-35]. Le K+ pourrait être sécrété dans la lumière du sac endolymphatique par la Na+,K+-ATPase basolatérale et par une conductance K apicale (inhibée par le tétra-éthyl-ammonium (TEA) et la 4-amino pyridine (4-AP)) [31, 33, 35, 36]. Les flux transépithéliaux d’eau empruntent, du moins en partie, des canaux à eau insérés dans les membranes plasmiques apicales et basolatérales. En effet, les ARN messagers codant pour des canaux à eau de type aquaporines 2, 3 et 4, ont été détectés par RT-PCR dans le sac endolymphatique de rat [17, 37]. Les échanges acido-basiques de part et d’autre de l’épithélium du sac sont assurés par différents enzymes et transporteurs, en particulier une H+-ATPase de type vacuolaire (inhibée par la bafilomycine) et un échangeur Na+/H+ apical ainsi qu’une anhydrase carbonique intracellulaire [27, 33, 38]. Ces systèmes de transports acido-basiques sont responsables de l’acidité du pH luminal du sac endolymphatique (pH 7,0) par rapport au pH physiologique [27, 38]. L’acidité luminale pourrait favoriser l’activation des macrophages flottant dans la lumière du sac [39] et/ou activer certains canaux à eau de type aquaporine [40]. L’isoforme B1 de la sous-unité B de la H+-ATPase apicale du sac endolymphatique est également présente dans la cochlée et dans le tubule rénal distal. Des mutations du gène codant pour cette isoforme entraînent chez l’homme l’association d’une surdité de perception et d’une acidose tubulaire distale rénale [41]. Le rôle de la perte de fonction de la H+-ATPase du sac endolymphatique dans l’étiopathogénie de la surdité reste à déterminer.
Le rôle du sac dans l’homéostasie de l’endolymphe est probablement variable d’une espèce à l’autre. En effet, chez le rat, le chinchilla et le singe-écureuil, l’oblitération du sac endolymphatique n’entraîne pas d’hydrops endolymphatique [13]. Chez l’homme, la destruction du sac endolymphatique présumé normal au cours de voies d’abord neurochirurgicales, n’entraîne pas de troubles audio-vestibulaires [14]. Ces observations suggèrent que, dans certaines espèces, et notamment chez l’homme, un dysfonctionnement du sac ne peut pas rendre compte à lui seul de l’hydrops endolymphatique. Partant de cette hypothèse, des modèles expérimentaux dits «biphasiques» ont cherché à comparer les pourcentages d’hydrops endolymphatiques obtenus chez le cochon d’Inde soit par dysfonctionnement isolé du sac (diminution de la vascularisation et du drainage lymphatique), soit lorsque celui-ci est associé à d’autres perturbations de l’homéostasie de l’endolymphe. Une lésion isolée du sac entraîne un hydrops dans 40 % des cas, alors que ce pourcentage est de 90 % lorsqu’une administration de minéralocorticoïdes est associée [15], ces hormones étant supposées augmenter la sécrétion de l’endolymphe cochléo-vestibulaire.
Réponse du sac endolymphatique à l’hyperosmolarité plasmatique
Au cours de la maladie de Ménière, compte tenu de la présence d’un hydrops endolymphatique, un test diagnostique, le test au glycérol, visant à diminuer l’hydrops endolymphatique par la création d’une hyperosmolarité plasmatique transitoire peut être réalisé. Cette hyperosmolarité diminuerait l’hydrops en entraînant un mouvement d’eau de la périlymphe vers le plasma puis de l’endolymphe vers la périlymphe. Le test est considéré comme positif lorsque l’audition du patient s’améliore une heure après la prise de glycérol. Chez le cochon d’Inde, la diminution du volume d’endolymphe consécutive à l’administration de glycérol n’est observée que lorsque le sac endolymphatique a été préalablement détruit, aucune modification du volume d’endolymphe n’étant observée lorsque le sac est intact. Ce résultat suggère un rôle primordial du sac endolymphatique dans le maintien du volume endolymphatique alors que l’hyperosmolarité plasmatique tend à diminuer ce volume. Deux mécanismes pourraient rendre compte de ce rôle du sac. Le premier est une inhibition de la réabsorption d’endolymphe par le sac sous l’action de l’hormone antidiurétique (ADH), hormone sécrétée en réponse à l’hyperosmoralité. En effet, dans des conditions d’iso-osmolarité plasmatique, l’administration chronique d’ADH chez le cochon d’Inde induit un hydrops endolymphatique dans 70% des cas [17]. La liaison de l’ADH à des récepteurs V2 induirait une diminution de la réabsorption d’endolymphe par le sac en inhibant l’insertion membranaire des aquaporines 2 présentes dans l’épithélium du sac [17]. Le second mécanisme ferait intervenir la sécrétion de substances osmotiquement actives, protéines et glycosaminoglycanes, dans la lumière du sac (voir Figure 2A et 2B), avec pour conséquence une entrée d’eau dans le compartiment endolymphatique [18].
Les autres fonctions du sac endolymphatique
Défense immunitaire de l’oreille interne
L’oreille interne est capable de déclencher des réactions immunitaires et peut être le siège de pathologies auto-immunes. Le sac endolymphatique joue probablement un rôle central dans la réaction immunitaire de l’oreille interne. En effet, le sac est la seule structure de l’oreille interne qui possède des cellules immunocompétentes à l’état basal, c’est-à-dire en dehors de toute stimulation immunitaire [19]. De plus, au cours des labyrinthites expérimentales d’origine immunitaire, le sac endolymphatique est la première structure de l’oreille interne infiltrée par des cellules inflammatoires, et sa destruction diminue considérablement les réactions immunitaires locales de l’oreille interne [19]. Enfin, l’injection de KLH (keyhole limpet hemocyanin) dans la région du sac chez des cochons d’Inde préalablement sensibilisés à cet antigène par voie sous-cutanée, entraîne le développement d’un hydrops endolymphatique [20]. Ce modèle d’hydrops expérimental mime mieux les symptômes de la maladie de Ménière que ne le fait l’oblitération du sac puisqu’il s’accompagne d’un syndrome audio-vestibulaire aigu réversible alors que l’oblitération du sac induit une symptomatologie progressive et définitive.
Élimination de matériels présents dans l’endolymphe
Différents matériels, notamment d’origine cellulaire (membranes plasmiques ou cellules entières), peuvent contaminer le compartiment endolymphatique. Le sac semble être la structure de l’oreille interne spécialisée dans l’élimination de ces matériels, leur phagocytose et leur dégradation étant assurées par les macrophages présents dans la lumière [21].
Des cristaux calciques sont également mis en évidence dans la lumière du sac endolymphatique (voirFigure 2A). Chez l’amphibien, ces cristaux jouent un rôle dans l’équilibre calcique et acido-basique systémique [22]. Chez les mammifères, des cristaux ont été mis en évidence dans la lumière du sac, essentiellement durant la vie foetale [23]. Ils pourraient migrer du sac vers le vestibule et entrer dans la compostition des otoconies, agrégats de cristaux de carbonate de calcium situés au pôle apical des cellules sensorielles de l’utricule et du saccule. Cependant, le confinement des cristaux calciques au fond des cryptes épithéliales du sac, leur forme variable (hexagonale, cylindrique ou rectangulaire), leur petite taille (0,5-1 µm) et leur faible nombre sont contre cette hypothèse. Leur présence chez les mammifères pourrait donc ne représenter qu’un vestige de leur importance fonctionnelle chez les amphibiens.
Conclusions et perspectives
Les travaux expérimentaux effectués sur le sac endolymphatique suggèrent que cet organe participe à divers processus physiologiques de l’oreille interne, à des niveaux différents selon les espèces. Les principales fonctions attribuées au sac sont l’homéostasie de l’endolymphe, la réponse immunitaire de l’oreille interne et l’élimination de débris présents dans l’endolymphe. Les mécanismes et les régulations de ces différentes fonctions commencent à être mieux connus chez le petit animal de laboratoire. Chez l’homme, le mode de fonctionnement du sac endolymphatique et son rôle dans l’étiopathogénie de la maladie de Ménière restent à déterminer. Plusieurs mécanismes non exclusifs peuvent être proposés, en particulier: (1) un excès de sécrétion ou un défaut d’élimination de composés osmotiquement actifs présents dans le compartiment endolymphatique. En faveur de cette hypothèse, la lumière du sac endolymphatique de certains patients atteints de maladie de Ménière est remplie d’un matériel granuleux, probablement formé de protéines et glycosaminoglycanes [2, 24]; (2) une diminution de la réabsorption d’endolymphe liées à des lésions de l’épithélium du sac, notamment dans le cadre de pathologies auto-immunes [25]. Si l’implication du sac endolymphatique au cours de cette maladie humaine est tout à fait probable, la recherche d’autres facteurs déclenchant et/ou entretenant la maladie est nécessaire pour rendre compte de l’évolution par crises de la maladie de Ménière et de l’absence de retentissement audio-vestibulaire après exérèse chirurgicale d’un sac endolymphatique sain.
Appendices
Remerciements
Les auteurs remercient le Professeur Gérard Friedlander pour son soutien permanent et Pascale Borensztein pour les critiques constructives dans l’élaboration du manuscrit.
Note
-
[1]
Méthode utilisant l’application d’un courant électrique (alternatif ou continu) de faible intensité pour augmenter la pénétration tissulaire d’une molécule préférentiellement chargée.
Références
- 1. Dahlmann A, Von Düring M. The endolymphatic duct and sac of the rat: a histological, ultrastructural, and immunocytochemical investigation. Cell Tissue Res 1995; 282: 277-89.
- 2. Hebbar GK, Rask-Andersen H, Linthicum F. Three-dimensional analysis of 61 human temporal bones with and without Meniere’s disease. Ann Otol Rhinol Laryngol 1991; 100: 219-25.
- 3. Welling DB, Clarkson MW, Miles BA, et al. Submillimeter magnetic resonance imaging of the temporal bone in Meniere’s disease. Laryngoscope 1996; 106: 1359-64.
- 4. Ferrary E, Sterkers O. Mechanisms of endolymph secretion. Kidney Int 1998; 53: S98-103.
- 5. Kimura RS, Schuknecht HF. Membranous hydrops of the inner ear of the guinea pig after obliteration of the endolymphatic sac. Pract Otorhinolaryngol 1965; 27: 343-54.
- 6. Andrews JC, Honrubia V. Vestibular function in experimental endolymphatic hydrops. Laryngoscope 1988; 98: 479-85.
- 7. Sziklai I, Ferrary E, Horner KC, et al. Time-related alteration of endolymph composition in an experimental model of endolymphatic hydrops. Laryngoscope 1992; 102: 431-8.
- 8. Salt AN, DeMott J. Endolymph calcium increases with time after surgical induction of hydrops in guinea pigs. Hear Res 1994; 74: 115-21.
- 9. Rask-Andersen H, Bredberg G, Lyttkens L, Loof G. The function of the endolymphatic duct, an experimental study using ionic lanthanum as a tracer: a preliminary report. Ann NY Acad Sci 1981; 374: 11-9.
- 10. Salt AN. Regulation of endolymphatic fluid volume. Ann NY Acad Sci 2001; 942: 306-12.
- 11. Qvortrup K, Rostgaard J, Holstein-Rathlou NH, Bretlau P. The endolymphatic sac, a potential endocrine gland? Acta Otolaryngol (Stockh) 1999; 119: 194-9.
- 12. Qvortrup K, Rostgaard J, Holstein-Rathlou NH. The inner ear produces a natriuretic hormone. Am J Physiol 1996; 270: F1073-7.
- 13. Kimura RS. Fistulae in the membranous labyrinth. Ann Otol Rhinol Laryngol 1984; 112 (suppl): 36-43.
- 14. Prades JM, Martin C, Chelikh L, Merzougui N. Abord rétrolabyrinthique «optimisé». Contribution de l’endoscopie de l’angle ponto-cérébelleux. Ann Otolaryngol Chir Cervicofac 1995; 112: 46-51.
- 15. Dunnebier EA, Segenhout JM, Wit HP, Albers FW. Two-phase endolymphatic hydrops: a new dynamic guinea pig model. Acta Otolaryngol (Stockh) 1997; 117: 13-9.
- 16. Takumida M, Hirakawa K, Harada Y. Effect of glycerol on the guinea pig inner ear after removal of the endolymphatic sac. ORL J Otorhinolaryngol Relat Spec 1995; 57: 5-9.
- 17. Kumagami H, Loewenheim H, Beitz E, et al. The effect of antidiuretic hormone on the endolymphatic sac of the inner ear. Pflugers Arch 1998; 436: 970-5.
- 18. Tian Q, Rask-Andersen H, Linthicum FH Jr. Identification of substances in the endolymphatic sac. Acta Otolaryngol (Stockh) 1994; 114: 632-6.
- 19. Tomiyama S, Harris JP. The endolymphatic sac: its importance in inner ear immune responses. Laryngoscope 1986; 96: 685-91.
- 20. Tomiyama S. Development of endolymphatic hydrops following immune response in the endolymphatic sac of the guinea pig. Acta Otolaryngol (Stockh) 1992; 112: 470-8.
- 21. Jansson B, Rask-Andersen H. Erythrocyte removal and blood clearance in the endolymphatic sac. An experimental and TEM study. Acta Otolaryngol (Stockh) 1996; 116:429-34.
- 22. Guardabassi A. The utilization of the calcareous deposits of the endolymphatic sacs of Bufo Bufo Bufo in the mineralization of the skeleton. Investigations by means of 45Ca. Zeitschrift Zellforschnung 1960; 51: 278-82.
- 23. Yamane H, Imoto T, Nakai Y, et al. Otoconia degradation. Acta Otolaryngol (Stockh) 1984; 406 (suppl): 263-70.
- 24. Thalmann R, Thalmann I. Source and role of endolymph macromolecules. Acta Otolaryngol (Stockh) 1999; 119: 293-6.
- 25. Danckwardt-Lilliestrom N, Friberg U, Kinnefors A, Rask-Andersen H. Endolymphatic sacitis in a case of active Meniere’s disease. An ultrastructural histopathologic investigation. Ann Otol Rhinol Laryngol 1997; 106: 190-8.
- 26. Couloigner V, Teixeira M, Sterkers O, Ferrary E. In vivo study of the electrochemical composition of luminal fluid in the guinea pig endolymphatic sac. Acta Otolaryngol (Stockh) 1999; 119: 200-2.
- 27. Sujikawa S, Yamashita T, Tomoda K, et al. Effects of acetazolamide on acid-base balance in the endolymphatic sac of the guinea pig. Acta Otolaryngol (Stockh) 1993; 500 (suppl): 50-3.
- 28. Linthicum FH. Histopathology of Meniere’s-like conditions. In: Harris JP, ed. Meniere’s disease. The Hague: Kugler Publication, 1999: 53-66.
- 29. Schuknecht HF. Pathology of the ear. Cambridge, USA: Harvard University Press, 1974.
- 30. Mori N, Ninoyu O, Morgenstern C. Cation transport in the ampulla of the semicircular canal and in the endolymphatic sac. Arch Otorhinolaryngol 1987; 244: 61-5.
- 31. Mizukoshi F, Bagger-Sjöbäck D, Rask-Andersen H, Wersall J. Cytochemical localization of Na+,K+-ATPase in the guinea pig endolymphatic sac. Acta Otolaryngol (Stockh) 1988; 105: 202-8.
- 32. Mori N, Wu D. Low-amiloride affinity Na channel in the epithelial cells isolated from the endolymphatic sac of guinea pigs. Pflugers Arch 1996; 43: 58-64.
- 33. Couloigner V, Loiseau A, Sterkers O, et al. Effect of locally applied drugs on the endolymphatic sac potential. Laryngoscope 1998; 108: 592-8.
- 34. Wu D, Mori N. Evidence for the presence of a Na+-H+ exchanger in the endolymphatic sac epithelium of guinea pigs. Pflugers Arch 1998; 436: 182-8.
- 35. Teixeira M, Couloigner V, Loiseau A, et al. Evidence for apical K conductance and Na-K-2Cl cotransport in the endolymphatic sac of guinea pig. Hear Res 1999; 128: 45-50.
- 36. Wu D, Mori N. Outward K+ current in epithelial cells isolated from intermediate portion of endolymphatic sac of guinea pigs. Am J Physiol 1996; 271: C1765-73.
- 37. Beitz E, Kumagami H, Krippeit-Drews P, et al. Expression pattern of aquaporin water channels in the inner ear of the rat. The molecular basis for a water regulation system in the endolymphatic sac. Hear Res 1999; 132: 76-84.
- 38. Couloigner V, Teixeira M, Hulin P, et al. Effect of locally applied drugs on the pH of luminal fluid in the endolymphatic sac of guinea pig. Am J Physiol 2000; 279: R1695-700.
- 39. Bellocq A, Suberville S, Philippe C, et al. Low environmental pH is responsible for the induction of nitric-oxide synthase in macrophages. Evidence for involvement of nuclear factor-kappaB activation. J Biol Chem 1998; 273: 5086-92.
- 40. Zeuthen T, Klaerke DA. Transport of water and glycerol in aquaporin 3 is gated by H+. J Biol Chem 1999; 274: 21631-6.
- 41. Karet FE, Finberg KE, Nelson RD, et al. Mutations in the gene encoding B1 subunit of H+-ATPase cause renal tubular acidosis with sensorineural deafness. Nat Genet 1999; 21:84-90.
List of figures
Figure 1
Schéma des compartiments et composition des différents liquides de l’oreille interne.
La composition de l’endolymphe, liquide contenu à l’intérieur du labyrinthe membraneux (bleu foncé), varie d’un compartiment à l’autre. Dans la cochlée, c’est un liquide dont la composition est proche de celle d’un liquide intracellulaire, pratiquement dépourvu de sodium mais positivement polarisé. Dans le sac endolymphatique, les travaux effectués in vivo à l’aide de microélectrodes à sélectivité ionique ou par dosage ultramicrospectrophotométrique, ont montré que la composition du liquide luminal (toujours appelé endolymphe) est intermédiaire entre celles de l’endolymphe et de la périlymphe [26, 27]. Le potentiel transépithélial mesuré entre les compartiments endolymphatique et périlymphatique est positif dans l’endolymphe, il varie en fonction de l’organe où il est mesuré: + 100 mV dans la cochlée et de + 8 à + 15mV dans le sac endolymphatique. A: ampoule; S: saccule; ST: scala tympani; SV: scala vestibuli; U: utricule.
Figure 2
Aspect histologique du sac endolymphatique chez le rat et chez l’homme.
La lumière du sac endolymphatique contient en quantités variables, selon les espèces, des amas de matériel organique granuleux appelé substance homogène. Ce matériel, constitué de protéines, glycoprotéines et glycosaminoglycanes, est synthétisé localement par l’épithélium du sac endolymphatique, stocké sous forme de vésicules intracytoplasmiques et libéré dans la lumière du sac par fusion entre les membranes plasmiques et vésiculaires. Il peut être éliminé par phagocytose par les macrophages présents dans la lumière du sac. Il pourrait intervenir dans certaines fonctions du sac, notamment dans l’homéostasie de l’endolymphe. A. Chez le rat, le sac endolymphatique est constitué par une lumière unique et est totalement rempli de substance homogène (prenant fortement la coloration, en noir). Dans la lumière on distingue également un cristal calcique (tête de flèche rouge). CSCpost: canal semi-circulaire postérieur. B. Chez l’homme, la lumière du sac se présente sous forme d’un système de tubules épithéliaux interconnectés. Certains sont remplis de substance homogène (têtes de flèche rouges), d’autres apparaissent plus ou moins vides (têtes de flèche jaunes). Des vaisseaux sont présents dans le tissu conjonctif, en regard du sac endolymphatique (flèches bleues) (adapté de [28]). C. Microscopie électronique des cellules du sac endolymphatique de souris. Ces cellules possèdent des projections membranaires apicales (têtes de flèche rouges), des replis basolatéraux et des vésicules intracytoplasmiques contenant un matériel organique granuleux. En fonction de leurs caractéristiques morphologiques, plusieurs types cellulaires (cellules claires et sombres) ont été décrits, sans que l’on connaisse les fonctions spécifiques de chacun d’eux.
Figure 3
Hydrops endolymphatique au cours de la maladie de Ménière.
Sur une coupe sagittale, la forme en limaçon de la cochlée apparaît clairement. Chez l’homme, la cochlée est enroulée sur deux tours et demi de spire. La distension (flèche en pointillé) de la membrane de Reissner, structure qui sépare les compartiments endolymphatique et périlymphatique, signe l’hydrops endolymphatique. La position normale de la membrane de Reissner est indiquée en trait bleu pointillé au tour moyen de la cochlée (adapté de [29]).
Figure 4
Modèle des transports épithéliaux dans le sac endolymphatique.
Les gradients électrochimiques de Na+ et de K+ de part et d’autre de l’épithélium du sac suggèrent que les flux transépithéliaux passifs de ces ions se font dans le sens d’une sécrétion de Na+ et d’une réabsorption de K+. à l’état stationnaire, ces flux passifs doivent être compensés par des transports actifs de sens opposé. Cette hypothèse est confirmée par la baisse de la concentration luminale de K+ et l’augmentation de celle de Na+ observées lors de l’inhibition des systèmes de transport actif au cours de l’anoxie [30]. Le Na+ serait réabsorbé par l’action conjuguée de transporteurs apicaux, cotransport Na-K-2Cl (inhibé par le bumétanide), échangeur Na+/H+ (inhibé par l’amiloride) et canal Na de type ENaC (epithelial Na channel), et d’une Na+,K+-ATPase basolatérale (inhibée par l’ouabaïne) [31-35]. Le K+ pourrait être sécrété dans la lumière du sac endolymphatique par la Na+,K+-ATPase basolatérale et par une conductance K apicale (inhibée par le tétra-éthyl-ammonium (TEA) et la 4-amino pyridine (4-AP)) [31, 33, 35, 36]. Les flux transépithéliaux d’eau empruntent, du moins en partie, des canaux à eau insérés dans les membranes plasmiques apicales et basolatérales. En effet, les ARN messagers codant pour des canaux à eau de type aquaporines 2, 3 et 4, ont été détectés par RT-PCR dans le sac endolymphatique de rat [17, 37]. Les échanges acido-basiques de part et d’autre de l’épithélium du sac sont assurés par différents enzymes et transporteurs, en particulier une H+-ATPase de type vacuolaire (inhibée par la bafilomycine) et un échangeur Na+/H+ apical ainsi qu’une anhydrase carbonique intracellulaire [27, 33, 38]. Ces systèmes de transports acido-basiques sont responsables de l’acidité du pH luminal du sac endolymphatique (pH 7,0) par rapport au pH physiologique [27, 38]. L’acidité luminale pourrait favoriser l’activation des macrophages flottant dans la lumière du sac [39] et/ou activer certains canaux à eau de type aquaporine [40]. L’isoforme B1 de la sous-unité B de la H+-ATPase apicale du sac endolymphatique est également présente dans la cochlée et dans le tubule rénal distal. Des mutations du gène codant pour cette isoforme entraînent chez l’homme l’association d’une surdité de perception et d’une acidose tubulaire distale rénale [41]. Le rôle de la perte de fonction de la H+-ATPase du sac endolymphatique dans l’étiopathogénie de la surdité reste à déterminer.