Abstracts
Résumé
Le récepteur du Ca2+ extracellulaire (CaR), localisé à la membrane de la cellule parathyroïdienne, répond aux fluctuations des ions Ca2+ sériques et contrôle l’homéostasie calcique. Il appartient à la classe III des récepteurs couplés aux protéines G. Son activité est contrôlée par divers ions divalents et trivalents, mais aussi par des molécules endogènes telles que les acides aminés aromatiques de forme L ou la spermine. Le développement de molécules calcimimétiques capables de potentialiser les actions du Ca2+ sur le CaR et de réduire la concentration de la parathormone circulante in vivo, ainsi que des études cliniques récentes, suggèrent qu’il constitue une nouvelle cible thérapeutique pour le traitement des hyperparathyroïdies primaires et secondaires. Les calcilytiques bloquent le CaR et stimulent la sécrétion de parathormone. Ces nouvelles molécules, qui agissent au niveau des sept domaines transmembranaires du CaR, devraient permettre de caractériser les fonctions physiologiques associées au CaR et aux ions Ca2+ extracellulaires dans divers tissus tels que le rein, l’os ou le cerveau.
Summary
The extracellular calcium-sensing receptor (CaR) belongs to class III of G-protein coupled receptors. The CaR is expressed at the surface of the parathyroid cells and plays an essential role in the regulation of Ca2+ homeostasis through the control of parathyroid secretion. The CaR is activated by Ca2+ and Mg2+ present in the extracellular fluids, various di- and trivalent cations, L-aminoacids and charged molecules including several antibiotics. Calcimimetics potentiate the effect of Ca2+ and are proposed to be of therapeutic benefit for the treatment of both primary and secondary hyperparathyroidism. Calcilytics block the Ca2+-induced activation of the CaR. Three-dimensional models of the seven transmembrane domains of the human CaR have been used to identify specific residues implicated in the recognition of calcimimetics and calcilytics. These molecules should be useful for delineating the physiological roles played by the CaR in several tissues and for clarifying the direct effects attributed to extracellular Ca2+.
Article body
La régulation de l’homéostasie calcique dans les milieux extracellulaires est un mécanisme vital pour l’organisme, et de nombreuses fonctions physiologiques sont extrêmement sensibles aux variations de la concentration extracellulaire de Ca2+ (Ca2+ec). L’existence d’un système de régulation de la glande parathyroïde est connue depuis très longtemps. En effet, la sécrétion de la parathormone (PTH), une hormone calciotrope, est contrôlée par les ions Ca2+ présents dans le sérum [1] (Figure 1). La caractérisation moléculaire du mécanisme de détection des variations de Ca2+ à partir de glandes parathyroïdes bovines a permis, en 1993, d’isoler un nouveau membre atypique de la famille de récepteurs couplés aux protéines G, le récepteur des ions Ca2+ extracellulaires (CaR) [2]. Ce récepteur est exprimé par les cellules principales et les cellules C des glandes parathyroïdes et thyroïde, respectivement, où son activation inhibe la sécrétion de PTH et stimule la sécrétion de calcitonine. Dans le rein, le CaR est exprimé sur la membrane basolatérale de la partie corticale ascendante de l’anse de Henlé et, à un niveau plus faible, dans d’autres régions, dont la partie médullaire. Il participerait, au niveau péritubulaire, à l’inhibition exercée par les ions Ca2+ et Mg2+ sur leur réabsorption [1]. La présence du CaR au niveau des terminaisons nerveuses innervant les artères cérébrales, ainsi que sur des sous-populations de neurones sensitifs, suggère qu’il pourrait être impliqué dans le contrôle du tonus vasculaire et de la douleur [1, 3]. Si la présence du CaR a été identifiée dans différents tissus tels que l’estomac, le pancréas, le poumon, l’os ou encore la peau, l’identité du type cellulaire exprimant ce récepteur, ainsi que son rôle fonctionnel, ne sont pas encore clairement établis.
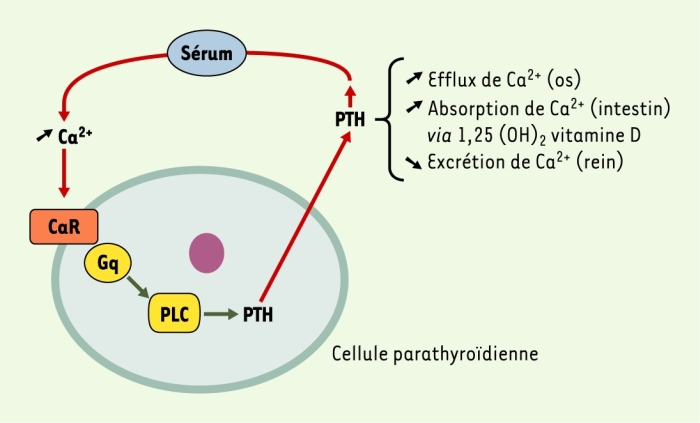
Figure 1
Régulation de la sécrétion de la parathormone (PTH) par les ions Ca2+ sériques.
L’augmentation de la PTH dans le sang se traduit par une libération de Ca2+ à partir des os, une augmentation de sa rétention par les reins et un accroissement de son absorption - notamment intestinale - par action de la 1,25(OH)2 vitamine D. L’ensemble de ces actions contribue à une augmentation de la concentration en Ca2+ ionisé dans le sang, ce qui induit la stimulation du récepteur membranaire du Ca2+ extracellulaire (CaR) présent à la surface des cellules parathyroïdiennes et conduit à la diminution de la sécrétion de PTH. PLC : phospholipase C ; Gq : protéine Gq.
Structure et fonction du CaR
Les récepteurs couplés aux protéines G (RCPG) constituent une vaste famille de protéines membranaires caractérisées par un domaine constitué de sept hélices transmembranaires (heptahélices) délimitant des boucles intra- et extracellulaires. Ces protéines sont activées par des signaux extrêmement variés tels que la lumière, des odeurs, des phéromones, des lipides, des amines, des nucléosides ou encore des polypeptides. Le CaR, qui appartient à la classe III des RCPG (Figure 2A), présente une homologie importante avec les récepteurs métabotropiques du glutamate (mGluR), les récepteurs GABAB et les récepteurs hypothétiques des phéromones et du goût [2, 3]. La plupart de ces récepteurs sont caractérisés par une extrémité extracellulaire aminoterminale de plus de 600 acides aminés (ED) homologue à des protéines périplasmiques chargées, chez la bactérie, de transporter de petites molécules telles que les acides aminés. Ce domaine est composé de deux lobes, LB1 et LB2, qui se ferment après fixation du ligand, un peu comme le piège à mouche de plantes carnivores, ce qui a conduit à appeler ce mécanisme Venus flytrap(Figure 2B). Cette hypothèse a été confirmée après cristallisation du domaine ED du mGluR1 en présence ou en l’absence de glutamate [4]. Dans ce modèle, les deux lobes adoptent une conformation ouverte ou fermée ; le glutamate est piégé entre les deux lobes et stabilise la conformation fermée. Cette modification structurale conduirait à l’activation du récepteur par l’intermédiaire du domaine heptahélice connecté aux deux lobes par une région riche en cystéines [5].
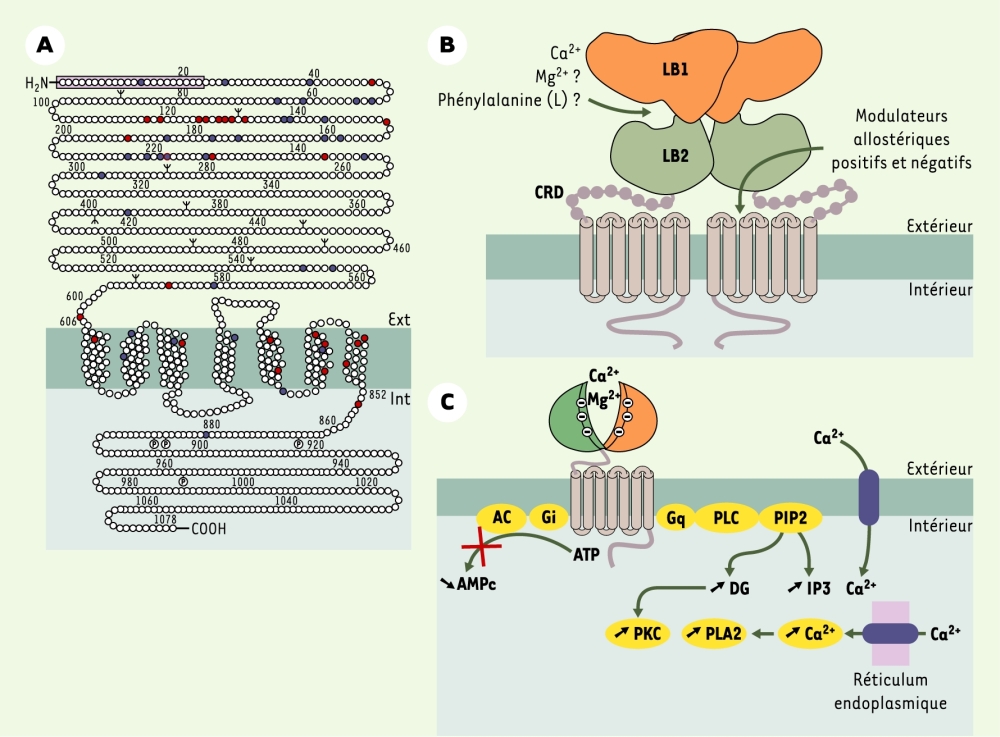
Figure 2
Structure et signalisation du récepteur du Ca2+ extracellulaire (CaR).
A. Topologie du récepteur humain : le CaR présente une longue extrémité aminoterminale (le peptide signal est représenté en violet), sept domaines hydrophobes caractéristiques des récepteurs couplés aux protéines G et une extrémité carboxyterminale intracellulaire. Les sites consensus de phosphorylation (P) des protéines kinases A et C et les sites de glycosylation potentiels (Ψ) sont indiqués. Les mutations induisant une perte (bleu foncé) ou un gain (rouge) de fonction associées respectivement à des hypocalcémies ou à des hypercalcémies chez l’homme sont représentées (voir [8] et http://www.casrdb.mcgill.ca/). B. Le CaR existe sous forme d’homodimères : par analogie avec le mGluR1, les deux domaines LB1 et LB2 forment une poche dans laquelle interagiraient les ions Ca2+ et, peut-être, les ions Mg2+ (qui sont aussi des ligands physiologiques du CaR) et les acides aminés aromatiques de forme L. Parmi les acides aminés du domaine ED du CaR homologues de ceux impliqués dans la liaison du glutamate dans le mGluR1, certains, tels que les sérines 147, 170 et l’aspartate 190, participeraient également à la liaison du Ca2+ [8]. Ce domaine Venus flytrap se fermerait en présence de Ca2+ et transmettrait le signal au domaine heptahélice par l’intermédiaire d’un domaine riche en cystéines (CRD). Le domaine heptahélice contient les sites de liaison de modulateurs allostériques positifs (calcimimétiques) et négatifs (calcilytiques) de synthèse. Il n’existe pas encore de molécules de synthèse modulant l’activité du CaR au niveau du domaine Venus flytrap, comme c’est le cas pour les récepteurs mGluR. C. Voies de signalisations associées au CaR et étudiées après expression de son ADNc dans des cellules eucaryotes. PLA2, PLC : phospholipases A2 et C ; PKC : protéine kinase C ; PIP2 : phosphatidylinositol bisphosphate ; Gi, Gq : protéines Gi, Gq ; AC : adénylate cyclase ; DG : diacylglycérol ; IP3 : inositol triphosphate.
Chez l’homme, des mutations induisant un gain ou une perte de fonction du CaR sont responsables de maladies génétiques graves, qui provoquent des hypocalcémies (hypocalcémie familiale dominante) ou des hypercalcémies (hypercalcémie hypocalciurique familiale et hyperparathyroïdie néonatale sévère) [6, 7]. Ces mutations, dont plus de soixante ont déjà été identifiées, sont principalement localisées dans le domaine ED, mais aussi dans les sept segments hydrophobes et les boucles intra- et extracytoplasmiques (Figure 2A) [8]. La modélisation de ces mutations par mutagenèse dirigée et l’analyse fonctionnelle des récepteurs mutés, après transfection transitoire dans des cellules eucaryotes, ont permis de montrer soit une baisse de l’affinité du CaR pour le Ca2+ dans le cas de mutations inhibitrices, soit une augmentation de cette affinité dans le cas de mutations activatrices. Outre l’intérêt thérapeutique que représente l’identification de ces mutations chez des patients atteints d’hypo- ou d’hypercalcémie, ces études contribuent à une meilleure compréhension des mécanismes biochimiques contrôlant l’activation de ce récepteur.
Un récepteur atypique activé par le Ca2+ et le Mg2+ extracellulaires
L’activation du CaR dans des cellules surexprimant ce récepteur stimule la voie des phospholipases C (PLC), D et A2 conduisant à la mobilisation de seconds messagers intracellulaires tels que le Ca2+, l’inositol triphosphate, le diacylglycérol, ou encore les arachidonates (Figure 2C). Le CaR serait également couplé à une diminution de l’accumulation d’AMPc, ainsi qu’à l’activation des MAP-kinases (mitogen activated protein-kinases) [1]. La mobilisation de Ca2+ intracellulaire ou l’accumulation d’inositol phosphate qui résultent de l’activation de la PLC sont les réponses biochimiques le plus souvent associées à l’activité du CaR. La plupart de ces signaux avaient été observés après ajout de Ca2+ à des cellules de parathyroïdes bovines, au cours d’expériences qui suggéraient déjà l’existence d’un CaR [9]. Les ions Ca2+ stimulent le CaR dans une gamme de concentrations allant de 0,5 mM à 10 mM. Dans des modèles expérimentaux de cellules transfectées avec le CaR, la concentration efficace (CE50) conduisant à la moitié de l’effet maximal des réponses biochimiques décrites ci-dessus se situe à 3,5 mM. Par comparaison, la CE50 du Ca2+ vis-à-vis de l’inhibition de la sécrétion de PTH dans des cultures de cellules de parathyroïdes bovines est voisine de 1,3 mM [9], une concentration proche de la concentration physiologique du Ca2+ ionisé dans le sérum [1]. Les courbes d’activation par les ions Ca2+ indiquent une coopérativité très élevée, qui pourrait s’expliquer par la présence de plusieurs sites de liaison [4] des ions Ca2+ sur le CaR [10], ou encore par la dimérisation de deux monomères [11]. Ces données expérimentales sont en accord avec l’un des rôles physiologiques de ce récepteur, le contrôle extrêmement précis de l’homéostasie calcique.
Modulation de l’activité du CaR dans les tissus
Le CaR est stimulé par d’autres ions divalents (Mg2+, strontium…) ou trivalents (gadolinium…), à des concentrations allant de 10 μM à 100 μM. Il est intéressant de noter que l’administration prolongée de ranélate de strontium diminue le risque de fracture vertébrale chez la femme postménopausée présentant des signes d’ostéoporose [12] : le mode d’action de ce composé pourrait faire intervenir des CaR distribués sur les cellules telles que les ostéoblastes, chargées du remodelage osseux [1]. L’expression du CaR dans différentes régions du cerveau chez l’adulte, et notamment au niveau des terminaisons nerveuses [3], a conduit à l’étude des mécanismes pouvant moduler son activité dans le système nerveux central. Les ions Ca2+ ou les peptides β-amyloïdes induisent l’activation de canaux calciques non sélectifs dans les neurones de l’hippocampe de souris [13] - une réponse attribuée à l’activation du CaR - mais doit cependant être confirmée en utilisant des outils pharmacologiques sélectifs.
Des molécules basiques chargées, telles que la spermine ou la spermidine, présentes dans différents tissus, mais aussi certains antibiotiques comme la néomycine, souvent utilisée dans les tests de sélection des lignées cellulaires en laboratoire, stimulent le CaR en agissant comme des polycations organiques [1]. Les acides aminés aromatiques (phénylalanine, tyrosine…) de forme L, à des concentrations compatibles avec celles trouvées dans le sang (2 mM à 5 mM), augmentent la sensibilité du Ca2+ pour le CaR [14]. Leur site d’action sur le CaR pourrait être voisin de celui des ions Ca2+(Figure 2B) et ferait notamment intervenir la sérine 170 [15]. Ces observations pourraient en partie expliquer l’influence de la consommation quotidienne de protéines sur l’homéostasie calcique, et l’hypercalcémie souvent associée aux régimes hyperprotidiques. Chez les patients phénylcétonuriques, la toxicité cérébrale (et notamment des défauts de myélinisation dont sont responsables les oligodendrocytes) pourrait être liée à l’augmentation de la concentration en phénylalanine dans le liquide cérébrospinal et à l’activation inappropriée du CaR oligodendrocytaire [14, 16].
Les composés calcimimétiques de synthèse
Les molécules activant le CaR sont appelées calcimimétiques (agonistes). Cependant, il convient de distinguer les molécules stimulant le récepteur en l’absence de Ca2+ec (calcimimétiques de classe I) et celles se conduisant comme des modulateurs allostériques (calcimimétiques de classe II) [17]. La phénylalkylamine NPS R-568 et le composé indolique Calindol, appartenant à deux familles chimiques différentes, sont considérées comme des calcimimétiques de classe II (Figure 3). Ces molécules organiques de faible poids moléculaire présentent une affinité comparable pour le CaR (~0,1 µM) [18-20]. Elles déplacent la courbe dose-réponse du Ca2+ vers la gauche et ne présentent pas d’activité significative vis-à-vis du CaR en l’absence de Ca2+. La phénylalanine et d’autres acides aminés aromatiques de forme L peuvent être considérés comme des calcimimétiques de classe II, puisque leur activité dépend du Ca2+.
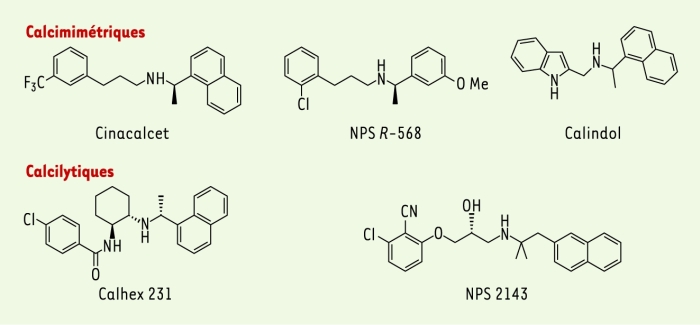
Figure 3
Structure de composés calcimimétiques et calcilytiques.
Le Cinacalcet, un calcimimétique de deuxième génération analogue au NPS R-568 (Figure 3), a été utilisé avec succès afin de normaliser la concentration de Ca2+ sérique chez des patients atteints d’hyperparathyroïdie primaire et secondaire. Les résultats expérimentaux et cliniques de l’utilisation des calcimimétiques sont l’objet d’une revue détaillée dans ce numéro de médecine/sciences ((→) m/s 2004, n° 11, p. 973).
Les composés calcilytiques
Les calcilytiques (antagonistes) inhibent l’activation du CaR par le Ca2+. Contrairement à celle des calcimimétiques, l’identification de ces molécules s’est révélée beaucoup plus difficile. Le composé NPS 2143 (Figure 3), premier calcilytique décrit dans la littérature, bloque le CaR présent sur la cellule parathyroïdienne et conduit à une augmentation de la sécrétion de PTH in vivo chez le rat [21]. Plus récemment, le composé Calhex 231, présentant une activité calcilytique proche de celle du NPS 2143, mais de structure différente, a été identifié [22]. L’activité de ces calcilytiques vis-à-vis du CaR dépend elle aussi du Ca2+ extracellulaire [22, 23].
Divers études cliniques ont suggéré que des augmentations intermittentes de PTH et de ses dérivés actifs chez des hommes et des femmes atteints d’ostéoporose permettaient de remodeler l’os en augmentant ses propriétés mécaniques et sa masse [24]. L’utilisation de calcilytiques permettant d’obtenir un pic sérique de PTH relativement court résultant d’un blocage du CaR parathyroïdien résoudrait les problèmes liés à la synthèse et à l’administration de ces molécules peptidiques. Cependant, si l’intérêt thérapeutique des calcilytiques apparaît évident, il conviendra encore d’identifier et de démontrer l’efficacité in vivo de telles molécules, qui devront augmenter la densité minérale osseuse, un paramètre qui n’a pas été modifié lors des premiers essais menés avec le composé NPS 2143 [21].
Identification d’un site de liaison des calcilytiques dans le domaine heptahélice du CaR
La cristallisation de la rhodopsine bovine a permis d’obtenir un modèle du domaine heptahélice de la classe I des RCPG [25], utilisé par la suite comme référence pour proposer un modèle théorique de celui du CaR, un récepteur éloigné appartenant à la classe III. L’analyse tridimensionnelle de ce modèle a ainsi permis d’observer la présence de deux poches délimitées par des acides aminés localisés sur la face externe des domaines transmembranaires, faisant face au milieu extracellulaire de la cellule et dans lesquelles viendrait interagir le Calhex 231 (Figure 4A). Ces poches font intervenir des acides aminés appartenant aux domaines transmembranaires (TM) 1, 2, 3 et 7 pour l’une d’entre elle, et aux domaines TM 3, 5 et 6 pour la deuxième, suggérant de nombreux sites d’interaction de ce composé avec le récepteur. La validation de ce modèle a été obtenue en réalisant l’analyse fonctionnelle de récepteurs présentant une mutation d’acides aminés appartenant à ces poches [22]. Le Calhex 231 n’antagonise plus, ou seulement difficilement, l’activation de ces récepteurs mutés exprimés transitoirement dans des cellules eucaryotes, comme l’indiquent les résultats d’un test biochimique mettant en jeu l’activation de la PLC liée à la transduction du CaR.
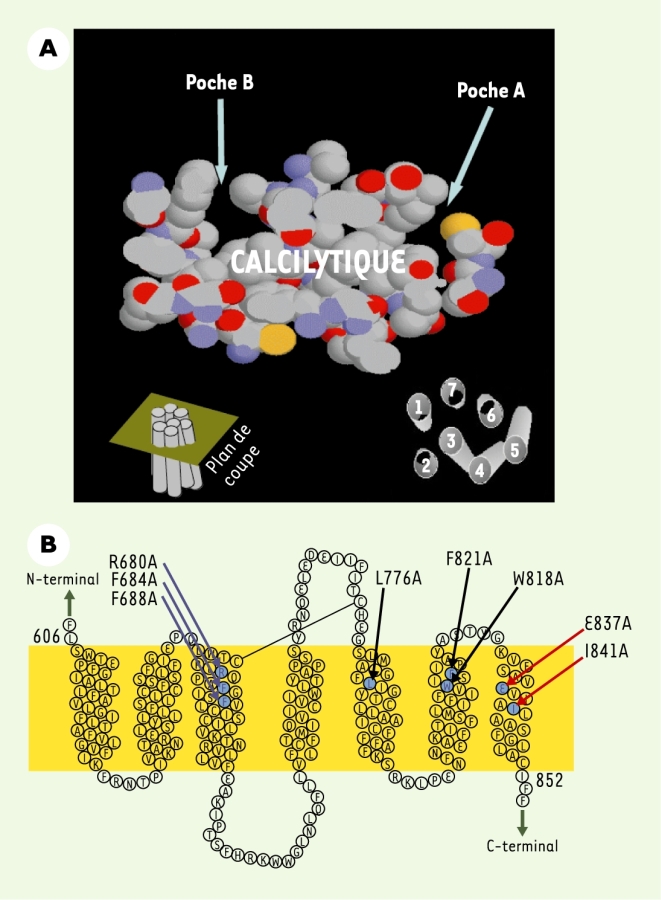
Figure 4
Les composés calcimimétiques et calcilytiques de synthèse interagissent au niveau du domaine heptahélice du CaR.
A. Un modèle du domaine heptahélice du CaR humain a été construit à partir des données cristallographiques de la rhodopsine bovine (pdb 1f88) à l’aide du mode GPCR de swissmodel (http://www.expasy.org/swissmod/SWISS-MODEL.html). Deux poches sont identifiées, dans lesquelles viennent interagir les calcilytiques Calhex 231 et NPS 2143. Vue de dessus passant par le plan de coupe indiqué en bas à gauche. La disposition des domaines transmembranaire est indiquée en bas à droite. Les atomes formant les poches sont indiqués par des sphères (carbone : blanc ; oxygène : rouge ; azote : bleu ; soufre : jaune). B. Topologie du domaine heptahélice du CaR humain. En couleur, sont indiquées les mutations ayant permis la mise en évidence de certains acides aminés impliqués dans la reconnaissance à la fois des calcimimétiques (Calindol et NPS R-568) et des calcilytiques (Calhex 231 et NPS 2143) (rouge), des deux calcilytiques seulement (bleu) ou uniquement du Calhex 231 (noir).
Ce premier modèle a ensuite servi à identifier les sites de reconnaissance du NPS 2143. Ce composé se loge également dans les deux poches décrites ci-dessus et interagit avec plusieurs résidus impliqués dans la reconnaissance du Calhex 231. Cependant, des différences dans le mode de liaison de ces deux molécules existent. Par exemple, la mutation en alanine du résidu arginine 680 (R680A) localisé dans le TM 3 facilite la liaison du Calhex 231, alors qu’elle provoque une perte d’affinité pour le NPS 2143 (Figure 4B). Des résultats analogues ont été obtenus pour le NPS 2143, par une deuxième équipe [26].
Le site de liaison des calcimimétiques de classe II n’est pas identique à celui des calcilytiques
Au cours des dernières années, plusieurs études ont permis de localiser le site d’interaction du NPS R-568 au niveau du domaine heptahélice et ont souligné l’importance du glutamate 837 (E837) du TM 7 dans la liaison de ce composé [27, 28]. Parmi les acides aminés impliqués dans la reconnaissance des deux calcilytiques Calhex 231 et NPS 2143, seuls des résidus localisés dans les TM 6 et 7 interviendraient dans la liaison des deux calcimimétiques Calindol et NPS R-568 (Figure 4B) [20]. Les courbes d’activation du CaR par le Ca2+ sont normalement décalées vers la gauche en présence de ces calcimimétiques. Cette potentialisation n’est plus observée lorsque des mutations affectent les résidus E837 et isoleucine 841 localisés dans le TM 7, par exemple. Dans le domaine TM 6, le Calindol interagirait plus spécifiquement avec le tryptophane 818, et le NPS R-568 avec la phénylalanine 821, deux acides aminés souvent conservés parmi les RCPG et probablement importants pour maintenir les RCPG de la classe I dans un état inactif. Ces travaux font apparaître que les sites de liaison de modulateurs allostériques positifs et négatifs de synthèse localisés au niveau du domaine heptahélice se recouvrent partiellement, mais ne sont pas identiques.
Conclusions
Le développement de calcimimétiques et de calcilytiques sélectifs, de forte affinité et de différentes structures, devrait permettre de caractériser les fonctions associées au CaR dans les tissus où son expression a été identifiée. En effet, les réponses attribuées au CaR ont souvent été observées en présence de cations divalents ou de calcimimétiques non sélectifs ou de faible affinité, et l’utilisation d’un antagoniste pour bloquer ces réponses n’a été réalisée que très rarement du fait de l’identification encore récente de ces composés. Ces études devraient permettre de vérifier l’existence de nouveaux mécanismes sensibles aux ions Ca2+ [1], mais ceci est une autre histoire…
Appendices
Remerciements
Nous remercions Robert Dodd, Phillipe Dauban, Albane Kessler, Didier Rognan, Hélène Faure, Sandrine Ferry et Elisabeth Traiffort pour les nombreuses discussions et leur contribution lors de la réalisation de travaux cités dans cet article. C.P. est soutenu par une bourse de 3e année de thèse de l’ARC.
Références
- 1. Brown EM, MacLeod RJ. Extracellular calcium sensing and extracellular calcium signaling.Physiol Rev 2001 ; 81 : 239-97.
- 2. Brown EM, Camba G, Riccardi D, et al. Cloning and characterization of an extracellular Ca2+-sensing receptor from bovine parathyroid.Nature 1993 ; 366 : 575-80.
- 3. Ruat M, Molliver ME, Snowman AM, Snyder SH. Calcium sensing receptor : molecular cloning in rat and localization to nerve terminals.Proc Natl Acad Sci USA 1995 ; 92 : 3161-5.
- 4. Kunishima N, Schimada Y, Tsuji Y, et al. Structural basis of glutamate recognition by a dimeric metabotropic glutamate receptor.Nature 2000 ; 407 : 971-7.
- 5. Pin JP, Galvez T, Prezeau L. Evolution, structure and activation mechanism of family 3/C G-protein-coupled receptors.Ther Pharmacol 2003 ; 98 : 325-54.
- 6. Pollak MR, Brown EM, Chou YH, et al. Mutations in the human Ca2+-sensing receptor gene cause familial hypocalciuric hypercalcemia and neonatal severe hyperparathyroidism.Cell 1993 ; 75 : 1297-303.
- 7. Pollak MR, Brown EM, Estep HL, et al. Autosomal dominant hypocalcaemia caused by a Ca2+-sensing receptor gene mutation.Nat Genet 1994 ; 8 : 303-7.
- 8. Hu J, Spiegel AM. Naturally occurring mutations of the extracellular Ca2+-sensing receptor : implications for its structure and function.Trends Endocrinol Metab 2003 ; 14 : 282-8.
- 9. Shoback D, Thatcher J, Leombruno R, Brown E. Effects of extracellular Ca++ and Mg++ on cytosolic Ca++ and PTH release in dispersed bovine parathyroid cells.Endocrinology 1983 ; 113 : 424-6.
- 10. Ruat M, Snowman AM, Hester LD, Snyder SH. Cloned and expressed rat Ca2+-sensing receptor.J Biol Chem 1996 ; 271 : 5972-5.
- 11. Zhang Z, Sun S, Quinn SJ, et al. The extracellular calcium-sensing receptor dimerizes through multiple types of intermolecular interactions.J Biol Chem 2001 ; 2000 : 7.
- 12. Meunier PJ, Roux C, Seeman E, et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis.N Engl J Med 2004 ; 350 : 459-68.
- 13. Ye CP, Ho-Pao Cl, Kanazirska M, et al. Amyloid-beta proteins activate Ca2+-permeable annels through calcium-sensing receptors.J Neurosci Res 1997 ; 7 : 547-54.
- 14. Conigrave AD, Quinn SJ, Brown EM. L-amino acid sensing by the extracellular Ca2+-sensing receptor.Proc Natl Acad Sci USA 2000 ; 97 : 4814-9.
- 15. Zhang Z, Qiu W, Quinn SJ, et al. Three adjacent serines in the extracellular domains of the CaR are required for L-amino acid-mediated potentiation of receptor function.J BiolChem 2002 ; 277 : 33727-35.
- 16. Ferry S, Traiffort E, Stinnakre J, Ruat M. Developmental and adult expression of rat calcium-sensing receptor transcripts in neurons and oligodendrocytes.Eur J Neurosci 2000 ; 12 : 872-84.
- 17. Nemeth EF. Pharmacological regulation of parathyroid hormone secretion.Curr PharmDes 2002 ; 8 : 2077-87.
- 18. Ferry S, Chatel B, Dodd RH, et al. Effects of divalent cations and of a calcimimetic on adrenocorticotropic hormone release in pituitary tumor cells.Biochem Biophys Res Commun 1997 ; 238 : 866-73.
- 19. Nemeth EF, Steffey ME, Hammerland LG, et al. Calcimimetics with potent and selective activity on the parathyroid calcium receptor.Proc Natl Acad Sci USA 1998 ; 95 : 4040-45.
- 20. Petrel C, Kessler A, Dauban P, et al. Positive and negative allosteric modulators of the Ca2+-sensing receptor interact within overlapping but not identical binding sites in the transmembrane domain.J Biol Chem 2004 ; 279 : 18990-7.
- 21. Gowen M, Stroup GB, Dodds RA, et al. Antagonizing the parathyroid calcium receptor stimulates parathyroid hormone secretion and bone formation in osteopenic rats.J ClinInvest 2000 ; 105 : 1595-604.
- 22. Petrel C, Kessler A, Malash F, et al. Modeling and mutagenesis of the binding site of Calhex 231, a novel negative allosteric modulator of the extracellular Ca2+-sensing receptor.J Biol Chem 2003 ; 278 : 49487-94.
- 23. Nemeth EF,Delmar EG, Heaton WL, et al. Calcilytic compounds: Potent and selective Ca2+ receptor antagonists that stimulate secretion of parathyroid hormone.J Pharmacol ExpTher 2001 ; 299 : 323-31.
- 24. Seeman E, Delmas PD. Reconstructing the skeleton with intermittent parathyroid hormone. Trends Endocrinol Metab 2001 ; 12 : 281-3.
- 25. Palczewski K, Kumasaka T, Hori T, et al. Crystal structure of rhodopsin : a G protein-coupled receptor.Science 2000 ; 289 : 739-45.
- 26. Miedlich SU, Gama l, Seuwen K, et al. Homology modeling of the transmembrane domain of the human calcium sensing receptor and localization of an allosteric binding site.J BiolChem 2004 ; 279 : 7254-63.
- 27. Ray K, Northup J. Evidence for distinct cation and calcimimetic compound (NPS 568) recognition domains in the transmembrane regions of the human Ca2+ receptor.J Biol Chem 2002 ; 277 : 18908-13.
- 28. Hu J, Reyes-Cruz G, Chen W, et al. Identification of acidic residues in the extracellular loops of the seven-transmembrane domain of the human Ca2+ receptor critical for response to Ca2+ and a positive allosteric modulator.J Biol Chem 2002 ; 277 : 46622-31.
List of figures
Figure 1
Régulation de la sécrétion de la parathormone (PTH) par les ions Ca2+ sériques.
L’augmentation de la PTH dans le sang se traduit par une libération de Ca2+ à partir des os, une augmentation de sa rétention par les reins et un accroissement de son absorption - notamment intestinale - par action de la 1,25(OH)2 vitamine D. L’ensemble de ces actions contribue à une augmentation de la concentration en Ca2+ ionisé dans le sang, ce qui induit la stimulation du récepteur membranaire du Ca2+ extracellulaire (CaR) présent à la surface des cellules parathyroïdiennes et conduit à la diminution de la sécrétion de PTH. PLC : phospholipase C ; Gq : protéine Gq.
Figure 2
Structure et signalisation du récepteur du Ca2+ extracellulaire (CaR).
A. Topologie du récepteur humain : le CaR présente une longue extrémité aminoterminale (le peptide signal est représenté en violet), sept domaines hydrophobes caractéristiques des récepteurs couplés aux protéines G et une extrémité carboxyterminale intracellulaire. Les sites consensus de phosphorylation (P) des protéines kinases A et C et les sites de glycosylation potentiels (Ψ) sont indiqués. Les mutations induisant une perte (bleu foncé) ou un gain (rouge) de fonction associées respectivement à des hypocalcémies ou à des hypercalcémies chez l’homme sont représentées (voir [8] et http://www.casrdb.mcgill.ca/). B. Le CaR existe sous forme d’homodimères : par analogie avec le mGluR1, les deux domaines LB1 et LB2 forment une poche dans laquelle interagiraient les ions Ca2+ et, peut-être, les ions Mg2+ (qui sont aussi des ligands physiologiques du CaR) et les acides aminés aromatiques de forme L. Parmi les acides aminés du domaine ED du CaR homologues de ceux impliqués dans la liaison du glutamate dans le mGluR1, certains, tels que les sérines 147, 170 et l’aspartate 190, participeraient également à la liaison du Ca2+ [8]. Ce domaine Venus flytrap se fermerait en présence de Ca2+ et transmettrait le signal au domaine heptahélice par l’intermédiaire d’un domaine riche en cystéines (CRD). Le domaine heptahélice contient les sites de liaison de modulateurs allostériques positifs (calcimimétiques) et négatifs (calcilytiques) de synthèse. Il n’existe pas encore de molécules de synthèse modulant l’activité du CaR au niveau du domaine Venus flytrap, comme c’est le cas pour les récepteurs mGluR. C. Voies de signalisations associées au CaR et étudiées après expression de son ADNc dans des cellules eucaryotes. PLA2, PLC : phospholipases A2 et C ; PKC : protéine kinase C ; PIP2 : phosphatidylinositol bisphosphate ; Gi, Gq : protéines Gi, Gq ; AC : adénylate cyclase ; DG : diacylglycérol ; IP3 : inositol triphosphate.
Figure 3
Structure de composés calcimimétiques et calcilytiques.
Figure 4
Les composés calcimimétiques et calcilytiques de synthèse interagissent au niveau du domaine heptahélice du CaR.
A. Un modèle du domaine heptahélice du CaR humain a été construit à partir des données cristallographiques de la rhodopsine bovine (pdb 1f88) à l’aide du mode GPCR de swissmodel (http://www.expasy.org/swissmod/SWISS-MODEL.html). Deux poches sont identifiées, dans lesquelles viennent interagir les calcilytiques Calhex 231 et NPS 2143. Vue de dessus passant par le plan de coupe indiqué en bas à gauche. La disposition des domaines transmembranaire est indiquée en bas à droite. Les atomes formant les poches sont indiqués par des sphères (carbone : blanc ; oxygène : rouge ; azote : bleu ; soufre : jaune). B. Topologie du domaine heptahélice du CaR humain. En couleur, sont indiquées les mutations ayant permis la mise en évidence de certains acides aminés impliqués dans la reconnaissance à la fois des calcimimétiques (Calindol et NPS R-568) et des calcilytiques (Calhex 231 et NPS 2143) (rouge), des deux calcilytiques seulement (bleu) ou uniquement du Calhex 231 (noir).